9.7: Молекулярні форми
- Page ID
- 22584
- Визначте форму простих молекул.
Молекули мають форми. Існує велика кількість експериментальних доказів цього ефекту, від їх фізичних властивостей до їх хімічної реакційної здатності. Малі молекули - молекули з одним центральним атомом - мають форми, які можна легко передбачити. Основою молекулярних форм називається валентна оболонка відштовхування електронної пари (VSEPR). VSEPR говорить, що електронні пари, будучи складеної з негативно заряджених частинок, відштовхують один одного, щоб дійти якомога далі один від одного. VSEPR робить різницю між геометрією електронної групи, яка виражає, як розташовані електронні групи (зв'язки та незв'язні електронні пари), та молекулярною геометрією, яка виражає, як розташовані атоми в молекулі. Однак дві геометрії пов'язані між собою.
Існує два типи електронних груп: будь-який тип зв'язку - одинарний, подвійний або потрійний - і одинокі електронні пари. При застосуванні VSEPR до простих молекул перше, що потрібно зробити, це підрахувати кількість електронних груп навколо центрального атома. Пам'ятайте, що множинний зв'язок вважається лише однією групою електронів.
Будь-яка молекула, що має лише два атоми, є лінійною. Молекула, центральний атом якої містить лише дві електронні групи, орієнтує ці дві групи якомога далі один від одного - на 180° один від одного. Коли дві електронні групи знаходяться на відстані 180° один від одного, атоми, прикріплені до цих електронних груп, також знаходяться на відстані 180° один від одного, тому загальна молекулярна форма є лінійною. Приклади включають BeH 2 і CO 2:

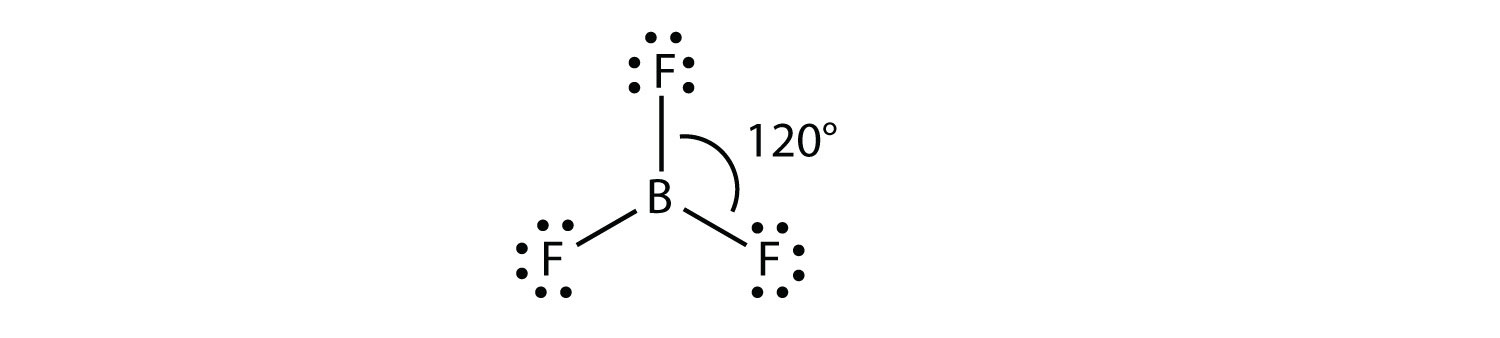
Молекула з трьома електронними групами орієнтує три групи якомога далі один від одного. Вони приймають положення рівностороннього трикутника—120° один від одного і в площині. Форма таких молекул тригональна плоска. Прикладом може служити БФ 3:
Деякі речовини мають тригональний планарний розподіл електронної групи, але мають атоми, пов'язані лише з двома з трьох електронних груп. Прикладом може служити ФГОС 2:
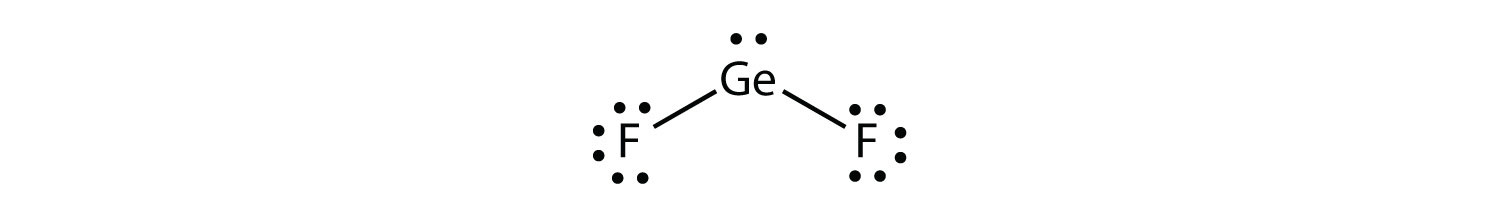
З точки зору геометрії електронної групи GeF 2 має тригональну плоску форму, але її реальна форма продиктована положеннями атомів. Таку форму називають зігнутою або незграбною.
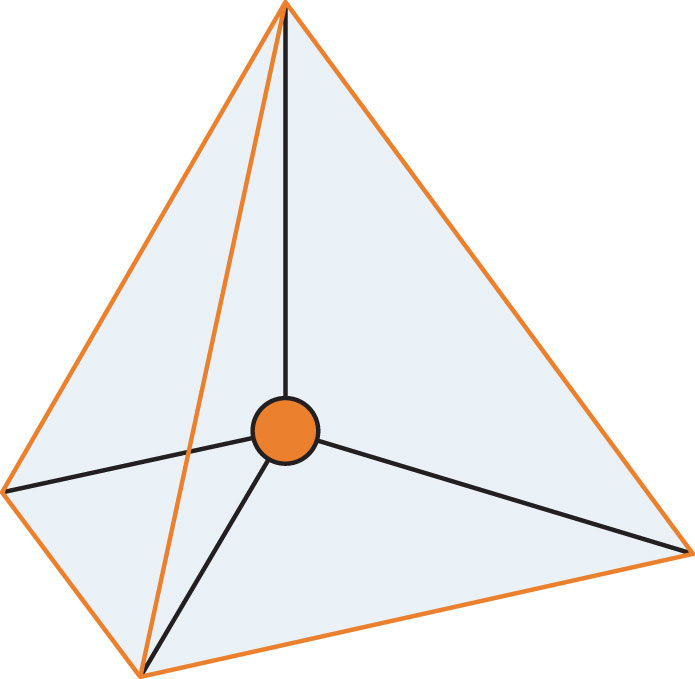
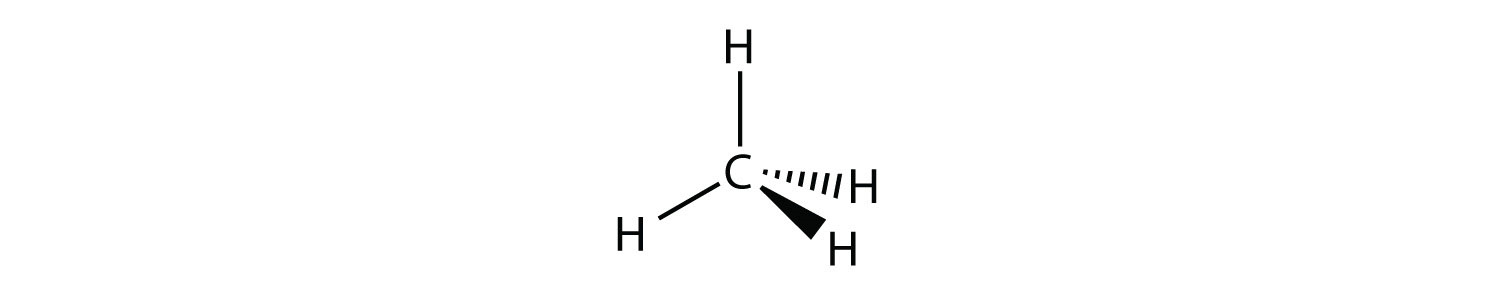
Молекула з чотирма електронними групами навколо центрального атома орієнтує чотири групи у напрямку тетраедра, як показано на малюнку\(\PageIndex{1}\): Тетраедрична геометрія. Якщо до цих електронним групам приєднані чотири атоми, то молекулярна форма теж тетраедрична. Метан (СН 4) - приклад.
Ця діаграма СН 4 ілюструє стандартну умовність відображення тривимірної молекули на двовимірній поверхні. Прямі лінії знаходяться в площині сторінки, суцільна клинова лінія виходить з площини до читача, а пунктирна клинова лінія виходить з площини далеко від читача.
NH 3 є прикладом молекули, центральний атом якої має чотири електронні групи, але тільки три з них пов'язані з оточуючими атомами.
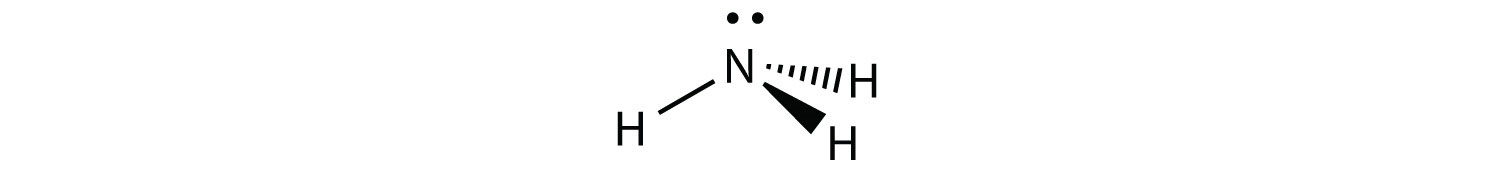
Хоча електронні групи орієнтовані у формі тетраедра, з точки зору молекулярної геометрії форма NH 3 тригональна пірамідальна.
Н 2 О є прикладом молекули, центральний атом якої має чотири групи електронів, але тільки дві з них пов'язані з оточуючими атомами.
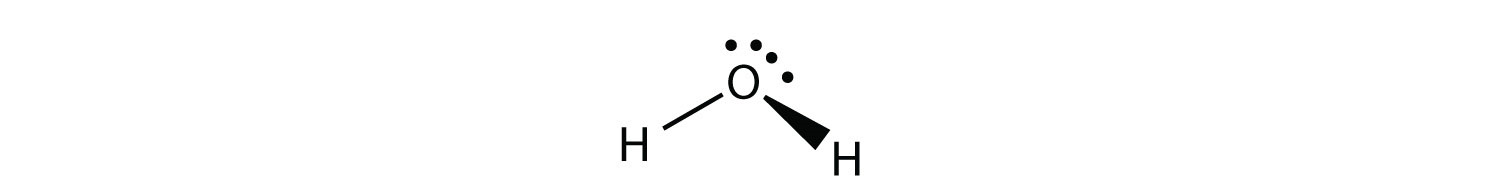
Хоча електронні групи орієнтовані у формі тетраедра, форма молекули вигнута або кутова. Молекула з чотирма електронними групами близько центрального атома, але лише одна електронна група, пов'язана з іншим атомом, є лінійною, оскільки в молекулі всього два атоми.
Подвійні або потрійні зв'язки зараховують як одну електронну групу. CH 2 O має наступну електронну точкову діаграму Льюїса.
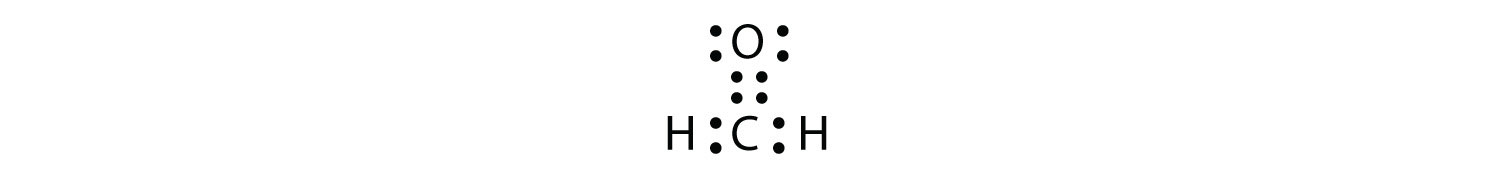
Центральний атом С має три електронні групи навколо нього, оскільки подвійний зв'язок вважається однією групою електронів. Три електронні групи відштовхуються один від одного, щоб прийняти тригональну плоску форму:
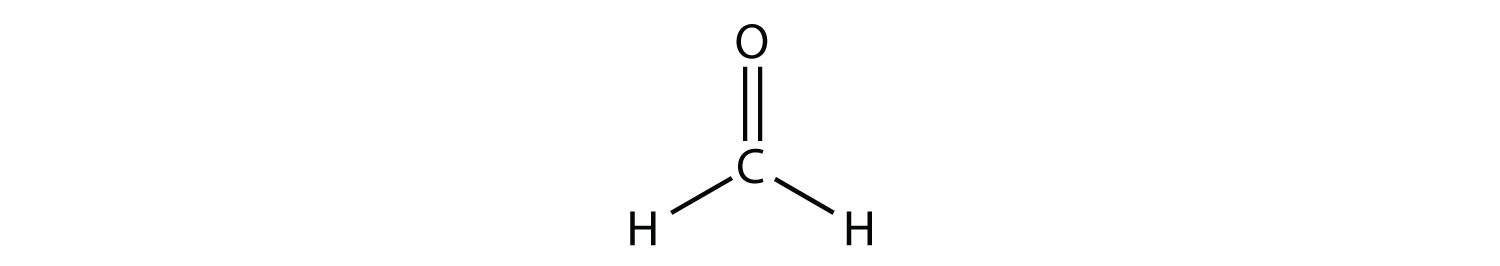
(Одинокі електронні пари на атомі O опущені для наочності.) Молекула не буде ідеальним рівностороннім трикутником, оскільки подвійний зв'язок С—О відрізняється від двох зв'язків С—Н, але як плоска, так і трикутна описують відповідну приблизну форму цієї молекули.
Яка приблизна форма кожної молекули?
- \(\ce{PCl3}\)
- \(\ce{NOF}\)
Рішення
Перший крок - намалювати електронну точкову діаграму Льюїса молекули.
а:
Для pCl 3 електронна точка діаграма виглядає наступним чином:

Самотні електронні пари на атомах Cl опущені для наочності. Атом Р має чотири електронні групи, три з яких пов'язані з оточуючими атомами, тому молекулярна форма тригональна пірамідна.
б:
Електронна точкова діаграма для NOF виглядає наступним чином:
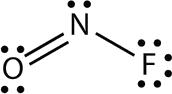
Атом N має на ньому три електронні групи, дві з яких пов'язані з іншими атомами. Молекулярна форма вигнута.
Що таке приблизна молекулярна форма\(\ce{CH2Cl2}\)?
- Відповідь
-
Тетраедричний
Таблиця\(\PageIndex{1}\) узагальнює форми молекул на основі їх кількості електронних груп і оточуючих атомів.
| Кількість електронних груп на центральному атомі | Кількість навколишніх атомів | Молекулярна форма |
|---|---|---|
| будь-який | 1 | лінійний |
| 2 | 2 | лінійний |
| 3 | 3 | тригональний площинний |
| 3 | 2 | зігнутий |
| 4 | 4 | чотиригранний |
| 4 | 3 | трикутна пірамідальна |
| 4 | 2 | зігнутий |
Резюме
Приблизну форму молекули можна передбачити за кількістю електронних груп і кількості оточуючих атомів.
