9.6: Порушення правила октету
- Page ID
- 22574
- Визнати три основних типи порушень правила октета.
Настільки ж важливим і корисним, як правило октета при хімічному зв'язуванні, є деякі відомі порушення. Це не означає, що правило октету марне - зовсім навпаки. Як і у багатьох правилах, є винятки, або порушення.
Існує три порушення правила октета. Молекули непарних електронів є першим порушенням правила октета. Хоча їх небагато, деякі стабільні сполуки мають непарну кількість електронів в своїх валентних оболонках. При непарній кількості електронів хоча б одному атому в молекулі доведеться порушувати правило октета. Прикладами стабільних непарних електронів молекул є\(\ce{NO}\)\(\ce{NO2}\), і\(\ce{ClO2}\). Електронна точкова діаграма\(\ce{NO}\) Льюїса для виглядає наступним чином:
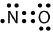
Хоча\(\ce{O}\) атом має октет електронів,\(\ce{N}\) атом має лише сім електронів у своїй валентній оболонці. Хоча\(\ce{NO}\) є стабільною сполукою, вона дуже хімічно реактивна, як і більшість інших непарно-електронних сполук.
Електрон-дефіцитні молекули є другим порушенням октетного правила. Ці стабільні сполуки мають менше восьми електронів навколо атома в молекулі. Найбільш поширеними прикладами є ковалентні сполуки берилію і бору. Наприклад, берилій може утворювати дві ковалентні зв'язку, в результаті чого в його валентній оболонці утворюється всього чотири електрона:
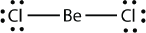
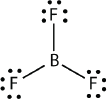
Бор зазвичай робить лише три ковалентні зв'язки, в результаті чого навколо\(\ce{B}\) атома утворюється лише шість валентних електронів. Відомим прикладом є\(\ce{BF3}\):
Третє порушення октетного правила виявляється в тих сполуках з більш ніж вісьмома електронами, присвоєними їх валентної оболонці. Вони називаються молекулами розширеної валентної оболонки. Такі сполуки утворюються тільки центральними атомами в третьому ряду таблиці Менделєєва або за його межами, які мають в своїх валентних оболонках порожні d орбіталі, які можуть брати участь в ковалентному зв'язку. Одним з таких з'єднань є\(\ce{PF5}\). Єдина розумна електронна точкова діаграма Льюїса для цієї сполуки має\(\ce{P}\) атом, що утворює п'ять ковалентних зв'язків:

Формально\(\ce{P}\) атом має в своїй валентній оболонці 10 електронів.
Визначте кожне порушення правила октету, намалювавши електронну точкову діаграму Льюїса.
- \(\ce{ClO}\)
- \(\ce{SF6}\)
Рішення
- З одним атомом Cl і одним атомом O ця молекула має 6 + 7 = 13 валентних електронів, тому вона являє собою непарну електронну молекулу. Електронна точкова діаграма Льюїса для цієї молекули виглядає наступним чином:
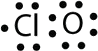
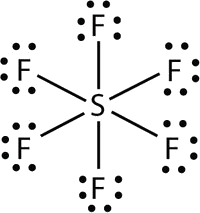
- В\(\ce{SF6}\), центральний\(\ce{S}\) атом робить шість ковалентних зв'язків з шістьма оточуючими атомами F, тому це розширена молекула валентної оболонки. Його електронна точкова діаграма Льюїса виглядає наступним чином:
Визначте порушення правила октету,\(\ce{XeF2}\) намалювавши електронну точкову діаграму Льюїса.
- Відповідь
-
Атом Xe має розширену валентну оболонку з більш ніж вісьмома електронами навколо нього.
.

Резюме
Існує три порушення правила октету: непарні електронні молекули, молекули з дефіцитом електронів та молекули розширеної валентної оболонки.
