9.3: Перенесення електронів - іонні зв'язки
- Page ID
- 22576
Цілі навчання
- Викладіть правило октета.
- Визначте іонний зв'язок.
- Продемонструйте перенесення електронів між атомами з утворенням іонних зв'язків.
У розділі 9.2 ми бачили, як іони утворюються, втрачаючи електрони для створення катіонів, або шляхом отримання електронів для утворення аніонів. Проникливий читач, можливо, щось помітив: багато утворюються іонів мають вісім електронів у своїй валентній оболонці. Або атоми отримують достатньо електронів, щоб мати вісім електронів у валентній оболонці і стати відповідним чином зарядженим аніоном, або вони втрачають електрони в початковій валентній оболонці. У разі втрати електронів нижня оболонка, тепер валентна оболонка, має в ній вісім електронів; тому атом стає позитивно зарядженим. З якоїсь причини наявність восьми електронів в валентній оболонці є особливо енергетично стійким розташуванням електронів. Тенденція, що атоми люблять мати вісім електронів у своїй валентній оболонці, називається правилом октету. Коли атоми утворюють сполуки, правило октету не завжди задовольняється для всіх атомів у будь-який час, але це дуже гарне правило для розуміння видів зв'язків, які можуть зробити атоми.
Порушити правило октета не можна. Розглянемо натрій: в своїй елементарній формі він має один валентний електрон і стабільний. Однак він досить реактивний і не вимагає багато енергії, щоб видалити цей електрон, щоб зробити іон Na +. Ми могли б видалити інший електрон, додавши ще більше енергії до іона, щоб зробити іон Na 2 +. Однак для цього потрібно набагато більше енергії, ніж зазвичай є в хімічних реакціях, тому натрій зупиняється при заряді 1+ після втрати одного електрона. Виходить, що іон Na + має повний октет в своїй новій валентної оболонці, оболонку n = 2, яка задовольняє правилу октета. Правило октету є результатом тенденцій енергій і корисно для пояснення того, чому атоми утворюють іони, які вони роблять.
Розглянемо атом Na в присутності атома Cl. Два атоми мають ці електронні точкові діаграми Льюїса та електронні конфігурації:
\[\mathbf{Na\, \cdot }\; \; \; \; \; \; \; \; \; \; \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
\[\left [ Ne \right ]3s^{1}\; \; \; \; \left [ Ne \right ]3s^{2}3p^{5}\nonumber \]
Щоб атом Na отримав октет, він повинен втратити електрон; щоб атом Cl отримав октет, він повинен отримати електрон. Електрон переноситься від атома Na до атома Cl:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
в результаті чого два іони - іон Na + та іон Cl −:
\[\mathbf{Na\, \cdot }^{+}\; \; \; \; \; \; \; \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\nonumber \]
\[\left [ Ne \right ]\; \; \; \; \; \left [ Ne \right ]3s^{2}3p^{6}\nonumber \]
Обидва види тепер мають повні октети, а електронні оболонки енергетично стабільні. З базової фізики ми знаємо, що протилежні заряди притягують. Ось що відбувається з іонами Na + та Cl −:
\[\mathbf{Na\, \cdot }^{+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\rightarrow Na^{+}Cl^{-}\; \; or\; \; NaCl\nonumber \]
де ми написали остаточну формулу (формулу хлориду натрію) відповідно до конвенції для іонних сполук, не перераховуючи звинувачення явно. Тяжіння між протилежно зарядженими іонами називається іонної зв'язком, і вона є одним з основних видів хімічних зв'язків в хімії. Іонні зв'язки викликані електронами, що переходять від одного атома до іншого.
При перенесенні електронів кількість втрачених електронів має дорівнювати кількості отриманих електронів. Ми бачили це в утворенні NaCl. Подібний процес відбувається між атомами Mg і O атомами, за винятком цього випадку переносяться два електрони:
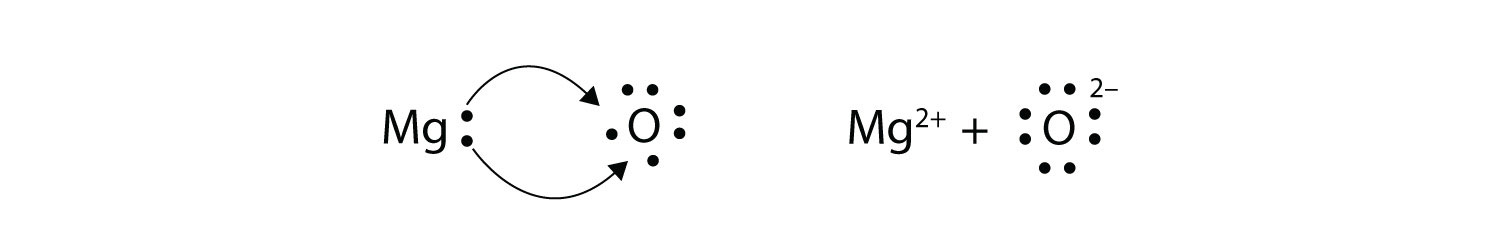
Два іони мають октети як валентну оболонку, а дві протилежно заряджені частинки притягуються, утворюючи іонний зв'язок:
\[\mathbf{Mg\,}^{2+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}O}}\mathbf{\: :}^{2-}\; \; \; \; \; Mg^{2+}O^{2-}\; or\; MgO\nonumber \]
Пам'ятайте, в підсумковій формулі для іонного з'єднання ми не записуємо заряди на іони.
А як щодо того, коли атом Na взаємодіє з атомом O? Атому O потрібні два електрони, щоб завершити свій валентний октет, але атом Na постачає лише один електрон:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.}O}}\mathbf{\: :}\nonumber \]
Атом O все ще не має октету електронів. Нам потрібен другий атом Na, щоб подарувати другий електрон атому O:
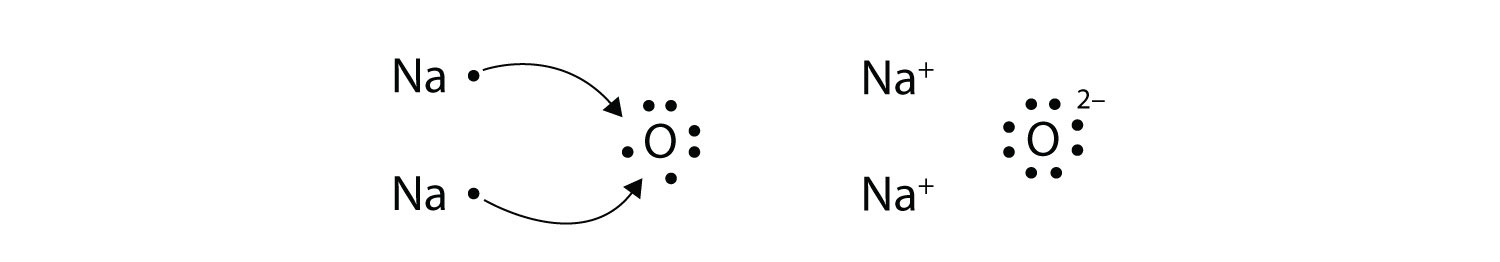
Ці три іони притягуються один до одного, утворюючи загальну нейтрально заряджену іонну сполуку, яку ми пишемо як Na 2 O. Необхідність кількості втрачених електронів дорівнювала кількості отриманих електронів пояснює, чому іонні сполуки мають відношення катіонів до аніонів, що вони роблять. Цього також вимагає закон збереження матерії.
Приклад\(\PageIndex{1}\)
Стрілками проілюструйте перенесення електронів з утворенням хлориду кальцію з атомів Ca і Cl атомів.
Рішення
Атом Ca має два валентні електрони, тоді як атом Cl має сім електронів. Атому Cl потрібен лише один, щоб завершити свій октет, тоді як атоми Ca мають два електрони, щоб втратити. Нам потрібні два атоми Cl, щоб прийняти два електрони з одного атома Ca. Процес перенесення виглядає наступним чином:
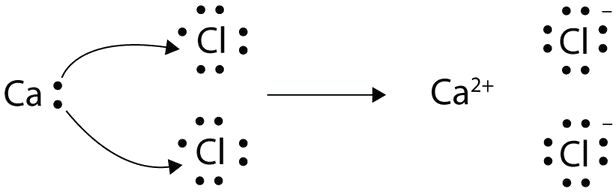
Протилежно заряджені іони притягують один одного, щоб зробити CaCl 2.
Вправа\(\PageIndex{1}\)
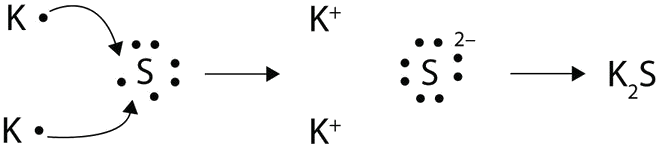
Стрілками проілюструйте перенесення електронів з утворенням сульфіду калію від атомів K і атомів S.
- Відповідь
-
Міцність іонного зв'язку залежить від двох основних характеристик: величини зарядів і розміру іона. Чим більше величина заряду, тим міцніше іонний зв'язок. Чим менше іон, тим сильніше іонний зв'язок (оскільки менший розмір іонів дозволяє іонам зблизитися). Виміряна міцність іонного зв'язку називається енергією решітки. Деякі енергії решітки наведені в таблиці\(\PageIndex{1}\) - Енергії решітки деяких іонних сполук.
| З'єднання | Енергія решітки (кДж/моль) |
|---|---|
| ЛіФ | 1 036 |
| LicL | 853 |
| NaCl | 786 |
| NaBr | 747 |
| МГФ 2 | 2 957 |
| Na 2 О | 2 481 |
| MgO | 3 791 |
Хімія всюди: Сіль
Елемент натрій (частина [а] на супровідному малюнку) є дуже реактивним металом; з огляду на можливість, він вступить в реакцію з потом на руках і утворює гідроксид натрію, який є дуже їдким речовиною. Елемент хлор (частина [b] на супровідному малюнку) являє собою блідо-жовтий агресивний газ, який не повинен вдихатися через його отруйної природи. З'єднайте ці дві небезпечні речовини разом, однак, і вони реагують, щоб зробити іонну сполуку хлорид натрію (частина [c] на супровідному малюнку), відому просто як сіль.

Сіль необхідна для життя. Іони Na + є одним з основних іонів в організмі людини і необхідні для регулювання балансу рідини в організмі. Іони Cl − необхідні для правильної роботи нервів та дихання. Обидва ці іони постачаються сіллю. Смак солі - один з основних смаків; сіль - це, мабуть, найдавніший ароматизатор, відомий, і одна з небагатьох порід, яку ми їмо.
Вплив занадто великої кількості солі для здоров'я все ще обговорюється, хоча у звіті Міністерства сільського господарства США за 2010 рік зроблено висновок, що «надмірне споживання натрію... підвищує кров'яний тиск, добре прийнятий і надзвичайно поширений фактор ризику інсульту, ішемічної хвороби серця та захворювань нирок» ( Комітет Міністерства сільського господарства США з питань політики харчування та просування, доповідь Консультативного комітету з дієтичних керівних принципів щодо дієтичних рекомендацій для американців, доступ до січня 5, 2010). Зрозуміло, що більшість людей вживають більше солі, ніж потрібно їх організму, і більшість дієтологів рекомендують стримувати споживання солі. Цікаво, що люди, які страждають низьким вмістом солі (званої гіпонатрією), роблять це не тому, що вживають занадто мало солі, а тому, що п'ють занадто багато води. Спортсмени витривалості та інші, що беруть участь у тривалих напружених фізичних вправах, повинні стежити за споживанням води, щоб вміст солі їх тіла не розбавлений до небезпечних рівнів.
Резюме
- Тенденція до утворення видів, що мають вісім електронів в валентній оболонці, називається правилом октета.
- Притягання протилежно заряджених іонів, викликане перенесенням електронів, називається іонним зв'язком.
- Міцність іонного зв'язку залежить від величини зарядів і розмірів іонів.
