8.6: Періодичні тенденції
- Вміти констатувати, як змінюються певні властивості атомів залежно від їх взаємного положення на таблиці Менделєєва.
Одна з причин того, що таблиця Менделєєва настільки корисна, полягає в тому, що її структура дозволяє якісно визначити, як змінюються деякі властивості елементів відповідно до їх положення на таблиці Менделєєва. Варіації властивостей відповідно до позицій на таблиці Менделєєва називаються періодичними тенденціями. У науці немає іншого інструменту, який би дозволив нам судити про відносні властивості такого класу об'єктів, що робить періодичну таблицю дуже корисним інструментом. Багато періодичні тенденції носять загальний характер. Може бути кілька моментів, де спостерігається протилежна тенденція, але існує загальна тенденція, якщо розглядати весь рядок або вниз по всьому стовпцю періодичної таблиці.
Перша періодична тенденція, яку ми розглянемо, - атомний радіус. Атомний радіус є вказівкою розміру атома. Хоча поняття певного радіуса атома трохи нечітке, атоми поводяться так, ніби вони мають певний радіус. Такі радіуси можна оцінити з різних експериментальних методів, таких як рентгенівська кристалографія кристалів.
Коли ви опускаєтеся вниз по стовпчику таблиці Менделєєва, атомні радіуси збільшуються. Це пов'язано з тим, що валентна електронна оболонка стає більшою і є більша основне квантове число, тому валентна оболонка лежить фізично далі від ядра. Цю тенденцію можна узагальнити наступним чином:
\[as\downarrow PT,atomic\; radius \uparrow\nonumber \]
де PT розшифровується як таблиця Менделєєва. Переходячи ряд на таблиці Менделєєва, зліва направо, тенденція інша. Це тому, що хоча валентна оболонка підтримує однакове основне квантове число, кількість протонів - а отже, і ядерний заряд - збільшується, коли ви переходите по ряду. Зростаючий позитивний заряд кидає жорсткіше зчеплення валентних електронів, тому, коли ви переходите по таблиці Менделєєва, атомні радіуси зменшуються. Знову ж таки, ми можемо узагальнити цю тенденцію наступним чином:
as→PT,atomicradius↓
8.6.1На малюнку показані сфери, що представляють атоми s і p блоків з періодичної таблиці до масштабу, показуючи дві тенденції для атомного радіуса.
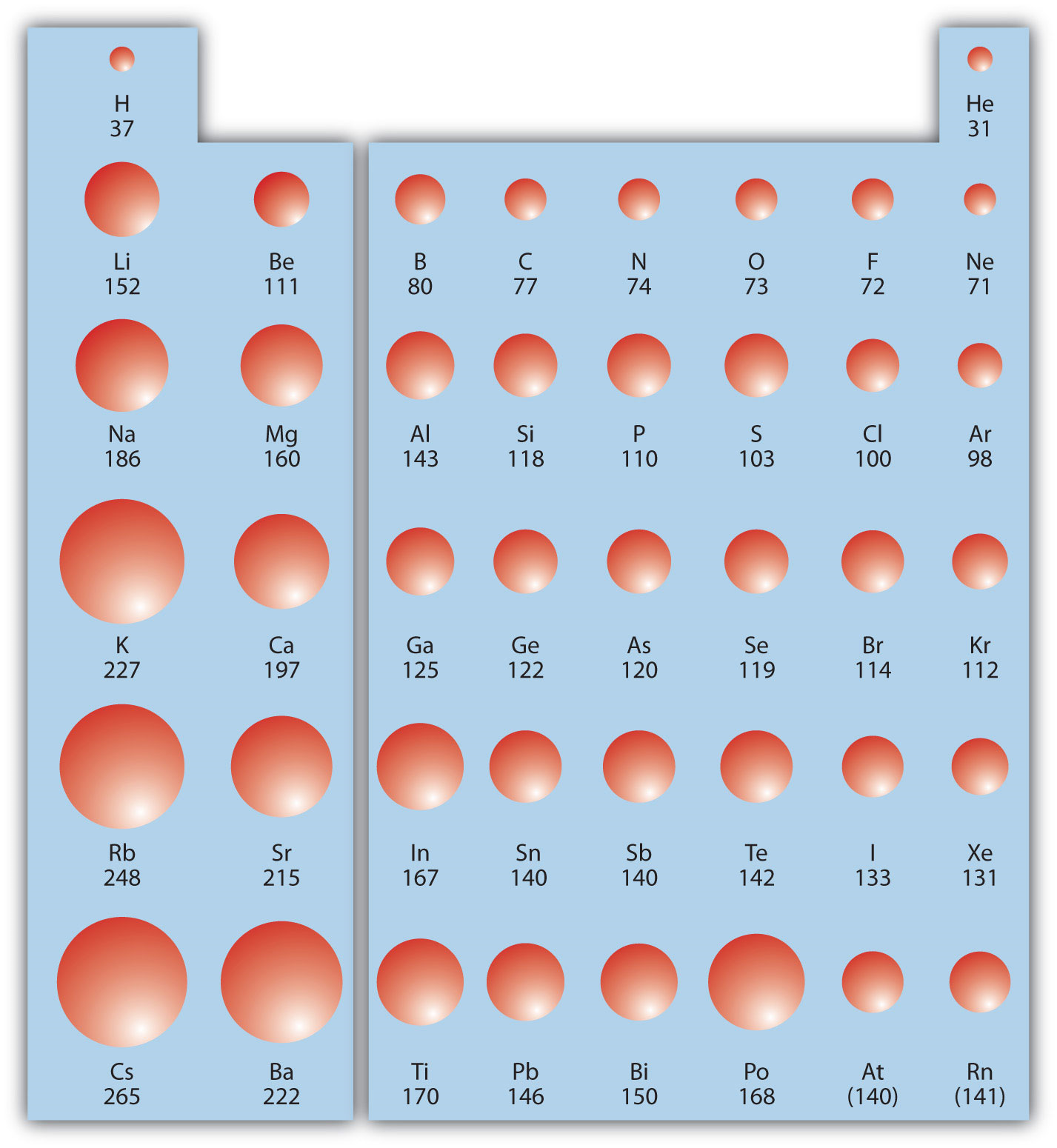
Посилаючись лише на таблицю Менделєєва, а не до малюнка8.6.1, який атом більший у кожній парі?
- Si або S
- S або Te
Рішення
- Si знаходиться ліворуч від S на періодичній таблиці, тому вона більша, тому що, коли ви йдете по ряду, атоми стають меншими.
- S знаходиться вище Te на періодичній таблиці, тому Te більше, тому що, коли ви йдете вниз по колонці, атоми стають більшими.
Посилаючись лише на таблицю Менделєєва, а не до малюнка8.6.1, який атом менший, Ca або Br?
Відповідь
Br
Енергія іонізації (ІЕ) - це кількість енергії, необхідної для видалення електрона з атома в газовій фазі:
A(g)→A+(g)+e−ΔH≡IE
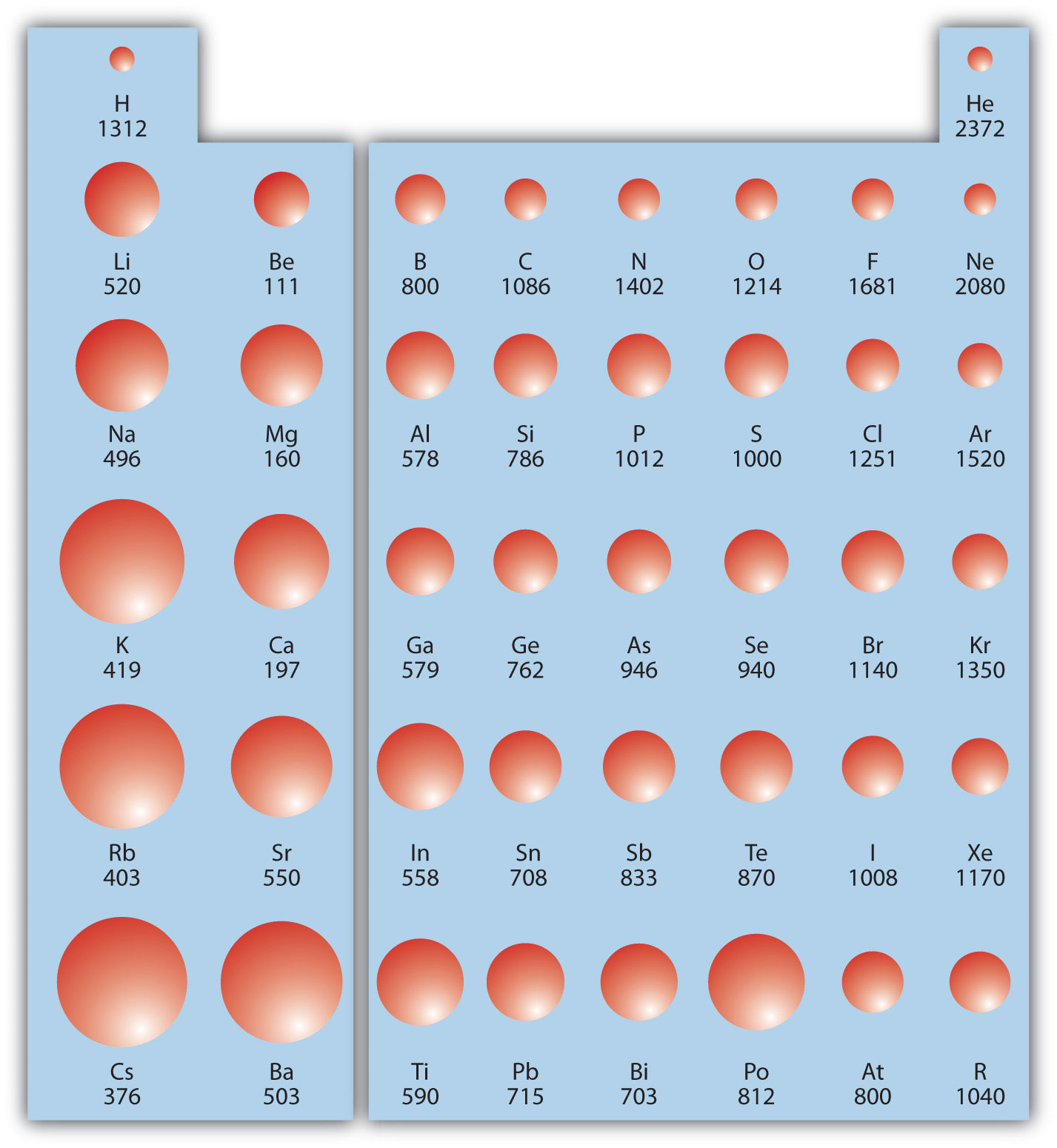
IE зазвичай виражається в кДж/моль атомів. Це завжди позитивно, оскільки видалення електрона завжди вимагає, щоб енергія була введена (тобто вона ендотермічна). IE також показує періодичні тенденції. Коли ви йдете вниз по таблиці Менделєєва, стає легше видалити електрон з атома (тобто тобто зменшується), оскільки валентний електрон знаходиться далі від ядра. Таким чином,
as↓PT,IE↓
Однак, коли ви переходите по таблиці Менделєєва і електрони наближаються, потрібно більше енергії, щоб видалити електрон. В результаті ІП збільшується:
as→PT,IE↑
8.6.2На малюнку показані значення IE проти позиції в таблиці Менделєєва. Знову ж таки, тенденція не є абсолютною, але загальні тенденції, що проходять поперек і вниз по періодичній таблиці, повинні бути очевидними.
IE також показує цікаву тенденцію в межах даного атома. Це пов'язано з тим, що більше одного IE можна визначити шляхом видалення послідовних електронів (якщо атом має їх для початку):
- Перша енергія іонізації (IE 1):
A(g)→A+(g)+e−
- Друга енергія іонізації (IE 2):
A+(g)→A2+(g)+e−
- Третя енергія іонізації (IE 3):
A2+(g)→A3+(g)+e−
і так далі.
Кожен наступний IE більший за попередній, оскільки електрон видаляється з атома з поступово більшим позитивним зарядом. Однак IE приймає великий стрибок, коли послідовна іонізація спускається в нову оболонку. Наприклад, нижче наведено перші три ІЕ для Mg, електронна конфігурація яких становить 1 s 2 2 s 2 2 p 6 3 s 2:
Перша енергія іонізації (IE 1) = 738 кДж/моль:
Mg(g)→Mg+(g)+e−
Друга енергія іонізації (IE 2) = 1,450 кДж/моль:
Mg+(g)→Mg2+(g)+e−
Третя енергія іонізації (IE 3) = 7,734 кДж/моль:
Mg2+(g)→Mg3+(g)+e−
Другий ІЕ вдвічі перевищує перший, що не дивно: перший ІЕ передбачає видалення електрона з нейтрального атома, тоді як другий передбачає видалення електрона з позитивного іона. Третій IE, однак, в п'ять разів перевищує попередній. Чому вона настільки більша? Оскільки перші два електрони видаляються з підоболонки 3 s, але третій електрон повинен бути видалений з оболонки n = 2 (зокрема, підоболонки 2 p, яка нижче за енергією, ніж оболонка n = 3). Таким чином, це займає набагато більше енергії, ніж просто подолання більшого іонного заряду. Такі тенденції демонструють, що електрони в атомах організовані в групах.
Який атом в кожній парі має більшу першу енергію іонізації?
- Автомобіль для Sr
- К або К +
Рішення
- Оскільки Sr знаходиться нижче Ca в таблиці Менделєєва, легше видалити електрон з неї; таким чином, Ca має вищий IE.
- Оскільки K + має позитивний заряд, з нього буде важче видалити інший електрон, тому його IE більше, ніж у K. Дійсно, він буде значно більшим, оскільки наступний електрон у K +, який потрібно видалити, походить з іншої оболонки.
Який атом має нижчу енергію іонізації, C або F?
Відповідь
C
Протилежність IE описується спорідненістю електронів (ЕА), яка є зміною енергії, коли атом газової фази приймає електрон:
A(g)+e−→A−(g)ΔH≡EA
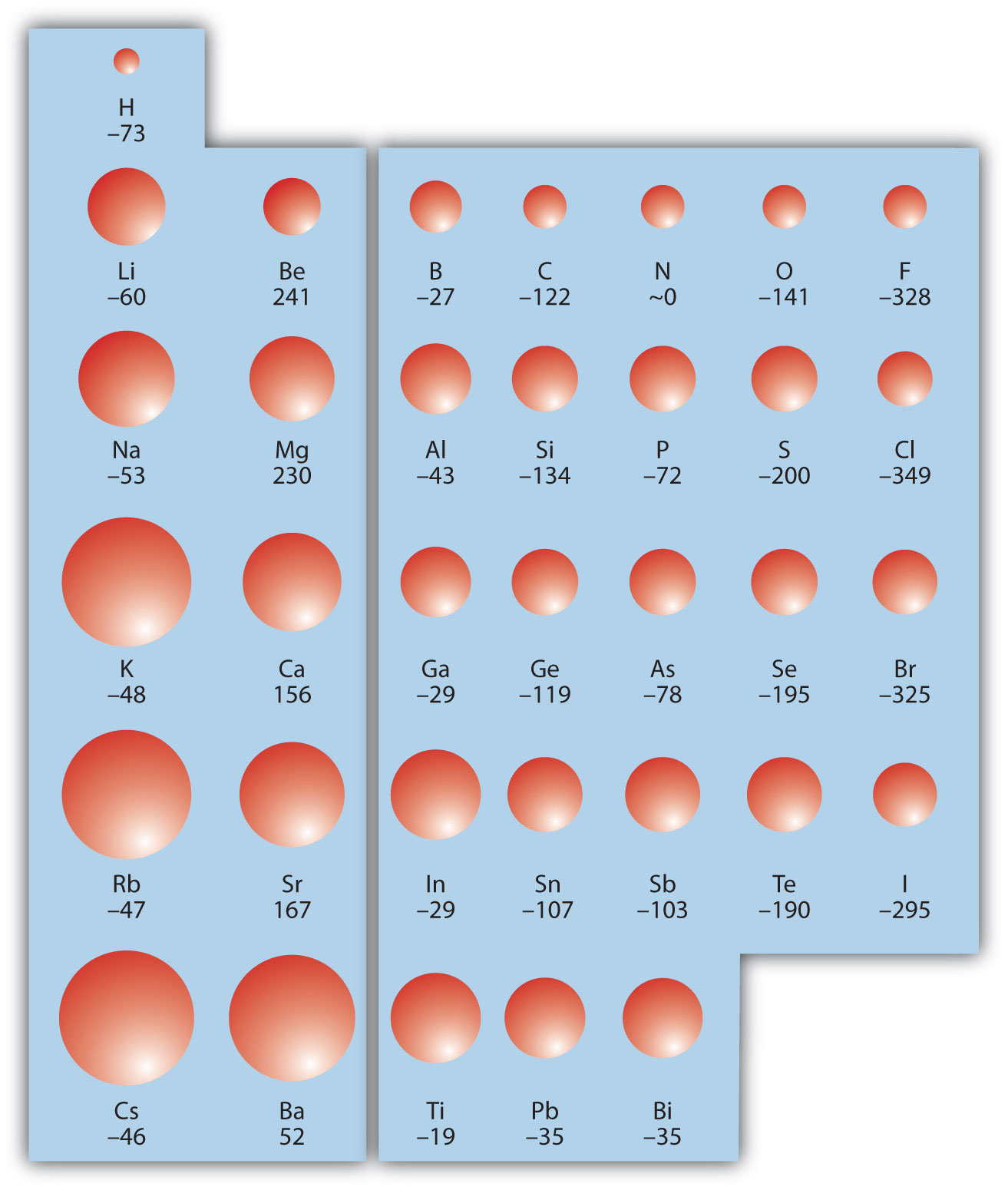
ЕА також зазвичай виражається в кДж/моль. EA також демонструє деякі періодичні тенденції, хоча вони менш очевидні, ніж інші періодичні тенденції, обговорювані раніше. Як правило, коли ви переходите по таблиці Менделєєва, EA збільшує свою величину:
as→PT,EA↑
Не існує остаточної тенденції, коли ви йдете вниз по періодичній таблиці; іноді EA збільшується, іноді зменшується. 8.6.3На малюнку показані значення EA в порівнянні з позицією на періодичній таблиці для елементів s - і p -блоку. Тенденція не є абсолютною, особливо враховуючи великі позитивні значення EA для другого стовпця. Однак загальна тенденція, що проходить через таблицю Менделєєва, повинна бути очевидною.
Передбачте, який атом у кожній парі матиме найвищу величину спорідненості електронів.
- C або F
- Na або S
Рішення
- C і F знаходяться в одному рядку таблиці Менделєєва, але F далі праворуч. Тому F повинен мати більшу величину ЕА.
- Na і S знаходяться в одному рядку таблиці Менделєєва, але S далі праворуч. Тому S повинен мати більшу величину EA.
Передбачте, який атом матиме найвищу величину спорідненості електронів: As або Br.
Відповідь
Br
Резюме
Певні властивості - а не атомний радіус, енергії іонізації та спорідненість електронів - можуть бути якісно зрозумілі за положеннями елементів у періодичній таблиці.
