3.4: Маси атомів і молекул
- Page ID
- 22505
- Висловлюють маси атомів і молекул.
Оскільки матерія визначається як все, що має масу і займає простір, не слід дивуватися, дізнавшись, що атоми та молекули мають масу.
Окремі атоми і молекули, однак, дуже малі, а маси окремих атомів і молекул теж дуже малі. Для макроскопічних об'єктів ми використовуємо такі одиниці, як грами та кілограми, щоб констатувати їх маси, але ці одиниці занадто великі, щоб зручно описувати маси окремих атомів і молекул. Потрібна інша шкала.
Атомна одиниця маси
Атомна одиниця маси (u; деякі тексти використовують amu, але цей старий стиль більше не приймається) визначається як одна дванадцята маси атома вуглецю-12, ізотопу вуглецю, який має шість протонів і шість нейтронів у своєму ядрі. За цією шкалою маса протона становить 1,00728 u, маса нейтрона - 1,00866 u, а маса електрона - 0,000549 у.Не буде великої похибки, якщо оцінити масу атома простим підрахунком загальної кількості протонів і нейтронів в ядрі (тобто визначити його масове число) і ігнорувати електрони. Таким чином, маса вуглецю-12 становить близько 12 u, маса кисню-16 - близько 16 u, а маса урану-238 - близько 238 у.Більш точні маси зустрічаються в наукових довідках—наприклад, точна маса урану-238 - 238.050788 u, тому видно, що ми не за горами, використовуючи в якості значення цілого числа маса атома.
Яка маса елемента? Це дещо складніше, оскільки більшість елементів існує у вигляді суміші ізотопів, кожен з яких має свою масу. Таким чином, хоча легко говорити про масу атома, говорячи про масу елемента, ми повинні враховувати ізотопну суміш.
Атомна маса
Атомна маса елемента - це середньозважене значення мас ізотопів, що складають елемент. Що ми маємо на увазі під середньозваженим? Ну і розглянемо елемент, який складається з двох ізотопів, 50% з масою 10 u і 50% з масою 11 у. середньозважене знаходять множенням кожної маси на її дробове входження (в десятковому вигляді) і подальшим складанням всіх продуктів. Сума є середньозваженим і служить формальною атомною масою елемента. У цьому прикладі ми маємо наступне:
| 0,50 × 10 у | = 5,0 у.о. |
|---|---|
| 0,50 × 11 у | = 5,5 у.о |
| Сума | = 10,5 u = атомна маса нашого елемента |
Зверніть увагу, що жоден атом в нашому гіпотетичному елементі не має маси 10,5 u; скоріше, це середня маса атомів, зважена їх відсотками виникнення.
Цей приклад схожий на реальний елемент. Бор існує як близько 20% бор-10 (п'ять протонів і п'ять нейтронів в ядрах), так і близько 80% бор-11 (п'ять протонів і шість нейтронів в ядрах). Атомна маса бору розраховується аналогічно тому, що ми зробили для нашого гіпотетичного прикладу, але відсотки різні:
| 0,20 × 10 у | = 2,0 у.о. |
|---|---|
| 0,80 × 11 у | = 8,8 у.о. |
| Сума | = 10,8 u = атомна маса бору |
Таким чином, ми використовуємо 10,8 u для атомної маси бору.
Практично всі елементи існують у вигляді сумішей ізотопів, тому атомні маси можуть значно відрізнятися від цілих чисел. У таблиці\(\PageIndex{1}\) наведено атомні маси деяких елементів. Атомні маси в таблиці\(\PageIndex{1}\) перераховані до трьох знаків після коми, де це можливо, але в більшості випадків потрібні лише один або два знака після коми. Зауважимо, що багато атомних мас, особливо більші, не дуже близькі до цілих чисел. Це, частково, ефект зростаючої кількості ізотопів у міру збільшення атомів в розмірах. (Рекордна кількість - 10 ізотопів для олова.)
| Назва елемента | Атомна маса (u) | Назва елемента | Атомна маса (u) |
|---|---|---|---|
| Алюміній | 26.981 | Молібден | 95.94 |
| Аргон | 39.948 | Неонові | 20.180 |
| Миш'як | 74.922 | Нікель | 58.693 |
| Барій | 137.327 | Азот | 14.007 |
| Берилій | 9.012 | Кисень | 15.999 |
| Вісмут | 208.980 | Паладій | 106.42 |
| Бор | 10.811 | Фосфор | 30.974 |
| Бром | 79.904 | Платина | 195.084 |
| Кальцій | 40.078 | Калій | 39.098 |
| Вуглець | 12.011 | Радій | н/д |
| хлор | 35.453 | Радон | н/д |
| Кобальт | 58.933 | Рубідій | 85.468 |
| Мідь | 63.546 | Скандій | 44.956 |
| Фтор | 18.998 | Селен | 78.96 |
| Галій | 69.723 | кремнію | 28.086 |
| Германій | 72.64 | Сріблястий | 107.868 |
| Золотий | 196.967 | Натрій | 22.990 |
| Гелій | 4.003 | Стронцій | 87.62 |
| Водень | 1.008 | Сірка | 32.065 |
| Йод | 126.904 | Тантал | 180.948 |
| Іридій | 192.217 | Олово | 118 710 |
| Залізо | 55.845 | Титан | 47.867 |
| Криптон | 83.798 | Вольфрам | 183.84 |
| Свинець | 207.2 | Уран | 238.029 |
| Літій | 6.941 | Xenon | 131.293 |
| Магній | 24.305 | Цинк | 65.409 |
| Марганець | 54.938 | Цирконій | 91.224 |
| Меркурій | 200.59 | Молібден | 95.94 |
| Примітка: Атомна маса задається трьома знаками після коми, якщо це відомо. | |||
Молекулярна маса
Тепер, коли ми розуміємо, що атоми мають масу, легко розширити поняття на масу молекул. Молекулярна маса - це сума мас атомів в молекулі. Це може здатися банальним розширенням поняття, але важливо підрахувати кількість кожного типу атома в молекулярній формулі. Крім того, хоча кожен атом в молекулі є певним ізотопом, ми використовуємо середньозважений, або атомну масу, для кожного атома в молекулі.
Наприклад, якби ми визначали молекулярну масу триоксиду азоту N 2 O 3, нам потрібно було б додати атомну масу азоту два рази з атомною масою кисню три рази:
| 2 Н мас = 2 × 14,007 u | = 28,014 у.о. |
|---|---|
| 3 О мас = 3 × 15,999 u | = 47,997 у.о. |
| Всього | = 76.011 u = молекулярна маса N 2 O 3 |
Ми не були б за горами, якби ми обмежили наші числа одним або навіть двома знаками після коми.
Яка молекулярна маса кожної речовини?
- \(\ce{NBr3}\)
- \(\ce{C2H6}\)
Рішення
Додайте одну атомну масу азоту і три атомні маси брому:
| 1 Н маса | = 14,007 у.о. |
|---|---|
| 3 Br мас = 3 × 79,904 u | = 239,712 у.о. |
| Всього | = 253,719 u = молекулярна маса NBr 3 |
Додайте дві атомні маси вуглецю і шість атомних мас водню:
| 2 С мас = 2 × 12,011 u | = 24,022 у.о. |
|---|---|
| 6 Н мас = 6 × 1,008 u | = 6,048 у.о. |
| Всього | = 30.070 u = молекулярна маса С 2 Н 6 |
З'єднання\(\ce{C2H6}\) також має загальну назву - етан.
Яка молекулярна маса кожної речовини?
- \(\ce{SO2}\)
- \(\ce(PF3}\)
- Відповідь
-
64 063 грн
- Відповідь б
-
87 968 грн
20 березня 1995 року японське терористичне угрупування Aum Shinrikyo (на санскриті «Вища правда») випустило трохи газу зарину в системі метро Токіо; дванадцять людей загинули, а тисячі отримали поранення (рис.\(\PageIndex{2a}\)). Зарин (молекулярна формула\(\ce{C4H10FPO2}\)) - нервовий токсин, який вперше був синтезований в 1938 році. Він розглядається як один з найбільш смертельних токсинів, відомих, за оцінками, приблизно в 500 разів більш потужним, ніж ціанід. Вчені та інженери, які вивчають поширення хімічної зброї, такої як зарин (так, є такі вчені) хотіли б мати подібне менш небезпечне хімічне речовина для вивчення, дійсно таке, яке є нетоксичним, тому вони самі не піддаються ризику.
Гексафторид сірки використовується як модельна сполука для зарину. \(\ce{SF6}\)(Молекулярна модель якої показана на малюнку\(\PageIndex{2b}\)) має аналогічну молекулярну масу (близько 146 u), як зарин (близько 140 u), тому має аналогічні фізичні властивості в паровій фазі. Гексафторид сірки також дуже легко точно виявити навіть при низьких рівнях, і він не є нормальною частиною атмосфери, тому існує невеликий потенціал для забруднення природними джерелами. Отже,\(\ce{SF6}\) використовується також як повітряний трасувальник для систем вентиляції будівель. Він нетоксичний і дуже хімічно інертний, тому працівникам не потрібно вживати особливих запобіжних заходів, крім спостереження за асфіксією.
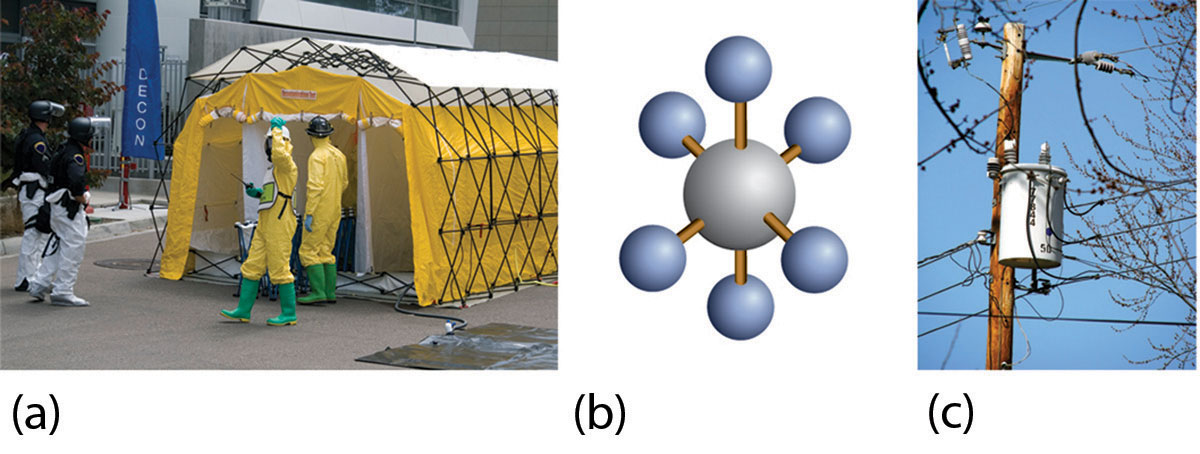
Гексафторид сірки має і ще одне цікаве застосування: іскрогасник в високовольтному електрообладнанні. \(\ce{SF6}\)Газ високого тиску використовується замість старих масел, які можуть мати забруднюючі речовини, які не є екологічно чистими (рис.\(\PageIndex{2c}\)).
Ключові виноси
- Атомна одиниця маси (u) - це одиниця, яка описує маси окремих атомів і молекул.
- Атомна маса - це середньозважена маса всіх ізотопів елемента.
- Молекулярна маса - це сума мас атомів в молекулі.
