12.1: Природа органічних молекул
- Page ID
- 22009
- Охарактеризуйте основні структурні властивості простих органічних молекул.
Органічна хімія - це вивчення хімії вуглецевмісних сполук. Вуглець виділяють тому, що він має хімічне різноманіття, неперевершене будь-яким іншим хімічним елементом. Її різноманітність заснована на наступному:
- Атоми вуглецю досить сильно зв'язуються з іншими атомами вуглецю.
- Атоми вуглецю досить міцно зв'язуються з атомами інших елементів.
- Атоми вуглецю утворюють велику кількість ковалентних зв'язків (чотири).
Цікаво, що елементарний вуглець не особливо рясний. Вона навіть не фігурує в списку найбільш поширених елементів в земній корі. Проте все живе складається з органічних сполук. Більшість органічних хімічних речовин є ковалентними сполуками, саме тому ми вводимо сюди органічну хімію. За умовністю, сполуки, що містять карбонатні іони і бікарбонатні іони, а також вуглекислий газ і чадний газ, не вважаються частиною органічної хімії, навіть незважаючи на те, що вони містять вуглець.
Структурні властивості вуглецевих сполук
Атом вуглецю має чотири валентних електрона, він чотиривалентний. Вуглець може утворювати чотири ковалентні зв'язки, або ділитися електронами з до чотирьох атомів, щоб отримати повний октет. Найпростіші вуглецеві сполуки містять тільки вуглець і водень і називаються вуглеводнями. Метан, найпростіший вуглеводень, містить єдиний вуглець з чотирма ковалентно зв'язаними атомами водню. Згадуючи те, що ви дізналися про молекулярні структури і VSEPR, ми знаємо, що метан є тетраедричним (чотири групи електронів і немає одиноких пар).
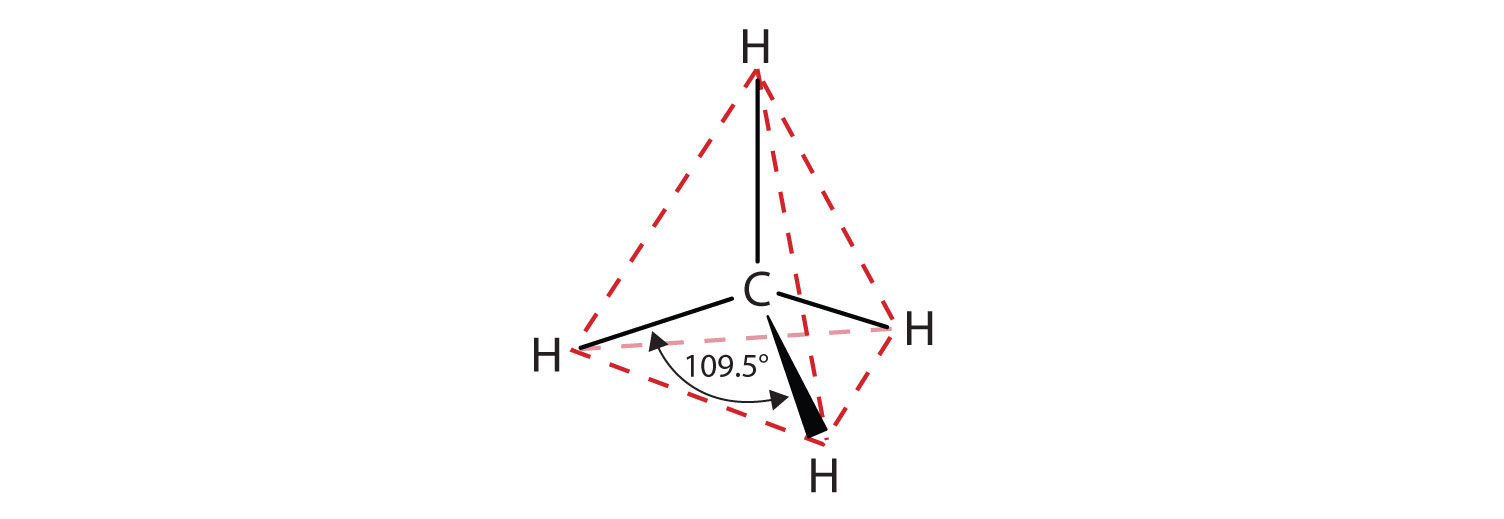
Вуглець також може утворювати подвійні зв'язки, розділяючи чотири електрони з сусіднім атомом вуглецю або потрійними зв'язками шляхом обміну шістьма електронами з сусіднім атомом вуглецю. Як показано на малюнку\(\PageIndex{2}\) нижче, вуглець із приєднаними трьома електронними групами буде тригональним планарним, а вуглець з двома електронними групами буде лінійним.
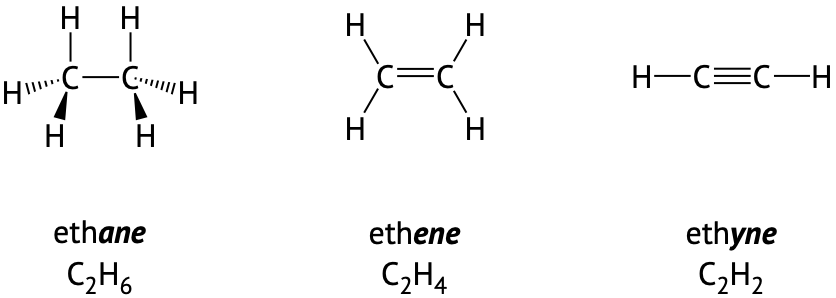
Малюнок\(\PageIndex{2}\): Два вуглеці можуть бути прикріплені разом в одному зв'язку, подвійний зв'язок або потрійний зв'язок. Зверніть увагу, в кожному прикладі вуглець робить чотири загальні зв'язки. Кількість атомів водню в кожній молекулі зменшується зі збільшенням кількості вуглецево-вуглецевих зв'язків.
Прості вуглеводневі сполуки неполярні через форму та невелику різницю електронегативності між атомами вуглецю та водню. Коли вуглець пов'язаний з галогеном або атомом кисню, отриманий зв'язок є полярним. Можливо, буде корисно переглянути розділ про електронегативність і полярність зв'язків і молекул, щоб мати можливість описати властивості різних органічних сполук, зокрема, як вони реагують і взаємодіють з іншими молекулами.
Порівняння органічних та неорганічних сполук
Органічні сполуки, як і неорганічні сполуки, підкоряються всім природним законам. Часто немає чіткого розмежування в хімічних або фізичних властивостях серед органічних і неорганічних молекул. Проте, корисно порівнювати типові члени кожного класу, як в табл\(\PageIndex{1}\). Однак майте на увазі, що в цій таблиці є винятки для кожної категорії.
| Органічні властивості | Приклад: Гексан | неорганічні властивості | Приклад: NaCl |
|---|---|---|---|
| низькі температури плавлення | −95° C | високі температури плавлення | 801°C |
| низькі температури кипіння | 69°C | високі температури кипіння | 1,413 °C |
| низька розчинність у воді; висока розчинність в неполярних розчинниках | нерозчинний у воді; розчинний у бензині | більша розчинність у воді; низька розчинність в неполярних розчинниках | розчинний у воді; нерозчинний у бензині |
| легкозаймистий | легкозаймистий | негорючий | негорючий |
| водні розчини не проводять електрику | непровідний | водні розчини проводять електрику | провідний у водному розчині |
| демонструють ковалентне склеювання | ковалентні зв'язки | демонструвати іонне склеювання | іонні зв'язки |
