8.13: Тверді речовини
- Page ID
- 21983
- Опишіть загальні властивості твердого тіла.
- Опишіть шість різних типів твердих речовин.
Тверда речовина схожа на рідину в тому, що частинки контактують один з одним. Тверді речовини на відміну від рідин тим, що міжмолекулярні сили досить сильні, щоб утримувати частинки на місці. При досить низьких температурах всі речовини є твердими речовинами (гелій є єдиним винятком), але температура, при якій твердий стан стає стабільною фазою, широко коливається серед речовин, від 20 К (−253° C) для водню до понад 3900 К (3600° C) для вуглецю.
Тверда фаза має кілька характеристик. По-перше, тверді речовини зберігають свою форму. Вони не заповнюють цілі контейнери, як це роблять гази, і вони не приймають форму своїх контейнерів, як це роблять рідини. Їх не можна легко стиснути, як гази, і вони мають відносно високу щільність.
Тверді речовини також можуть демонструвати різноманітні властивості. Наприклад, багато металів можуть бути збиті в тонкі листи або втягнуті в дроти, тоді як з'єднання, такі як NaCl, руйнуються, якщо вони будуть вражені. Деякі метали, такі як натрій і калій, досить м'які, а інші, такі як алмаз, дуже тверді і можуть легко подряпати інші речовини. Зовнішній вигляд також відрізняється: більшість металів блискучі і сріблясті, але сірка (неметал) жовта, а іонні сполуки можуть приймати веселку кольорів. Тверді метали проводять електрику і тепло, тоді як іонні тверді речовини - ні. Багато твердих речовин непрозорі, але деякі прозорі. Деякі розчиняються у воді, а деякі ні. На\(\PageIndex{1}\) малюнку показані два твердих тіла, які ілюструють подібні та різнорідні властивості твердих тіл.

Тверді речовини можуть мати найрізноманітніші фізичні властивості. Ми розглянемо різні типи твердих тіл та склеювання, яке надає їм їх властивості.
По-перше, ми повинні розрізняти два загальні типи твердих речовин. Аморфне тверде тіло - це тверда речовина без довгострокової структури або повторення. Приклади включають скло та багато пластмас, обидва з яких складаються з довгих ланцюгів молекул без порядку від однієї молекули до іншої. Кристалічне тверде тіло - тверде тіло, яке має правильну повторювану тривимірну структуру. Одним із прикладів є кристал NaCl (рис.\(\PageIndex{1}\)): на атомному рівні NaCl складається з регулярного тривимірного масиву іонів Na + та іонів Cl −.
Існує тільки один вид аморфного твердого тіла. Однак існує кілька різних типів кристалічних твердих тіл, залежно від ідентичності одиниць, що складають кристал.
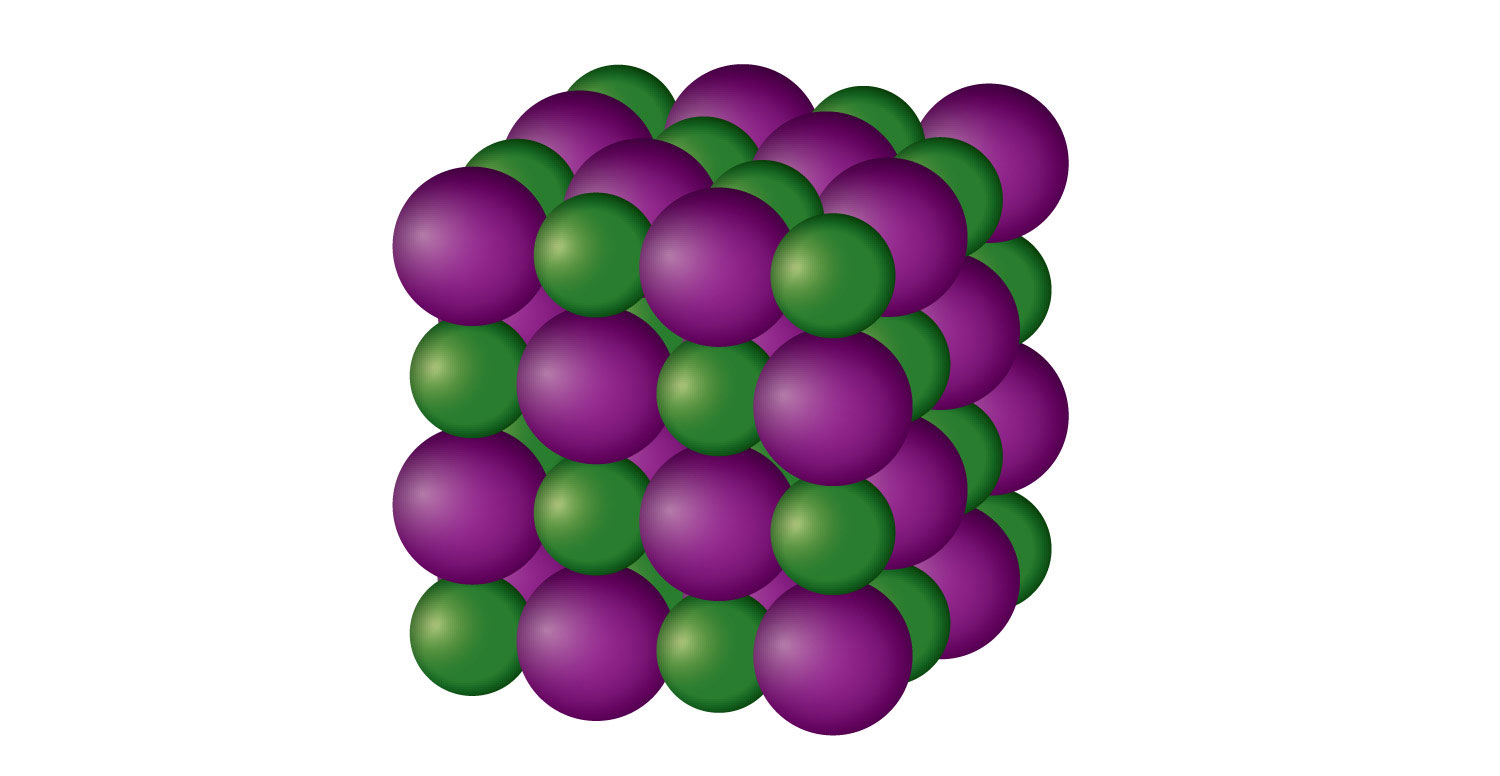
Іонне тверде тіло - це кристалічна тверда речовина, що складається з іонів (навіть якщо іони багатоатомні). NaCl є прикладом іонного твердого тіла (рис.\(\PageIndex{2}\) - Іонне тверде тіло). Іони Na + та Cl − іони чергуються у трьох вимірах, повторюючи візерунок, який триває у всьому зразку. Іони утримуються разом за рахунок тяжіння протилежних зарядів - дуже сильної сили. Отже, більшість іонних твердих речовин мають відносно високі температури плавлення; наприклад, температура плавлення NaCl становить 801° C. іонні тверді речовини, як правило, дуже крихкі. Щоб їх розірвати, потрібно зламати дуже сильні іонні атракціони; зміщення лише близько 1 × 10 −10 м буде переміщати іони поруч з іонами того ж заряду, що призводить до відштовхування. Іонні тверді речовини не проводять електрику в твердому стані; однак у рідкому стані і при розчиненні в якомусь розчиннику вони проводять електрику. Цей факт спочатку сприяв ідеї про те, що деякі речовини існують у вигляді іонних частинок.
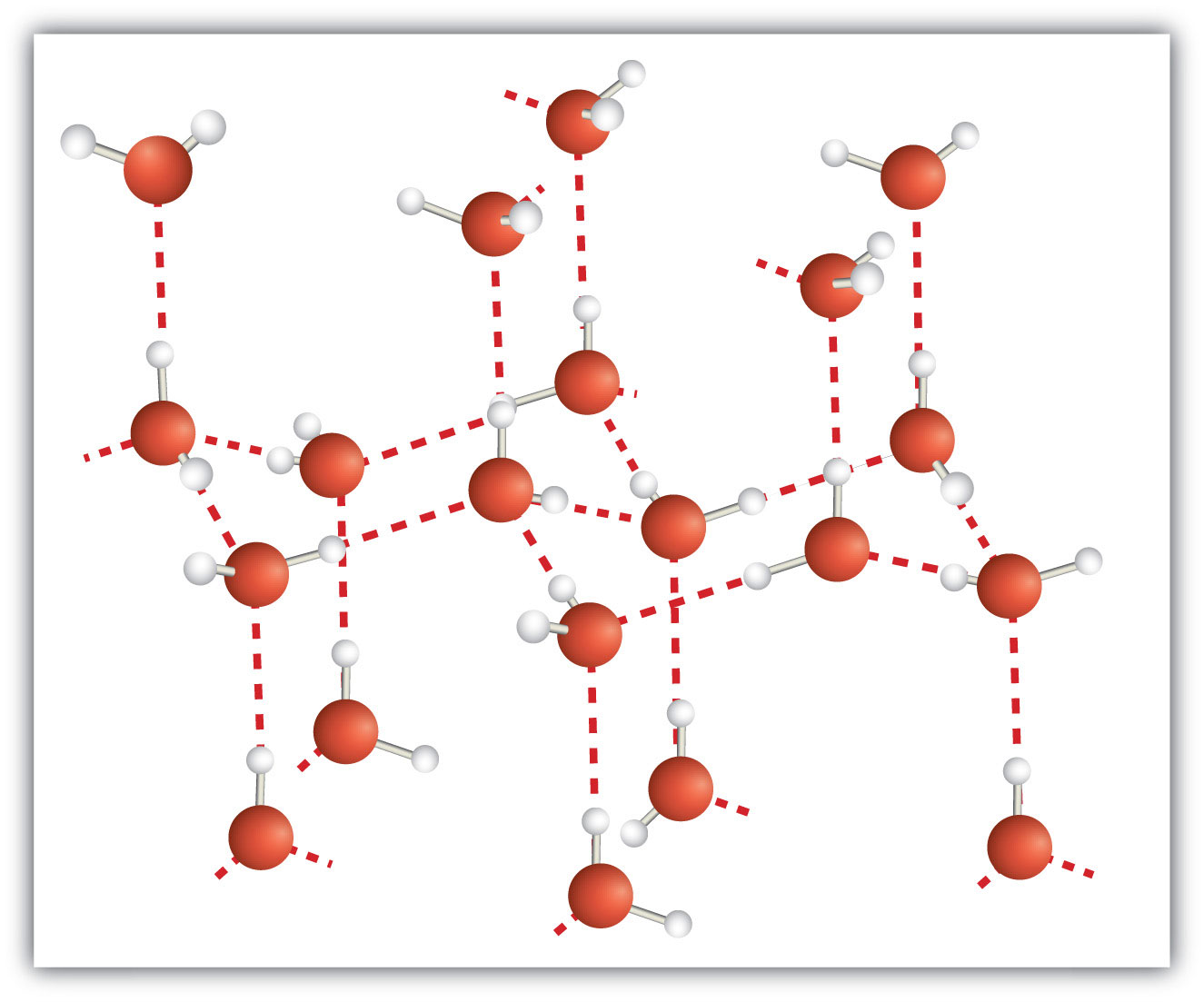
Молекулярна тверда речовина - це кристалічне тверде тіло, компоненти якого є ковалентно зв'язаними молекулами. Багато молекулярних речовин, особливо при дбайливому затвердінні з рідкого стану, утворюють тверді речовини, де молекули шикуються регулярним чином, подібним до іонного кристала, але вони складаються з молекул замість іонів. Оскільки міжмолекулярні сили між молекулами, як правило, менш сильні, ніж в іонних твердих тілах, молекулярні тверді речовини зазвичай плавляться при більш низьких температурах і м'якші, ніж іонні тверді речовини. Лід є прикладом молекулярної твердої речовини. У твердому стані молекули шикуються за правильним малюнком (рис.\(\PageIndex{3}\)). Деякі дуже великі молекули, такі як біологічні молекули, будуть утворювати кристали тільки в тому випадку, якщо вони будуть дуже ретельно затвердіти з рідкого стану або, частіше, з розчиненого стану; в іншому випадку вони будуть утворювати аморфні тверді речовини.
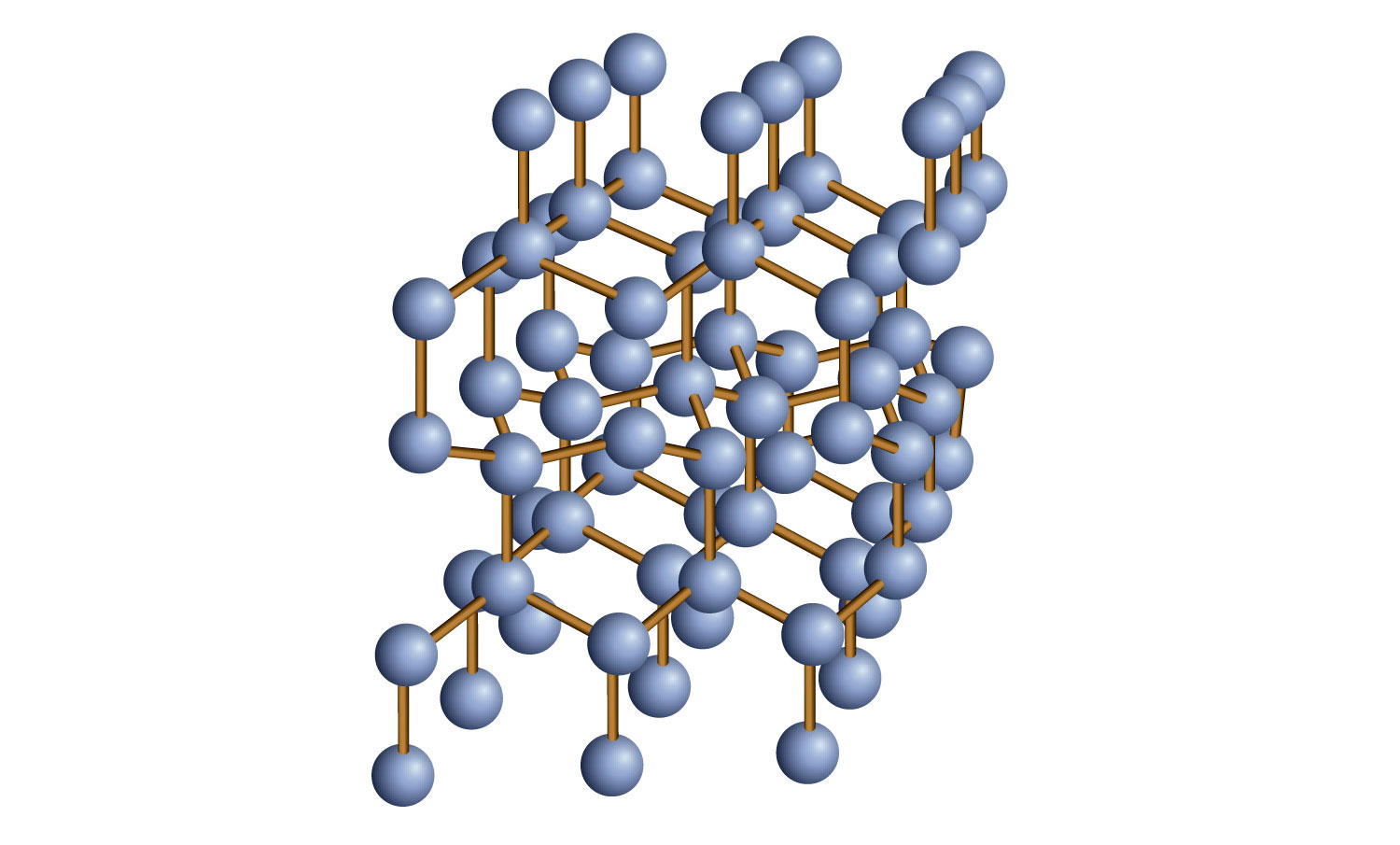
Деякі тверді речовини складаються з атомів одного або декількох елементів, які ковалентно пов'язані між собою, здавалося б, нескінченним чином. Такі тверді речовини називаються ковалентними мережевими твердими речовинами. Кожен шматочок речовини по суті є однією величезною молекулою, так як ковалентний зв'язок в кристалі поширюється по всьому кристалі. Двома найбільш відомими твердими речовинами ковалентної мережі є вуглець у формі алмазу та діоксид кремнію (SiO 2). Малюнок\(\PageIndex{4}\) - Ковалентна мережа твердих тіл, показує зв'язок в ковалентній мережі твердого тіла. Як правило, тверді тіла ковалентної мережі є поганими провідниками електрики, хоча їх здатність проводити тепло мінлива: алмаз є одним з найбільш теплопровідних речовин відомих, тоді як SiO 2 приблизно в 100 разів менше теплопровідний. Більшість твердих тіл ковалентної мережі дуже тверді, на прикладі алмаз, який є найважчим відомим речовиною. Тверді речовини ковалентної мережі мають високі температури плавлення завдяки своїй мережі ковалентних зв'язків, всі з яких довелося б розірвати, щоб вони перетворилися на рідину. Дійсно, тверді речовини ковалентної мережі є одними з найбільш відомих речовин, що плавляться: температура плавлення алмазу перевищує 3500° C, тоді як температура плавлення SiO 2 становить близько 1,650° C, ці характеристики пояснюються мережею ковалентних зв'язків по всьому зразку.
Металева тверда речовина - тверда речовина з характерними властивостями металу: блискучим і сріблястим кольором і хорошим провідником тепла і електрики. Металеву тверду речовину також можна забивати в листи і втягувати в дроти. Металеве тверде тіло проявляє металевий зв'язок, тип міжмолекулярної взаємодії, спричиненої спільним використанням електронів s валентності всіма атомами у зразку. Саме спільне використання цих валентних електронів пояснює здатність металів добре проводити електрику і тепло. Метали також відносно легко втрачають ці валентні електрони, що пояснює, чому металеві елементи зазвичай утворюють катіони, коли вони утворюють сполуки.
Передбачте тип кристала, виставленого кожним твердим тілом.
- MgO
- Ag
- СО 2
Рішення
- Поєднання металу і неметалу робить іонну сполуку, тому MgO існував би як іонні кристали в твердому стані.
- Срібло - це метал, тому воно існувало б як металеве тверде тіло в твердому стані.
- CO 2 - це ковалентно зв'язана молекулярна сполука. У твердому стані він утворював би молекулярні кристали. (Ви можете побачити кристали в сухому льоду неозброєним оком.)
Передбачте тип кристала, виставленого кожним твердим тілом.
- Я 2
- Са (НІ 32)
Відповіді
- молекулярні кристали
- іонні кристали
Продукти та напої, які ми їмо та п'ємо, мають різні фази: тверді, рідкі та газові. (Як ми заглинаємо гази? Газовані напої мають газ, який іноді викликає у людини відрижку.) Однак серед твердих речовин, які ми їмо, три, зокрема, є або виробляються з гірських порід. Так, скелі!
Перший з них - NaCl, або кухонна сіль. Сіль є єдиною твердою речовиною, яку ми ковтаємо, яка насправді видобувається як скеля (звідси термін кам'яна сіль; це справді скеля). Сіль забезпечує як іони Na +, так і іони Cl −, обидва з яких необхідні для гарного здоров'я. Сіль зберігає їжу, функція, яка була набагато важливішою перед днями сучасного приготування та зберігання їжі. Той факт, що солоність є одним з основних смаків, які язик може виявити, свідчить про сильний еволюційний зв'язок між вживанням солі та виживанням. Сьогодні існує певна стурбованість тим, що в раціоні занадто багато солі; за оцінками, середня людина споживає щонайменше в три рази більше солі щодня, ніж це необхідно для належного функціонування організму.
Інші дві породи, які ми їмо, пов'язані: бікарбонат натрію (NaHCO 3) та карбонат натрію (Na 2 CO 3). Однак ми не видобуваємо ці речовини безпосередньо з землі; ми видобуваємо трону, хімічна формула якої - Na 3 H (CO 3) 2. Цю речовину розчиняють у воді і обробляють газом СО 2, щоб зробити або Na 2 CO 3, або NaHCO 3. Інший процес, який називається процесом Solvay, також використовується для виготовлення Na 2 CO 3. У процесі Solvay NH 3 і CO 2 додають до розчинів NaCl для отримання NaHCO 3 і NH 4 Cl; NaHCO 3 випадає в осад і нагрівається з отриманням Na 2 СО 3. Так чи інакше, ми отримуємо ці два вироби з землі (тобто каміння).
NaHCO 3 також відома як харчова сода, яка використовується в багатьох хлібобулочних виробах. Na 2 CO 3 використовується в харчових продуктах для регулювання кислотного балансу. Він також використовується в пральні (де його називають пральною содою) для взаємодії з іншими іонами у воді, які, як правило, знижують ефективність миючого засобу.

Резюме
- Тверді речовини можна розділити на аморфні тверді речовини та кристалічні тверді речовини.
- Кристалічні тверді речовини можуть бути іонними, молекулярними, ковалентними мережами або металевими.