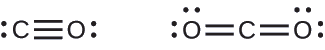4.3: Множинні ковалентні зв'язки
- Page ID
- 21476
- Визначте, коли для завершення октету потрібна множинна зв'язок (подвійна або потрійна).
Спільне використання пари електронів являє собою єдиний ковалентний зв'язок, який зазвичай просто називають єдиним зв'язком. Однак у багатьох молекулах атоми досягають повних октетів, розділяючи між ними більше однієї пари електронів:
- Дві електронні пари розділили подвійний зв'язок
- Три пари електронів розділили потрійний зв'язок
Оскільки кожен азот містить 5 валентних електронів, їм потрібно розділити 3 пари, щоб кожен досягти валентного октету. N 2 досить інертний, завдяки міцному потрійному зв'язку між двома атомами азоту.
На додаток до азоту та кисню, вуглець також зазвичай утворює множинні зв'язки до повних валентних октетів. Додаткові приклади, що включають ці три атоми, наведені нижче.
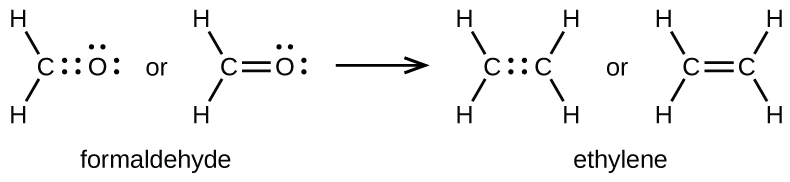
Подвійний зв'язок утворюється між атомами вуглецю і кисню в CH 2 O (формальдегід) і між двома атомами вуглецю в C 2 H 4 (етилен):
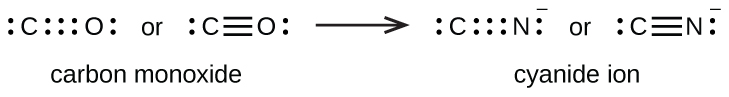
Потрійний зв'язок утворюється між вуглецем і киснем в окисі вуглецю (СО) і між вуглецем і азотом в іоні ціаніду (CN -):
Місія NASA Кассіні-Гюйгенс виявила велику хмару токсичного ціаністого водню (HCN) на Титані, одному з супутників Сатурна. Титан також містить етан (H 3 CCH 3), ацетилен (HCCH) та аміак (NH 3). Які структури Льюїса цих молекул?
Рішення
Обчисліть кількість валентних електронів.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- Н 3 КСН 3: (1 × 3) + (2 × 4) + (1 × 3) = 14
- ГКЧ: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH 3: (5 × 1) + (3 × 1) = 8
Намалюйте скелет і з'єднайте атоми одинарними зв'язками. Пам'ятайте, що Н ніколи не є центральним атомом:
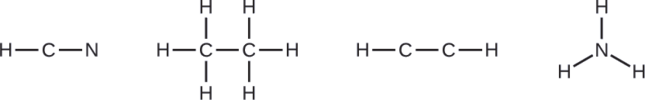
Там, де потрібно, розподіляють електрони до кінцевих атомів:
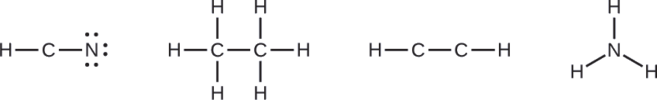
- HCN: шість електронів, розміщених на N
- H 3 CCH 3: електрони не залишаються
- HCCH: немає кінцевих атомів, здатних приймати електрони
- NH 3: немає кінцевих атомів, здатних приймати електрони
Там, де потрібно, помістіть залишилися електрони на центральному атомі:
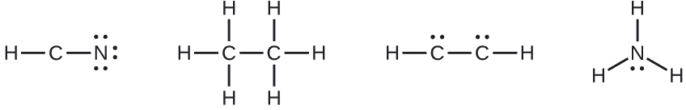
- HCN: електрони не залишаються
- H 3 CCH 3: електрони не залишаються
- HCCH: чотири електрони, розміщені на вуглеці
- NH 3: два електрони, розміщені на азоті
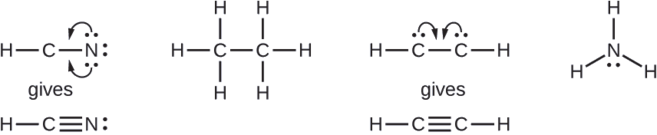
Там, де потрібно, переставляйте електрони, щоб утворити множинні зв'язки, щоб отримати октет на кожному атомі:
- HCN: сформуйте ще дві зв'язки C — N
- H 3 CCH 3: всі атоми мають правильну кількість електронів
- HCCH: утворюють потрійний зв'язок між двома атомами вуглецю
- NH 3: всі атоми мають правильну кількість електронів
Як чадний газ, CO, так і вуглекислий газ, CO 2, є продуктами згоряння викопного палива. Обидва ці гази також викликають проблеми: СО токсичний, а CO 2 був причетний до глобальних змін клімату. Які структури Льюїса цих двох молекул?
- Відповідь
-