3.6: Багатоатомні іони
- Page ID
- 21629
Цілі навчання
- Для ідентифікації та назви багатоатомних іонів.
Деякі іони складаються з груп атомів, ковалентно пов'язаних між собою і мають загальний електричний заряд. Оскільки ці іони містять більше одного атома, їх називають багатоатомними іонами. Структури, назви та формули деяких багатоатомних іонів наведені на малюнку та таблиці нижче.
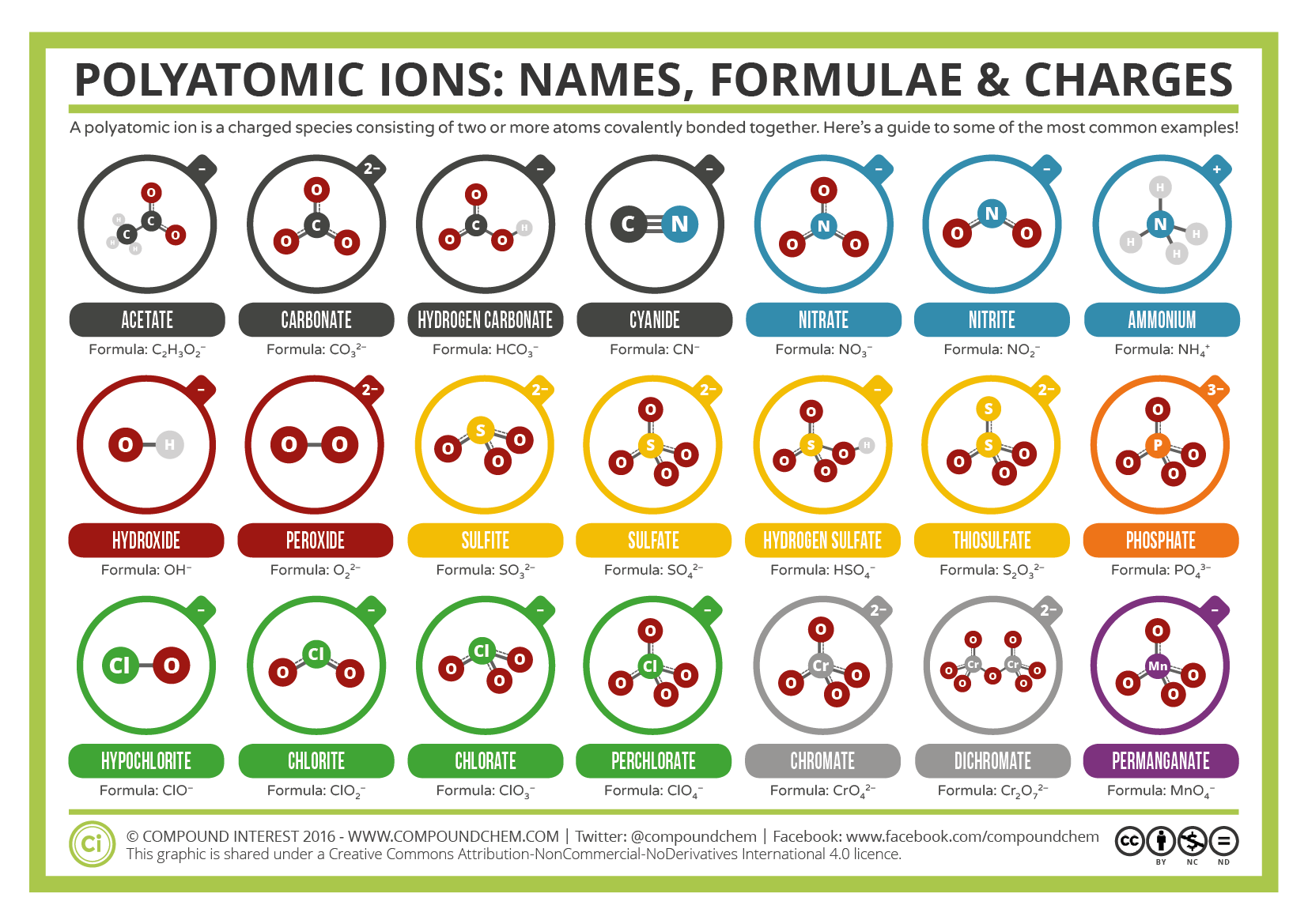
Багатоатомні іони мають визначені формули, назви та заряди, які ніяк не можуть бути змінені. У таблиці\(\PageIndex{1}\) наведено іони іонів та формули іонів найбільш поширених багатоатомних іонів. Наприклад,\(\ce{NO_3^{−}}\) це нітратний іон; він має один атом азоту і три атоми кисню і загальний заряд −1.
| Ім'я іона | Іонна формула |
|---|---|
| іон гідроній | Н 3 О + |
| іон амонію | NH 4 + |
| гідроксид-іон | ОХ − |
| іон ціаніду | CN − |
| карбонат-іон | СО 3 2 − |
| бікарбонат або гідрокарбонат | ГСО 3 − |
| ацетат іон | С 2 Н 3 О 2 − або СН 3 СО 2 − |
| нітрит іон | НЕМАЄ 3 − |
| нітровий кліщ | НЕМАЄ 2 − |
| сірка їла залізо | ТАК 4 2 − |
| сірчана сірка | ТАК 3 2 − |
| фосфат-іон | ПО 4 - 3 − |
| фосфатний іон | П 3 − 3 − |
Зверніть увагу, що лише два багатоатомні іони в цій таблиці - це катіони, іон гідронію (H 3 O +) та іон амонію (NH 4 +), інші багатоатомні іони все негативно заряджені і, отже, класифікуються як аніони. Однак лише два з них, іон гідроксиду та іон ціаніду, названі за допомогою суфікса «- ide», який, як правило, свідчить про негативно заряджені іони. Решта багатоатомні аніони, які всі містять кисень, у поєднанні з іншим неметалом, існують як частина ряду, в якій кількість кисню всередині багатоатомної одиниці може змінюватися. Єдиного суфікса «-ide» недостатньо для розрізнення назв аніонів у спорідненому багатоатомному ряду. Тому використовуються суфікси «- їли» і «- ite», щоб позначити, що відповідні багатоатомні іони входять до складу ряду. Крім того, ці суфікси також вказують на відносну кількість кисню, які містяться всередині багатоатомних іонів. Зверніть увагу, що всі багатоатомні іони, назви яких закінчуються на "-ate" містять на один більше кисню, ніж ті багатоатомні аніони, назви яких закінчуються на "-ite». На жаль, подібно до загальної системи іменування перехідних металів, ці суфікси вказують лише на відносну кількість кисню, які містяться всередині багатоатомних іонів. Наприклад, як нітратний іон, що символізується як NO 3 −, так і сульфатний іон, що символізується як SO 4 2 -, мають суфікс "-ate", однак перший містить три кисню, а останній містить чотири. Крім того, як іон нітроїдів, так і іон сіркоцитів містять три кисню, але ці багатоатомні іони не мають спільного суфікса. На жаль, відносна природа цих суфіксів передбачає, що комбінації іонних формул/іонних назв багатоатомних іонів повинні просто запам'ятовуватися.