7.4: Співвідношення тиску і температури
- Page ID
- 25546
Розглянемо газ в балоні з поршнем на рис\(\PageIndex{1}\). Підвищення температури збільшує середню кінетичну енергію (КЕ) і середню швидкість молекул газу, що призводить до більш частих і сильних зіткнень, що призводить до збільшення тиску газу, що подається на поршень або стінки газового контейнера.
Закон Гей-Люссака стверджує, що тиск газу прямо пропорційний абсолютній температурі за умови, що обсяг і кількість газу не змінюються.
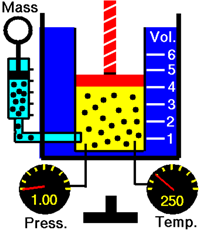
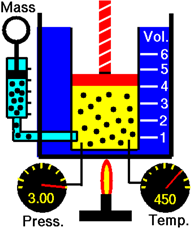
Математичні форми закону Гей-Люссака наступні.
\[P\propto{T}\nonumber\], або\[P=\mathrm{k}T\nonumber\], або\[\frac{P}{T}=\mathrm{k}, \nonumber\]
де\(k\) - постійна,\(P\) - тиск,\(T\) а температура (в шкалі Кельвіна) газу. Оскільки\(\frac{P}{T}\) Since є постійною, це означає, що
\[\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}=\mathrm{k}, \nonumber\]
де\(P_1\) початковий тиск,\(T_1\) це початкова температура в Кельвіні,\(P_2\) є кінцевим тиском, і\(T_2\) є кінцевою температурою в Кельвіні, за умови, що кількість газу і обсяг не змінюються.
Тиск кисневого бака, що містить 15,0 л кисню, становить 965 Торр при 55 o С. Яким буде тиск при охолодженні бака до 16 o С.
Рішення
По-перше, перетворіть температури в шкалу Кельвіна, перш ніж застосовувати газові закони.
Дано: Т 1 = 55 о С + 273,15 = 328,15 К, Т 2 = 16 о С + 273,15 = 289,15 К, Р 1 = 965 Торр, Р 2 =?
Формула:
\[\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}, \nonumber\]
переставити формулу для виділення потрібної змінної:
\[P_{2}=\frac{P_{1} T_{2}}{T_{1}} \nonumber\]
Вставте значення в переставлену формулу і розрахуйте:
\[P_{2}=\frac{965 \mathrm{~Torr} \times 298.15\mathrm{~K}}{328.15 \mathrm{~K}}=850 \mathrm{~Torr} \nonumber\]
