7.3: Взаємозв'язок температура-об'єм
Розглянемо газ в балоні з поршнем на рис.7.3.1. Підвищення температури збільшує середню кінетичну енергію (КЕ) молекул газу. Кінетична енергія (КЕ) прямо пропорційна швидкості молекулKE=12mv2, тобто де m - маса, а v - швидкість. Так, підвищення температури збільшує швидкість, що призводить до більш частих і більш сильних зіткнень, що призводить до підвищення тиску газу всередині камери. Об'єм газу починає збільшуватися, внаслідок чого тиск зменшується до тих пір, поки тиск всередині камери не буде дорівнює тиску зовні. Іншими словами, підвищення температури збільшує обсяг газу, якщо тиск і кількість газу не змінюються.
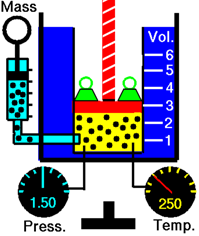
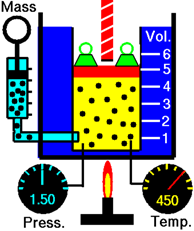
Якщо два пов'язаних параметра збільшуються або зменшуються разом, вони прямо пропорційні один одному.
Закон Чарльза говорить, що обсяг заданої кількості газу прямо пропорційний температурі в шкалі Кельвіна при постійному тиску.
Рис. 7.3.2 демонструє, що обсяг газу зменшується при охолодженні газу.



Математичні форми права Карла такі.
V∝T
, Де k - постійна, V - об'єм, а T - температура (в шкалі Кельвіна) газу. ОскількиVT це константа, це означає, що
V1T1=V2T2=k
де V 1 - початковий обсяг, T 1 - початкова температура в Кельвіні, V 2 - кінцевий обсяг, а T 2 - кінцева температура в Кельвіні за умови, що кількість газу і тиск не змінюються. Зверніть увагу, що шкала Кельвіна використовується в законі Чарльза, оскільки шкала Кельвіна не має від'ємних чисел, що означає, що лінійна крива починається від початку без будь-якого перехоплення y. Якщо задана температура не знаходиться в шкалі Кельвіна, спочатку перетворіть температуру в шкалу Кельвіна, а потім використовуйте газові закони для розрахунків.
Зразок СО 2 займає об'єм 3,23 л при 25,0 о С. Розрахувати обсяг газу при 50,0 o С, якщо тиск і кількість газу не змінюються?
Рішення
Дано: Т 1 = 25,0 о С + 273 = 298 К, Т 2 = 50,0 о С + 273 = 320 К, В 1 = 3,23 Л, В 2 =?
Формула:V1T2=V2T2, переставляємо формулу, щоб виділити потрібну змінну:V2=V1T1T2
Вставте значення в переставлену формулу і розрахуйте:V2=3.23 L×3.20 K273 K=3.79 L
Закон Чарльза пояснює дрейфування теплого повітря вгору в атмосфері. Коли газ глистів, його обсяг збільшується, а його щільність зменшується, що змушує газ дрейфувати вгору. Повітряна куля, показана на рис. 7.3.3, працює за допомогою гарячого повітря.

