7.2: Співвідношення тиску-об'єму
- Page ID
- 25556
Співвідношення тиску-об'єму
Розглянемо газ в балоні з поршнем, що штовхає його вниз за рахунок розміщених на ньому масивних предметів і за рахунок зовнішнього тиску повітря, як показано на рис. 7.2.1, Молекули газу вдаряють по поверхні поршня, надаючи тиск вгору рівне тиску вниз, що додається поршнем, який тримає поршень нерухомим. Збільшення тиску на поршень, наприклад, додаючи йому більшу вагу, змушує поршень рухатися вниз, зменшуючи обсяг газу. Молекули газу мають меншу відстань для переміщення перед ударом по поверхні поршня, що збільшує частоту зіткнення і призводить до збільшення тиску газу, поки не стане рівним зовнішньому тиску.
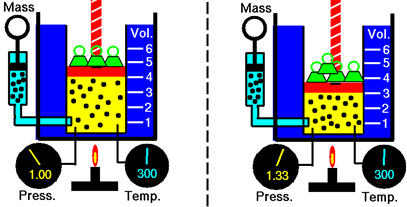
Коли зміна одного параметра викликає зміну іншого, параметри пов'язані між собою. Коли збільшення одного параметра викликає зменшення іншого, два обернено пропорційні один одному. Роберт Бойл вивчав кількісну залежність між об'ємом і тиском газу, зберігаючи кількість газу і температуру постійними. Дослідження укладено в законі під назвою закон Бойля, який стверджує, що:
Обсяг газу обернено пропорційний тиску газу за умови, що температура і кількість газу залишаються постійними.
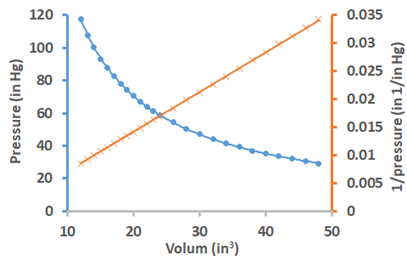
Рис. 7.2.2 ілюструє результати експерименту Бойла. Математична форма закону Бойла така:\[V \propto \frac{1}{P}\nonumber\], або\[V=\frac{\mathrm{k}}{P}\nonumber\], або\[PV=\mathrm{k}\nonumber\], де k - константа. Графік об'єму проти тиску криволінійний, але графік об'єму проти зворотного тиску - це лінійний графік, що показує зворотну пропорційність між об'ємом і тиском. Оскільки продукт ПВ є постійною, то це означає, що:\[P_{1} V_{1}=P_{2} V_{2}={k}\nonumber\], тобто твір початкового тиску (P 1) і початкового об'єму (V 1) дорівнює добутку кінцевого тиску (P 2) і кінцевого обсягу (V 2) газу за умови, що кількість газу і температура не змінюється.
Тиск 1,32 л проби газу SO 2 при 0,532 атм збільшено до 1,231 атм. Розрахувати новий обсяг газу, якщо температура і кількість газу залишаються колишніми?
Рішення
Дано: Р 1 = 0,532 атм, Р 2 = 1,231 атм, V 1 = 1,32 Л V 2 =?
Формула:\(P_{1} V_{1}=P_{2} V_{2}={k}\), переставити, щоб ізолювати потрібну змінну:\(V_{2}=\frac{P_{1} V_{1}}{P_{2}}\).
Вставте значення в переставлену формулу і розрахуйте:\(V_{2}=\frac{0.532 \mathrm{~atm} \times 1.32 \mathrm{~L}}{1.231 \mathrm{~atm}}=0.570 \mathrm{~L}\)
Кисневий балон вміщує 20,0 л кисню при тиску 10,0 атм. Яке кінцевий тиск, коли газ виділяється і займає обсяг 200 л?
Рішення
Дано: V 1 = 20,0 л, V 2 = 200 л, Р 1 = 10,0 атм Р 2 =?
Формула:\(P_{1} V_{1}=P_{2} V_{2}={k}\), переставити, щоб ізолювати потрібну змінну:\(P_{2}=\frac{P_{1} V_{1}}{V_{2}}\).
Вставте значення в переставлену формулу і розрахуйте:\(P_{2}=\frac{10.0 \mathrm{~atm} \times 20.0 \mathrm{~L}}{200 \mathrm{~L}}=1.00 \mathrm{~atm}\).
процес дихання
Закон Бойла пояснює механізм процесу дихання. Легкі являють собою еластичні структури на зразок повітряних кульок, поміщених в грудну порожнину, як показано на рис. 7.2.3. М'яз діафрагми робить гнучку підлогу, а ребра оточують порожнину.
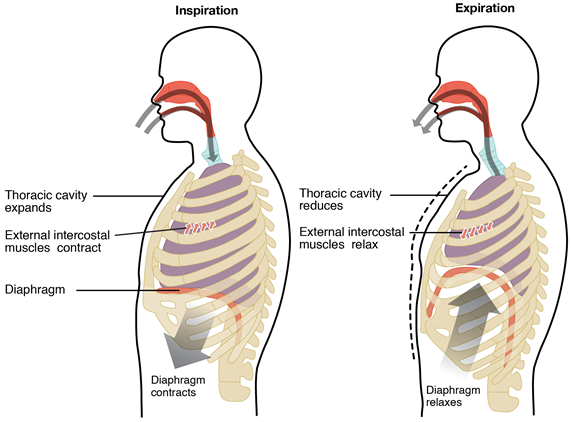
Інгаляції
Процес вдиху або вдиху починається, коли діафрагма стискається і рухається вниз, а м'язи ребер скорочуються, розширюючи грудну порожнину. Об'єм збільшується, тиск повітря зменшується всередині грудної порожнини і атмосферне повітря надходить в легені до тих пір, поки тиск в легенях не буде дорівнює зовнішньому тиску.
видих
Процес видиху або видиху починається тоді, коли діафрагма розширюється і рухається вгору, а м'язи ребер розслабляються, скорочуючи грудну порожнину. Обсяг зменшується і всередині грудної порожнини збільшується тиск повітря, що викачує повітря з легенів в атмосферу.
