7.1: Характеристики газів
- Page ID
- 25555
Що таке газ
Газ - одне з чотирьох станів речовини, яке потрапляє між рідким і плазматичним станом. Повітря навколо нас - це газ, що складається з ~ 78% азоту (N 2), ~ 21% кисню, а решта ~ 1% - інші гази, включаючи вуглекислий газ, водяні пари, аргон тощо, як показано на рис. 7.1.1.
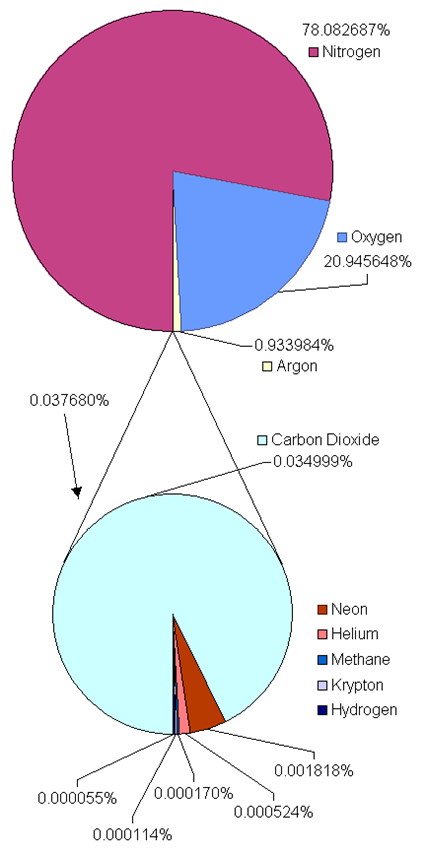
Елементи, які існують як гази при кімнатній температурі та атмосферному тиску, включають благородні гази, які є моноатомними молекулами, включаючи гелій (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) та радон (Rn), і двоатомні елементарні молекули, які включають водень (H 2), азот (N 2) ), кисень (O 2) і два галогени: фтор (F 2) і хлор (Cl 2). Кілька молекулярних сполук існують у вигляді газів при кімнатній температурі, наприклад, діоксид вуглецю (CO 2), окис вуглецю (CO), метан (CH 4), діоксид азоту (NO 2), діоксид сірки (SO 2), сірководень (H 2 S), аміак (NH 3).
Властивості газів визначаються їх кількістю в молі (n), об'ємом (V), температурою (T) і тиском (P). Ці параметри описані в наступному.
Кількість газу
Кількість газу вимірюється в молі (n), тобто 6.022 х 10 23 молекули газу - це один моль газу. Газ має масу і може вимірюватися в одиницях маси, таких як грами або кілограми, але масу потрібно розділити на молярну масу газу, щоб отримати кількість в молі для розрахунків.
Кількість газу в молі необхідно в газових законам, оскільки властивості газів пропорційні кількості молекул, а не масам молекул.
Скільки родимок в 10,0 г газу кисню?
Рішення
Крок 1. Дано: Маса = 10,0 г O 2, Бажане:? родимки О 2.
Крок 2. Рівність між заданою і потрібною одиницями: 1 моль О 2 = 32,00 г О 2.
Крок 3. Коефіцієнти перерахунку від рівності:\(\frac{1~mol~O_2}{32.00~g~O_2}\) і\(\frac{32.00~g~O_2}{1~mol~O_2}\)
Крок 4. Помножте задану величину на коефіцієнт перетворення, який скасовує дане і залишає бажану одиницю у відповіді:\[10.0 \cancel{~g~O_2)}\times\frac{1~mol~O_2}{32.00\cancel{~g~O_2}} = 0.312 ~g~O_2\nonumber\]
Обсяг газу
Об'єм (V) - простір, який займає речовина. Одиницею об'єму СІ є метровий куб (м 3), тобто простір всередині куба 1м х 1м х 1м.
Зазвичай обсяг повідомляється в літрах (L), що дорівнює дм 3, або мілілітрі (мл), що дорівнює см 3. Взаємозв'язок між одиницями об'єму наступна.
\[1 \mathrm{~m}^{3}=1000 \mathrm{~L}\nonumber\]
\[1 \mathrm{~L}=1000 \mathrm{~mL}\nonumber\]
Гази не мають фіксованої форми або обсягу. Гази набувають форму ємності. Гази розширюються або стискаються, щоб заповнити наявний простір у контейнері.
Температура газу
Температура (T) - це показник того, наскільки гарячим або холодним є об'єкт.
Температура - це прояв теплової енергії речовини. Теплова енергія є джерелом тепла. Тепло - це потік енергії від гарячого до холодного предмета. Одиницею температури СІ є Кельвін (К), який має значення 273,15 К при температурі замерзання води і 375,15 К при температурі кипіння води. Нулем шкали Кельвіна називають абсолютний нуль, при якому більше енергії не може витікати з речовини як тепло. Від'ємного числа на шкалі температури Кельвіна немає.
Іншими часто використовуваними одиницями температури є Цельсія (o С), який має значення 0 o C при температурі замерзання води і 100 o C при температурі кипіння води. Зв'язок між температурою в кельвіні (T K) і температурою в Цельсії (T C) наступний.
\[T_{K}=T_{C}+273.15\nonumber\]
Фаренгейт - це температурна шкала, що використовується в англійській системі вимірювання, яка має значення 32 o F при температурі замерзання води і 212 o F при температурі кипіння води. Зв'язок між температурою в Фаренгейті (T F) і температурою в Цельсії (T C) наступний.
\[T_{F}=\frac{9}{5} T_{C}+32\nonumber\]
Температура в Кельвіні (К) використовується в розрахунках газового закону.
Тиск газу
Тиск (P) - сила (F) на одиницю площі (A), т. Е\(P = \frac{F}{A}\).
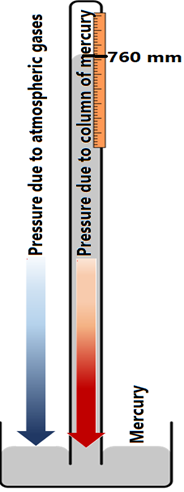
Матерія має масу і застосовує силу, яка є вагою за рахунок гравітаційного тяги. Наприклад, колона 1 м х 1м на рівні моря і висоті, рівній земній атмосфері, як показано на рис. 7.1.2, має масу ~ 10 000 кг. Ртуть (Hg), заповнена колоною 1 м х 1м і висотою 0,760 м, має таку ж масу, як і маса повітря 1 м х 1 м стовпа, що простягається від рівня моря до всієї атмосфери землі.

Стовп повітря, що йде від рівня моря до всієї атмосфери, застосовував тиск, рівний одній атмосфері (атм), де атм - одиниця тиску. Одна атмосфера (атм) дорівнює 760 міліметру ртутного стовпа (мм рт.ст.), де мм рт.ст. - інша одиниця тиску. Один мм рт. ст. також називається Торр. Взаємозв'язок між атм, мм рт.ст., і Торр наступний.
\[1\mathrm{~atm}=760 \mathrm{~mmHg} = 760 \mathrm{~Torr}\nonumber\]
Одиницею тиску СІ є паскаль (Па), що представляє собою тиск (P), прикладене силою (F) одного ньютона (N) на площі в один метр квадратний (м 2). Математична форма одиниці буває:\(1 ~Pascal = \frac{1~Newton}{1 ~meter-square}\) або\(Pa = \frac{N}{m^2}\)
Кілопаскаль дорівнює 1000 Па, а кілопаскаль ще називають барною стійкою. Англійська системна одиниця тиску - фунт-сила на квадратний дюйм (psi). Взаємозв'язок між різними одиницями тиску, згаданими вище, полягає в наступному.
\[1 \mathrm{~atm}=760 \mathrm{~mm} \mathrm{Hg}=760 \mathrm{~Torr}=1.01325 \times 10^{5} \mathrm{~Pa}=1.01325 \times 10^{2} \mathrm{~kP}=1.01325 \mathrm{~bar}=14.7 \mathrm{~psi}\nonumber\]
Ці відносини змінюються на коефіцієнти перетворення, які дозволяють переходити з однієї одиниці тиску в іншу, як пояснюється в наступних прикладах.
Експрес 51 мм рт.ст. в а) атм і б) в Па.
Рішення
Дано: Тиск = 51 мм рт. ст. Потрібно: тиск в атм і Па
Взаємозв'язок між мм рт.ст. і атм:\(1\mathrm{~atm}=760 \mathrm{~mm Hg}\nonumber\)
Коефіцієнти перерахунку від рівності:\(\frac{1 \mathrm{~atm}}{760 \mathrm{~mm} \mathrm{Hg}}\nonumber\) і\(\frac{760 \mathrm{~mm} \mathrm{Hg}}{1 \mathrm{~atm}}\nonumber\)
Розрахунки: помножте задану величину на коефіцієнт перетворення, який скасовує задану одиницю і залишає бажану одиницю у відповіді.
\[51 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1 \mathrm{~atm}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=6.7 \times 10^{-2} \mathrm{~atm}\nonumber\]
Аналогічно залежність між мм рт.ст. і Па:\(760 \mathrm{~mm Hg}=1.01325 \times 10^{5} \mathrm{~Pa}\nonumber\)
Коефіцієнти перерахунку від рівності:\(\frac{760 \mathrm{~mm Hg}}{1.01325 \times 10^{5} \mathrm{~Pa}}\nonumber\) і\(\frac{1.01325 \times 10^{5} \mathrm{~Pa}}{760 \mathrm{~mm Hg}}\nonumber\)
Розрахунки: помножте задану величину на коефіцієнт перетворення, який скасовує задану одиницю і залишає бажану одиницю у відповіді.
\[51 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1.01325 \times 10^{5} \mathrm{~Pa}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=6.8 \times 10^{3} \mathrm{~Pa}\nonumber\]
Вимірювання тиску газу
Прилад, який використовується для вимірювання атмосферного тиску, називається барометром.
Барометр, показаний на рис. 7.1.3, винайшла Євангеліста Торрічеллі. Це скляна трубка довжиною понад 760 мм і закрита одним кінцем. Скляна трубка заповнена ртуттю і перевернута, щоб занурити її відкритий кінець в посуд, яка містить шар ртуті. Ртуть падає з трубки через свою вагу, але перестає падати, коли стовпчик ртуті досягає 760 мм у висоту на рівні моря через атмосферний тиск, що штовхає її назад у трубку. Пам'ятайте 760 мм рт.ст. = 1 атм. Вище 760 мм знаходиться розрідження в трубці.
Тиск газів в лабораторії зазвичай вимірюється за допомогою приладу, званого манометром.
Манометр - це U-подібна скляна трубка, частково заповнена ртуттю, як показано на рис.7.1.4. Один кінець U-трубки з'єднаний з газовою камерою, в якій вимірюється тиск, а інший кінець або закритий (з вакуумом на закритому кінці), званий манометром із закритим кінцем, або він відкритий в атмосферу, званий манометром відкритого типу.

У випадку з манометром закритого типу тиск газу дорівнює різниці висоти ртуті в двох плечах U-трубки в мм рт.ст., тобто висоті (h) від точки N до точки B в міліметрових одиницях, як показано на рис.7.1.4.
Розрахувати тиск в атм для газу, показаного на рис. 7.1.4 в замкнутому манометрі, якщо h = 40 мм?
Рішення
У манометрі закритого типу тиск газу дорівнює висоті h в мм рт.ст.: P = 40 мм рт.ст.
Тиск в атм:
\[40 \cancel{\mathrm{~mm} \mathrm{Hg}} \times \frac{1 \mathrm{~atm}}{760 \cancel{\mathrm{~mm} \mathrm{Hg}}}=5.3 \times 10^{-2} \mathrm{~atm}\nonumber\]
У разі відкритого манометра тиск газу дорівнює різниці висоти ртуті в двох плечах U-трубки в мм рт.ст плюс атмосферний тиск зовні, виражений в мм рт.ст.
Зміна тиску повітря з висотою
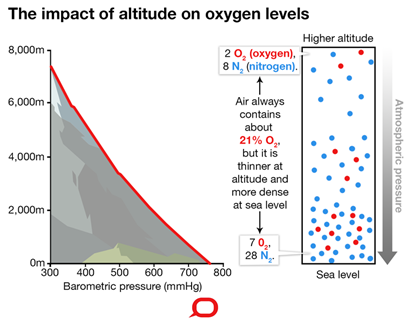
Тиск повітря зменшується, а концентрація газу зменшується в міру збільшення висоти, як показано на рис. 7.1.5. Концентрація кисню в повітрі також зменшується зі збільшенням висоти. Ось чому альпіністи відчувають недостатнє надходження кисню в організм на великих висотах - медичний стан, який називається гіпоксією.
Артеріальний тиск
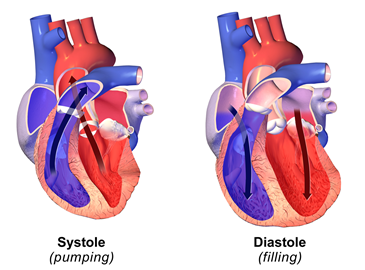
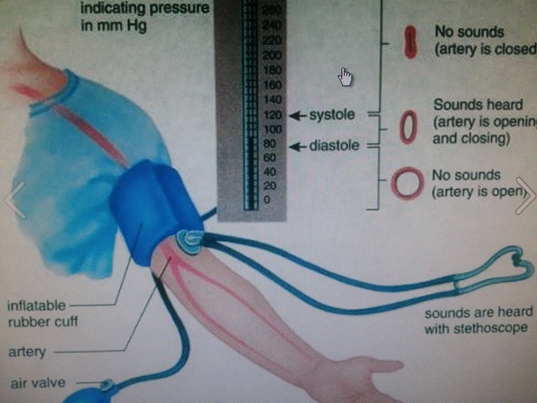
Серце перекачує кров в кровоносну систему. Коли серце скорочується, воно чинить тиск на кров, що знаходиться в ньому, і кров викачує з серця в кровоносну систему, як показано на рис. 7.1.6. Кров'яний тиск в кровоносній системі найвищий в цій точці, і називається воно систолічним. Вона може знаходитися в діапазоні від 100 до 200 мм рт.ст. Бажаний діапазон систолічного тиску становить від 100 до 120 мм рт.ст. Коли серцеві м'язи розслабляються, порожнина в серці розширюється і більше крові наповнюється серцем. Артеріальний тиск в кровоносній системі в цій точці мінімально, і називається воно діастолічним. Діастолічний тиск може варіюватися в діапазоні від 60 до 110 мм рт.ст. Бажаний діастолічний тиск менше 80 мм рт.ст.
Прилад, який використовується для вимірювання артеріального тиску, називається сфігмометром. Він складається з манжети, яка обертається навколо плеча, насоса для надування повітря в манжеті і стетоскопа для чуття звуку кровотоку, як показано на рис. 7.1.7. Манжета надувається повітрям до тиску вище систолічного тиску і це призводить до відсікання кровотоку через плечову артерію в плечовій артерії в області плеча. Стетоскоп використовується, щоб почути звук кровотоку. Ніякого звуку в цей момент не чути. Тиск в манжеті повільно знижується. Коли тиск в манжеті дорівнює систолічному тиску, кров починає вириватися в артерію, а через стетоскоп чути постукуючий звук. У точці, коли тиск дорівнює діастолічному, кров вільно тече по артерії, а постукуючий звук зникає. Показання артеріального тиску повідомляється як набір з двох чисел, наприклад, 120/80, де більше число - систолічний, а нижнє - діастолічний тиск.
Кінетична молекулярна теорія газів
Фізичні характеристики газів пояснюються моделлю під назвою кінетична молекулярна теорія газів, проілюстрована на рис.7.1.8.
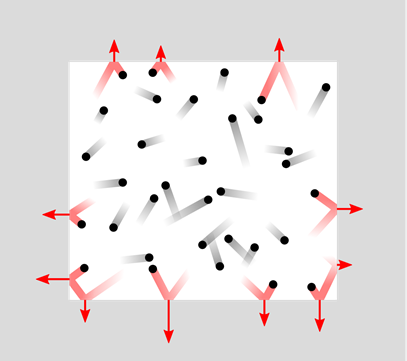
- Гази складаються з частинок, званих молекулами, які знаходяться далеко один від одного. Внаслідок великих відстаней міжмолекулярні сили мізерно малі, а обсяг, зайнятий молекулами газу, мізерно малий.
- Молекули газу рухаються по прямих лініях у випадкових напрямках, поки не зіткнуться з іншою молекулою або стінкою контейнера.
- Зіткнення пружні, тобто загальна енергія зберігається, але молекули змінюють напрямок і змінюють швидкість після зіткнення. Це призводить до розподілу молекулярних швидкостей в широкому діапазоні.
- Середня кінетична енергія молекул газу прямо пропорційна абсолютній температурі. Середня кінетична енергія молекул різних газів однакова при одній і тій же температурі.
Пояснення характеристик газів на основі кінетичної молекулярної теорії газів
- Піддаючи газ вакууму, молекули газу продовжують рухатися прямим шляхом у вакуумі, поки вони не зіткнуться з кордоном контейнера і не відскакують назад. Це пояснює, що гази розширюються. Зіткнення молекул газу зі стінкою надають зовнішній тиск на стінку і, як реакція, стінка чинить рівний внутрішній тиск на газ. Застосування більшого тиску на газ через будь-яку ділянку газової межі порушує вищезгаданий баланс дії і реакційних сил, в результаті чого відбувається рух всередину ділянки прикордонної поверхні. Іншими словами, гази стисливі.
- Якщо межа, що розділяє два гази, видаляється, випадкові молекулярні рухи в кінцевому підсумку змішують два гази, утворюючи однорідну суміш, тобто гази повністю змішуються з іншими газами.
- При підвищенні температури молекули газу рухаються швидше, а колоїдні частіше, що пояснює той факт, що гази надають більший тиск при нагріванні і розширюються, якщо межа не жорстка. Частіше лопання шин влітку відбувається через підвищення тиску за рахунок нагрівання.
- Коли в шині наповнюється більша кількість газу, тиск збільшується через більш частих зіткнень. Стиснення газу в менший об'єм мають той же ефект, тобто молекулярні зіткнення збільшують тиск.
Фізичні характеристики газів не залежать від природи молекул газу через незначні міжмолекулярні взаємодії, але залежать від чотирьох фізичних властивостей, тобто тиску, обсягу, температури та кількості газу. Наступні розділи описують взаємозв'язок між фізичними властивостями газів.
