3.2: Іменування бінарних іонних сполук
Бінарні іонні сполуки - це з'єднання, що складаються з одноатомних катіонів і одноатомних аніонів Наприклад, NaCl - бінарне іонне з'єднання, що складається з одноатомних катіонів Na + і одноатомних аніонів Cl -. Іншим прикладом є CaCl 2, що складається з одноатомних катіонів Ca 2 + і одноатомних аніонів Cl -.
Заряд на одноатомних іоні
Неметали і металоїди від 14 до 17 групи зазвичай утворюють одноатомні аніони. Заряд на аніоні дорівнює номеру групи мінус вісімнадцять. Наприклад, галогени в 17 групі мають заряд: 17-18 = -1, кисень в групі 16 має заряд: 16-18 = -2, а азот в групі 15 має заряд: 15-18 = -3. Метали зазвичай утворюють катіони: метали групи 1 з +1, метали групи 2 утворюють +2, а алюміній групи 13 утворюють +3 заряд на катіоні, як показано на рис.3.2.1. Інші метали мають змінні заряди в сполуках. Заряд металів, що мають змінний заряд, можна обчислити за хімічною формулою сполуки, оскільки загальний заряд —ve повинен дорівнювати загальному заряду +ve, щоб зробити з'єднання нейтральним.
розрахувати заряд іона заліза в FeCl 2?
Рішення
Три - два хлоридних аніона, кожен з -1 зарядом, що становить в цілому -2. Так що заряд на катіоні повинен бути +2, щоб збалансувати негативний заряд. Відповідь: Фе 2 +.
Розрахувати заряд на іон заліза в Fe 2 O 3?
Рішення
Є три аніона кисню, кожен з яких -2 заряду, що робить -6. Так загальний заряд на двох атомах заліза повинен дорівнювати +6, тобто заряд на атомах заліза дорівнює +3. Відповідь: Фе 3 +.
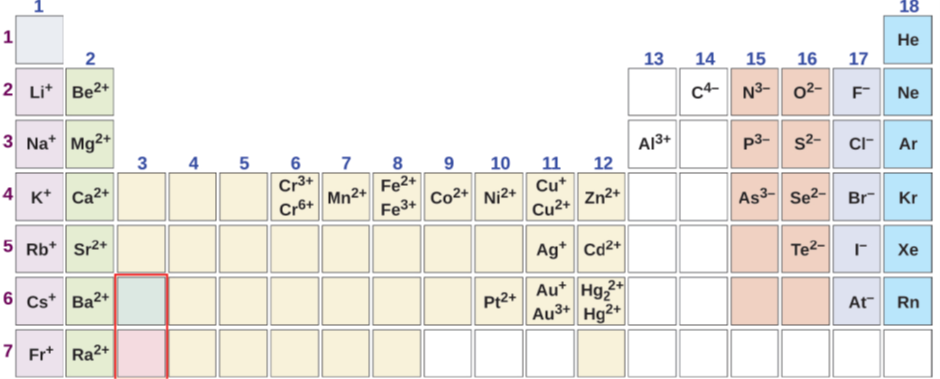
Назви одноатомних іонів
Назва одноатомного аніона
Ім'я одноатомного аніону - це назва елемента з останнім складом, заміненим на —ide ion. Наприклад, Cl - це іон хлориду, O 2- іон оксиду, N 3- іон нітриду, S 2- сульфідний іон, а C 4- іон карбіду, отриманий від назв елементів хлор, кисень, азот, сірка і вуглець відповідно.
Назва одноатомного катіона, що має фіксований заряд
Лужні метали мають +1, лужноземельні - +2, а алюміній має +3 заряду. Їх назва - назва елемента, що закінчується на ion. Наприклад, Na + - іон натрію, Ca 2 + - іон кальцію, а Al 3 + - іон алюмінію.
Назва одноатомного катіону, що має змінний заряд
Назви катіонів, які мають змінний заряд, - це назва елемента, за яким слідує заряд римською цифрою, укладеною в маленькі приквітки і закінчується іоном. Наприклад, Fe 2 + - іон заліза (II), а Fe 3 + - іон заліза (III), Cu + - іон міді (I), а Cu 2 + - іон міді (II).
Іони, які важливі в рідинях організму, включають іон натрію (Na +), іон калію (K +), іон кальцію (Ca 2 +), іон магнію (Mg 2 +) і хлорид-іон (Cl -), як показано на рис. 3.2.2. Na + присутній в рідинях всередині клітин. Він регулює і контролює рідини організму. K + присутній у рідинях поза клітинами і регулює рідини організму та функції клітин. Ca 2 + і Ma 2 + присутні в рідинях організму поза клітинами, де Ca 2 + потрібен для скорочення м'язів, Mg 2 + потрібен для скорочення м'язів, контролю нервів і ферментів. Cl - в першу чергу присутній для збалансування заряду катіонів в рідинях організму.
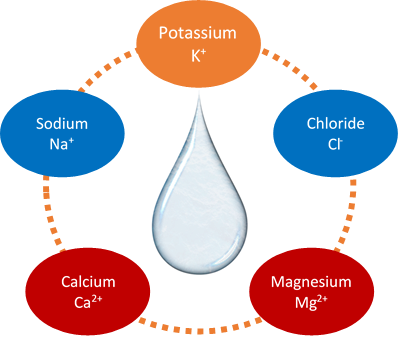
Написання формули бінарних іонних сполук
Формула іонного з'єднання - це символ катіонного елемента з індексним номером, за яким слідує символ аніонного елемента з індексним числом. Формула показує найпростіший коефіцієнт цілого числа складових елементів у індекси, таким чином, що загальний позитивний заряд дорівнює загальному негативному заряду. Сценарій праворуч від символів повідомляє число, якщо вони більше одного атома елемента.
Правила проілюстровані на рис. 3.2.3:
- Напишіть катіон, а потім аніон з зарядами,
- поміняти заряд у вигляді індексу протилежного іона,
- спростити індекс до найпростішого співвідношення цілих чисел,
- використовувати спрощений індекс в кінцевій формулі, і
- не пишіть індекс, якщо він один.
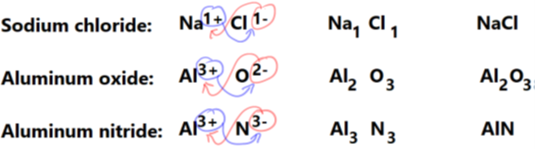
Написання назв іонного з'єднання з формули
Написання назви іонних сполук катіонів з фіксованим зарядом
Якщо катіон має фіксований заряд в з'єднаннях, назва починається з назви елемента катіона, після чого в кінці йде назва аніона без світового іона. Наприклад, КІ - йодид калію, а CaCl 2 - хлорид кальцію.
Написання назви іонних сполук катіонів зі змінним зарядом
Напишіть назву катіона, включаючи заряд римськими цифрами, укладеними в маленькі дужки, але без слова ion в кінці, а потім назва аніону, без іона в кінці. Наприклад, FeCl 2 - це хлорид заліза (II), а Fe 2 O 3 - оксид заліза (III). Додаткові приклади наведені в таблиці 1.
Катіони срібла, цинку та кадмію мають фіксовані зміни: Ag +, Zn 2 + та Cd 2 +. Назви цих катіонів - це назви елемента з зарядом або без нього, показані римськими цифрами, обидва способи це правильно.
|
Приклад# |
Формула |
Найменування катіона |
Назва аніона |
Найменування з'єднання |
|---|---|---|---|---|
|
1 |
NaCl |
іон натрію |
Хлорид-іон |
Хлорид натрію |
|
2 |
Всі 2 з 3 |
Іон алюмінію |
Оксид-іон |
оксид алюмінію |
|
3 |
FeCl 3 |
Іон заліза (III) |
Хлорид-іон |
Хлорид заліза (III) |
|
4 |
КуО |
Іон міді (II) |
Оксид-іон |
Оксид міді (II) |
|
5 |
AgCl |
Іон срібла (I), або Іон срібла |
Хлорид-іон |
Хлорид срібла (I), або Хлорид срібла |
