3.1: Склеювання в сполуках
- Page ID
- 25463
Хімічні зв'язки
Сполуки являють собою чисту форму речовини, утворену атомами більше одного елемента, об'єднаних в постійному цілому числовому співвідношенні.
Зв'язки з'єднують атоми в сполуках. Обмін або передача деяких валентних електронів від одного атома до іншого робить зв'язки. Благородні гази мають повну валентну оболонку з восьми валентних електронів, крім гелію, який має повну валентну оболонку з двох валентних електронів. Благородні гази є найменш реактивними, тобто найбільш інертною групою елементів.
Правило октету стверджує, що атоми всіх елементів, крім благородних газів, як правило, діляться, втрачають або отримують валентні електрони, щоб придбати електронну конфігурацію найближчого благородного газу, що має вісім валентних електронів.
ковалентні зв'язки
Зв'язок, утворена спільним використанням електронів, - це ковалентний зв'язок.
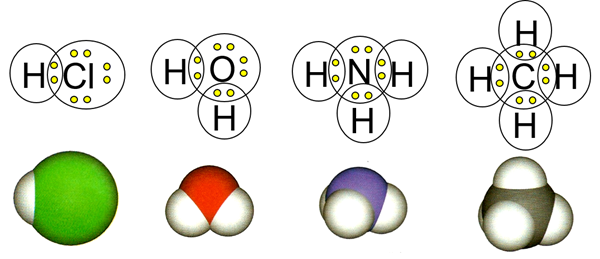
Коли неметалевий атом поєднується з іншим атомом неметалу, вони зазвичай утворюють ковалентний зв'язок. Ковалентний зв'язок - це пара спільних електронів, звана зв'язковою парою електронів, де кожен пов'язаний атом вносить один електрон. Наприклад, хлор має сім валентних електронів і потребує ще одного, щоб завершити свій октет. Водень має один валентний електрон і вимагає ще одного для придбання електронної конфігурації гелію, тобто дуету замість октету. Водень і хлор об'єднуються, розділяючи один електрон, щоб зробити з'єднання HCl. Так само кисень, азот і вуглець утворюють 2, 3 і 4 ковалентні зв'язки з воднем, щоб завершити їх октет і зробити сполуки H 2 O, NH 3 і CH 4 відповідно, як показано на рис. 3.1.1.
Два атоми можуть розділяти один, два або три електрони, щоб створити один, подвійний або потрійний ковалентний зв'язок. Наприклад, Н 2 має одинарний зв'язок (H-H), O 2 має подвійний зв'язок (O = O), а N 2 має потрійний зв'язок (NN), де кожна лінія між атомами представляє одну ковалентну зв'язок. Рис. 3.1.2 ілюструє утворення трьох ковалентних зв'язків в N 2. Валентна електронна пара, яка не бере участі в зв'язку, називається незв'язної парою. Одна незв'язна пара і три пари зв'язку завершують октет кожного атома азоту в молекулі N 2, як показано на рис. 3.1.2.
Зв'язкова пара електронів розраховує до загальної валентності електронів кожного зв'язаного атома., тобто в H-H кожен атом водню має два валентні електрони, а в: NN: кожен азот має вісім валентних електронів; два в незв'язній парі і шість у трьох парах зв'язку.

Формула ковалентного з'єднання
З'єднання представлено хімічною формулою, яка об'єднує в собі символи складових його елементів. Більше електропозитивних елементів зазвичай пишуться спочатку, наприклад, HF, NO, CO. Деякі винятки з цього правила, наприклад, NH 3 та CH 4, мають більше електронегативних елементів, написаних першими. Більшість ковалентних сполук існують у вигляді дискретних молекул. Індексит праворуч від символу елемента представляє кількість атомів компонента молекули. Наприклад, H 2 O має два атоми водню і один атом кисню в молекулі води. Зауважте, що індекс 1 не записаний, тобто символ елемента є одним атомом.
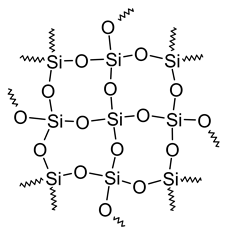
Кілька ковалентно зв'язаних сполук - це гігантські молекули, де атоми утримуються разом 3D-мережею зв'язків. Формула цих сполук показує найпростіше співвідношення цілого числа елементів в з'єднанні. Наприклад, на рис. 3.1.3 показаний SiO 2, присутній в піску і кварці високої чистоти, гігантській молекулі.

Іонний зв'язок
Зв'язок, утворена при передачі електронів від одного атома до інших атомів, являє собою іонний зв'язок.
З'єднання, яке має іонні зв'язки, - це іонна сполука. Зазвичай атоми металів втрачають електрони і стають катіонами, а неметалеві атоми отримують електрони, щоб стати аніонами. Електростатичне тяжіння між протилежними зарядами утримує іони разом в іонному з'єднанні. Наприклад, натрій (Na) втрачає один електрон, а фтор (F) набирає один електрон для отримання з'єднання фториду натрію (NaF), як показано на рис. 3.1.4.
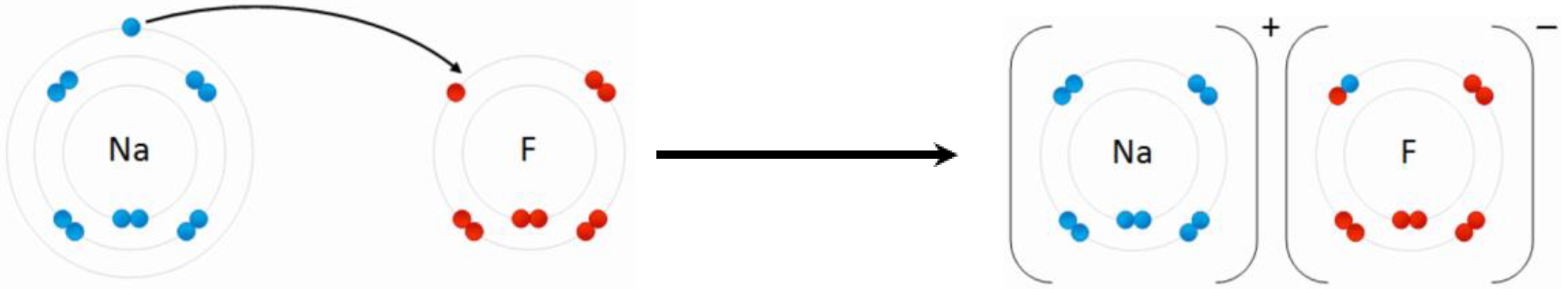
Іонні сполуки
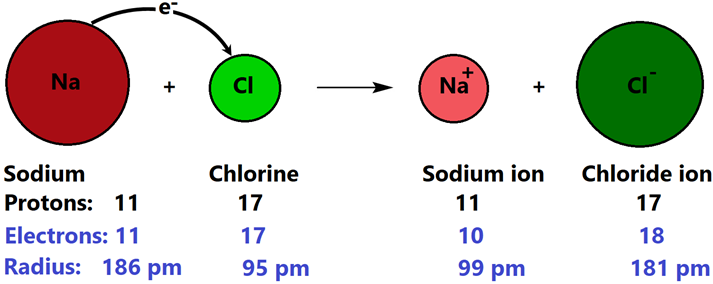
Кухонна сіль, т. Е. NaCl є прикладом іонного з'єднання. Na завершує свій октет, втрачаючи один електрон і стаючи катіоном Na +. Втрата електронів зменшує електронно-електронне відштовхування, але електронно-ядро тяжіння залишається колишнім. Отже, електронна хмара навколо ядра скорочується. Аналогічно атом хлору має сім валентних електронів. Після отримання одного електрона він стає Cl - аніоном з його октетом повним. Отримання електронів збільшує електронно-електронне відштовхування, але електронно-ядро тяжіння залишається колишнім. Отже, електронна хмара навколо ядра розширюється. Мал. 3.1.5 ілюструє утворення іонного зв'язку і супутні зміни загального числа електронів і розмірів щодо батьківських нейтральних атомів в разі утворення NaCl.
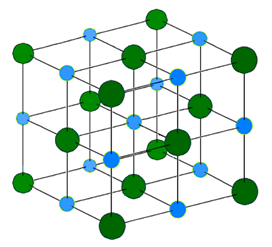
Іонний зв'язок не локалізована або односпрямована. Електростатична сила навколо іонів. Тому катіони оточують аніони, а аніон оточує катіони в регулярному масиві в тривимірній кристалічній решітці. Рис. 3.1.6 ілюструє будову NaCl.
- Формула іонних сполук являє собою найпростіше співвідношення цілого числа атомів складових елементів.
- Катіон завжди менший за розміром, ніж його батьківський нейтральний атом.
- Аніон завжди більший, ніж його батьківський нейтральний атом.


Зазвичай металева і неметалева зв'язок є іонною, а зв'язок між двома неметалами - ковалентна. Кращі критерії ґрунтуються на різниці електронегативності зв'язаних атомів. Електронегативність - це здатність атома притягувати до себе пару зв'язаних електронів. Якщо різниця електронегативності значна, то зв'язкові електрони повністю переходять на більш електронегативний атом, а зв'язок іонна. Немає єдиного значення різниці електронегативності для розділення іонних та ковалентних зв'язків, але зазвичай різниця електронегативності більше 1,8 призводить до іонного зв'язку. В іншому випадку ковалентний зв'язок, але зв'язкові електрони більше спрямовані до більш електронегативного атома, що робить його полярним ковалентним зв'язком. Різниця електронегативності менше 0,5 вважається нековалентним зв'язком, але справжня нековалентна зв'язок утворюється, коли зв'язані атоми є одним і тим же елементом.
властивості з'єднань
Властивості з'єднань зазвичай зовсім відрізняються від властивостей їх складових елементів. Наприклад, водень (Н 2) - це газ, який згорає в кисні, кисень (O 2) - газ, який сприяє горінню, але вода (H 2 O) - рідина, яка гасить вогонь. Аналогічно натрій (Na) - м'який метал, який плавиться при 97,79 o С, хлор (Cl 2) - газ жовтуватого кольору, але хлорид натрію (NaCl) - прозорий кристал, який плавиться при 801 o С.
Міжмолекулярні взаємодії в ковалентних молекулах слабкі до помірні щодо міцності ковалентних зв'язків або іонних зв'язків. Тому ковалентними молекулами, як правило, є гази, такі як O 2, NH 3, CH 4, рідини, такі як H 2 O, або м'які та низькоплавкі тверді речовини, такі як воски, глюкоза (C 6 H 12 O 6, mp 146 o C).
Іони в іонних сполуках утримуються міцними іонними зв'язками в 3D масиві кристалічних решіток. Тому іонні сполуки зазвичай являють собою тверді тверді тверді речовини з високими температурами плавлення Наприклад, NaCl плавиться при 801 o С. Ковалентні сполуки, які існують у вигляді 3D-мережі ковалентних зв'язків, тобто як гігантські молекули, зазвичай є твердими матеріалами, що мають більш високу температуру плавлення, ніж іонні сполуки. Наприклад, SiO 2, присутній у піску та кварці, являє собою тверду тверду речовину, яка плавиться при 1,710 o С. Алмаз - найважче відоме речовина, являє собою гігантську молекулу атомів вуглецю, що утримується разом у тривимірній мережі ковалентних зв'язків, яка плавиться близько 4,027 o C.
