1.2: Що таке хімія?
- Page ID
- 25501
Хімія - це вивчення речовини. Більш конкретно, хімія вивчає склад, властивості та перетворення речовини.
Властивості речовини бувають двох видів: фізичні властивості та хімічні властивості, як показано на рис.1.3.1.

Фізична властивість і фізичний процес
Фізичне майно
Фізична властивість - це властивість, яка при дотриманні не змінює елементарний склад речовини.
Приклади включають колір, масу, об'єм, електропровідність та теплопровідність.
Фізичні властивості, які не залежать від кількості речовини, називаються інтенсивними властивостями, наприклад, кольором, щільністю і теплопровідністю.
Фізичні властивості, які залежать від кількості речовини, типу, маси і обсягу, називаються великими властивостями.
Фізичний процес
Будь-який процес, який якось змінює матерію, але не змінює елементний склад, називається фізичним процесом.
Наприклад, плавлення твердого в рідину або кипіння рідини до газового стану є фізичними процесами.
Суміші можна розділити за допомогою фізичних процесів, заснованих на відмінностях фізичних властивостей складових. Рис. 1.3.2 демонструє, що магнітний матеріал, як залізо, можна відокремити від немагнітного матеріалу, такого як сірка, за допомогою магніту.
Процес фільтрації може відокремити неоднорідну суміш рідини і твердої речовини, як пісок у воді. Вода проходить через фільтрувальний папір, залишаючи після себе частинки піску на фільтрі.
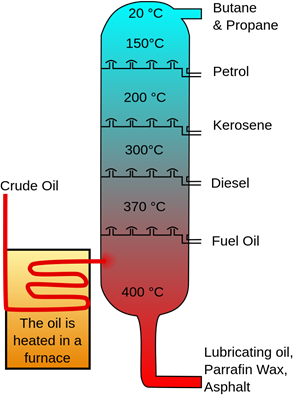
Процес дистиляції може розділяти однорідні суміші твердих речовин в рідишах або рідин в рідишах на основі різниці температур кипіння компонентів. Наприклад, однорідна сольова суміш, розчинена у воді, відокремлюється, переганяючи воду при температурі кипіння, залишаючи після себе тверду сіль. Дистиляція також може розділяти суміш двох або більше рідин, якщо їх температура кипіння різна, наприклад, перегонка сирої нафти відокремлює компоненти на основі їх температури кипіння.
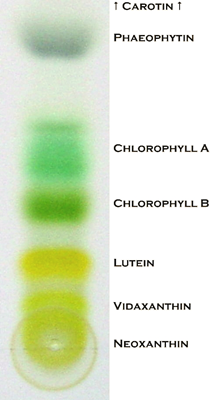
Хроматографія - ще одна методика, часто застосовується для поділу сумішей. Суміш, наприклад, чорнило, адсорбується на стаціонарній фазі, наприклад, на пористому папері, і поділ відбувається шляхом протікання рідкої фази, наприклад, води, що піднімається через капіляри в папері. Компонент чорнильної суміші відокремлюють, оскільки деякі компоненти мають більшу здатність залишатися адсорбованими в твердій фазі і меншою здатністю солюбілізуватися в рідкій фазі, ніж інші компоненти. Рис. 1.3.2 Ілюструє описані процеси фізичного поділу.

Хімічні властивості та хімічний процес
Хімічний процес
Хімічні властивості стосуються зміни елементного складу речовини.
Наприклад, метан (СН 4) в природному газі горючий -це хімічна властивість. Це означає, що метан і кисень змінюють свій елементний склад, щоб стати вуглекислим газом і водою і виділяти тепло після займання.
Хімічний процес
Процес, що змінює елементний склад, називається хімічним процесом або хімічною реакцією.
Наприклад, фотосинтез - це хімічний процес, який перетворює вуглекислий газ і воду в глюкозу, використовуючи енергію сонячного світла.
Хімічне рівняння
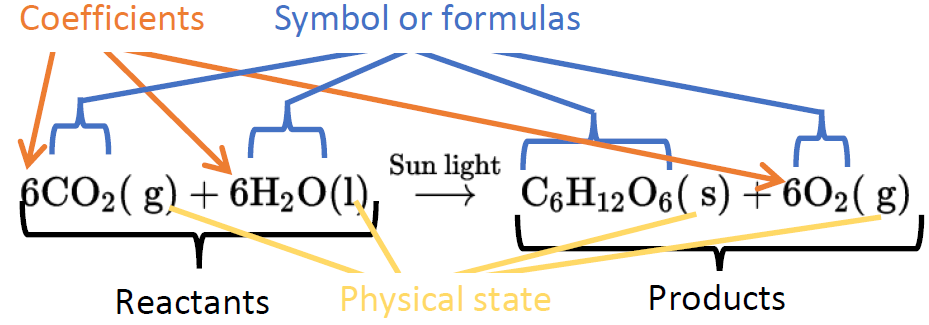
Хімічне рівняння являє собою хімічну реакцію у вигляді символів задіяних елементів і сполук.
Речовини, що споживаються в хімічній реакції, є реагентами, а утворені речовини - продуктами. Реагенти пишуться з лівого боку, розділені знаком плюса, за ним стрілкою, а вироби знаходяться в правій частині стрілки, як показано на рис.1.3.3. Наприклад, наступне хімічне рівняння представляє згоряння метану.
\ begin {рівняння}
\ математика {CH} _ {4} +2\ mathrm {O} _ {2}\ longrightarrow\ mathrm {CO} _ {2} +2\ mathrm {2}\ mathrm {O}\ nonumber
\ end {рівняння}
Зверніть увагу, що хімічна формула без будь-якого попереднього числа, наприклад, O 2 та CO 2, являє собою одну молекулу або одиницю кількості хімічної речовини. Число, що передує формулі, називається коефіцієнтом, і воно являє собою кількість частинок або кількість задіяних одиниць. Наприклад, коефіцієнт 2 в 2Н 2 О в вищевказаному хімічному рівнянні являє собою дві молекули утворилися води або утворилися дві молі води, де моль - одинична кількість. Відзначимо, що хімічний склад змінився в хімічній реакції. Раніше одна речовина була атомами вуглецю та водню в співвідношенні 1:4, а інша речовина - атоми кисню. Після реакції одна речовина - атоми вуглецю і кисню в співвідношенні 1:2, а інша - водень і кисень в пропорції 2:1.
Фізичний стан речовини іноді відображається в хімічному рівнянні наступними символами: (s) для твердого тіла, (l) для рідини, (g) для газу та (aq) для речовини, розчиненої у воді, як показано на рис. 1.3.3.
Науковий метод - як наука досягає прогресу?
Хімія - одна галузь науки. Знання науки збираються систематично з покоління в покоління за допомогою наукового методу.
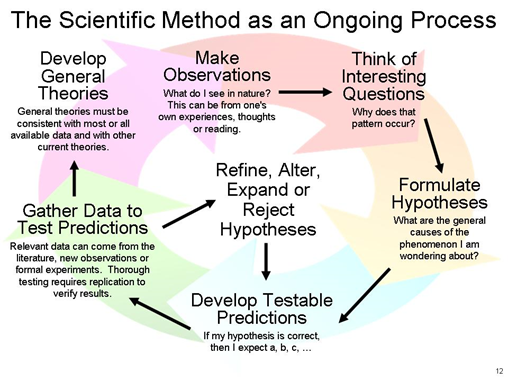
Науковий метод починається з проведення спостережень, надання орієнтовного пояснення, тобто гіпотез, перевірки гіпотези, тобто експерименту, і виведення висновку з дослідження. Істина, знайдена за допомогою повторних експериментів, стає законом, і всебічне пояснення пов'язаних висновків, зібраних з часом, стає теорією.
Ці кроки наукового методу проілюстровані на рис. 1.3.4 і описані нижче.
Спостереження
Спостереження - це активне отримання інформації з першоджерела. Наприклад, ви заповнюєте повітря в автомобільній шині і помічаєте, що показання тиску на манометрі збільшується, оскільки більше газу заповнює шину. Це приклад спостереження.
гіпотеза
Гіпотеза - це орієнтовне пояснення спостереження або закон, заснований на наявних наукових знаннях. Наприклад, Джон відвідує одного і починає чхати. Друг каже, що у мене є кішка, і у вас може бути алергія на котів. Це орієнтовне пояснення чхання Джона є гіпотезою.
Експеримент
Експерименти перевіряють гіпотезу. Наприклад, Джон відвідує іншого друга, у якого є кішка, щоб з'ясувати, алергія у нього на кішок чи ні. Якщо він чхає в цьому експерименті, це підтримує гіпотезу. Якщо він не чхає, експеримент спростовує гіпотезу.
Висновок
Гіпотеза, доведена правда, стає висновком. Гіпотеза відхиляється або переглядається, якщо результати експерименту її не підтримують. Наприклад, вчені з усього світу і в різні періоди намагалися перетворити інші метали в золото і кожен раз піддавалися невдачі. Він дійшов висновку, що елементи не перетворюються на більш просту матерію будь-якою фізичною чи хімічною реакцією.
Законодавство
Якщо спостереження повсюдно вірно в повторних експериментах, воно стає законом. Приклади права такі.
- Тиск будь-якого газу прямо пропорційно кількості газу, якщо температура і обсяг підтримуються постійними, є законом Авогадро.
- Частка атомів різних елементів в з'єднанні завжди однакова, це закон постійної пропорції.
- Маса перед будь-якою хімічною реакцією така ж, як і після хімічної реакції, тобто маса зберігається в будь-якій хімічній реакції або процесі, що є законом збереження маси.
Теорія
Це називається теорією, якщо хтось пропонує всебічне пояснення, засноване на наукових принципах, щоб пояснити кілька законів і висновків на пов'язану тему. Наприклад, зібрані з часом знання про властивості речовини змусили Далтона висунути атомну теорію Дальтона.
Постулати атомної теорії Дальтона:
- елементи складаються з крихітних неподільних частинок, званих атомами;
- атоми будь-якого одного елемента ідентичні один одному, але відрізняються від атомів будь-яких інших елементів;
- Атоми різних елементів реагують один з одним в постійному цілому числовому співвідношенні для отримання з'єднання;
- атоми в з'єднанні відокремлюють і рекомбінують, щоб дати новий матеріал. Тим не менш, атоми не створюються і не руйнуються в реакції.
Ці постулати пояснюють властивості речовини, описані в попередніх розділах. Наприклад, елементи не можуть перетворюватися в простіші речовини будь-яким фізичним або хімічним процесом, оскільки вони складаються з одного типу атома. Атоми неподільні відповідно до першого постулату. Сполуки можуть перетворюватися в елементи хімічною реакцією, оскільки атоми в сполуках можуть відокремлюватися і рекомбінувати відповідно до четвертого постулату.
Що відбувається після прийняття теорії?
Теорія проходить перевірку часом. Якщо він продовжує пояснювати результати майбутніх експериментів, він залишається дійсним. Якщо він спростований або не може пояснити деякі спостереження майбутніх експериментів, він або відхиляється, або переглядається. Наприклад, «атоми не діляться» більше не вважається дійсним. Згідно з сучасними знаннями, атоми можуть ділитися на субатомні частинки, такі як електрони, протони та нейтрони. Однак субатомні частинки більше не представляють елемент.
«Атоми одного елемента однакові» було переглянуто, оскільки ізотопи - це атоми одного елемента, які відрізняються в деяких відношеннях. Твердження «атоми ні створені, ні руйнуються» все ще діє для хімічних реакцій, але не тримається в ядерних реакціях, де атоми одного елемента можуть перетворюватися в атоми інших елементів. Аналогічно речовина може бути перетворена в енергію і навпаки в ядерних реакціях, слідуючи відомому рівнянню Ейнштейна: E = mc 2, де Е - енергія, m - маса, а c - швидкість світла. Це означає, що закон збереження маси і закон збереження енергії не діють окремо в ядерній реакції. І все-таки маса і енергія разом зберігаються в ядерних реакціях. Це приклади змін, зроблених в теорії з плином часу.
Теорія є базовим знанням, яке дозволяє передбачати нові закони і призводить до нових уявлень про суміжні поняття. Наприклад, Дальтон передбачив закон множинних пропорцій, також відомий як закон Дальтона, тобто, якщо атоми двох елементів можуть поєднуватися в одному цілому числовому співвідношенні, щоб дати певну сполуку, вони також можуть змішуватися в іншому цілому числовому співвідношенні, щоб дати іншу сполуку.
Коли елементи утворюють сполуки, пропорції елементів в цих хімічних сполуках можуть виражатися в малих співвідношеннях цілого числа.
Наприклад, атоми водню і кисню можуть змішуватися в співвідношенні 2:1, щоб забезпечити воду (H 2 O). Тим не менш, вони також можуть поєднуватися в співвідношенні 2:2, щоб дати перекис водню (H 2 O 2), іншу сполуку. Аналогічно, вуглець і водень поєднуються в співвідношенні 1:4, щоб отримати метан (CH 4); вони можуть поєднуватися в співвідношенні 2:6, щоб зробити ще одну етанову сполуку (C 2 H 6).
