22.9: Балансування окислювально-відновних реакцій - Метод зміни числа окислення
Сірчана кислота виробляється в надзвичайно великих кількостях в США (близько 40 млн тонн/рік). Цей матеріал виготовляється шляхом окислення сірки з утворенням триоксиду сірки. Потім розчиняють у воді з утворенням сірчаної кислоти.SO3 Велика частина виробленої сірчаної кислоти використовується в добривах. Ця кислота також міститься в свинцево-кислотних автомобільних акумуляторах.
Балансування окислювально-відновних реакцій: метод окислення-число-зміна
Одним із способів збалансувати окислювально-відновні реакції є відстеження передачі електронів, використовуючи номери окислення кожного з атомів. Для методу окислення-зміни чисел почніть з незбалансованого рівняння скелета. Нижче наведено приклад для реакції оксиду заліза (II) з чадним газом. Ця реакція та, яка протікає в доменній печі при переробці залізної руди в металеве залізо:
Fe2O3(s)+CO(g)→Fe(s)+CO2(g)
+3Fe2−2O3(s)++2C−2O(g)→0Fe(s)++4C−2O2(g)

Число окислення атома вуглецю збільшується на 2, тоді як число окислення атома заліза зменшується на 3. Як написано, кількість втрачених електронів не дорівнює кількості отриманих електронів. У збалансованому окислювально-відновному рівнянні вони повинні бути рівними. Так, збільшення числа окислення одного атома необхідно зробити рівним зменшенню числа окислення іншого.
Крок 4: Використовуйте коефіцієнти, щоб загальне збільшення числа окислення дорівнювало загальному зменшенню числа окислення. При цьому найменш поширеним кратним 2 і 3 є 6. Так приріст окислювально-числа потрібно помножити на 3, при цьому зменшення окислювально-числа потрібно помножити на 2. Коефіцієнт також застосовується до формул в рівнянні. Таким чином, 3 поміщається передCO і передCO2. A 2 ставиться передFe правою стороною рівняння. Коефіцієнт неFe2O3 вимагає, оскільки індекс 2 післяFe вказує на те, що вже є два атоми заліза.
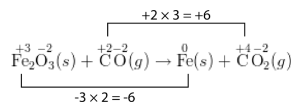
Крок 5: Перевірте балансування для обох атомів і заряду. Іноді може знадобитися поставити коефіцієнт перед молекулярною формулою, яка не брала участі в окислювально-відновному процесі. У поточному прикладі рівняння тепер збалансоване.
Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)
