22.2: Окислювально-відновні реакції та іонні сполуки
Азотна кислота має безліч застосувань у виробництві добрив і вибухових речовин. Більшість азотної кислоти виготовляється з аміаку за допомогою триступеневого процесу. Аміак окислюєтьсяHNO3 до утворення декількох оксидів азоту, в результаті чого кислота.
Окислювально-відновні реакції та іонні сполуки
В ході хімічної реакції між металом і неметалом електрони передаються від атомів металу до неметалевих атомів. Наприклад, при змішуванні металу цинку з сіркою і нагріванні утворюється з'єднання сульфіду цинку. Два валентних електрона від кожного атома цинку передаються кожному атому сірки.
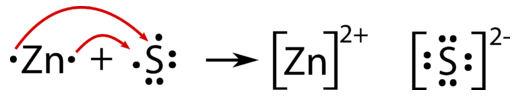
Оскільки цинк втрачає електрони в реакції, він окислюється. Сірка набирає електрони і, таким чином, зменшується. Окислювально-відновна реакція - це реакція, яка передбачає повне або часткове перенесення електронів від одного реагенту до іншого. Окислення - це повна або часткова втрата електронів або посилення кисню. Зменшення - це повне або часткове посилення електронів або втрата кисню. Окислювально-відновна реакція - ще один термін для окислювально-відновної реакції.
Кожен з цих процесів можна показати в окремому рівнянні, званому напівреакцією. Половинна реакція - це рівняння, яке показує або окислення, або реакцію відновлення, яка виникає під час окислювально-відновної реакції.
Oxidation:Zn→Zn2++2e−Reduction:S+2e−→S2−
Важливо пам'ятати, що дві напівреакції відбуваються одночасно. Утворені іони потім притягуються один до одного в іонному зв'язку.
Іншим прикладом окислювально-відновної реакції, що включає перенесення електронів, є добре відома комбінація металевого натрію та газу хлору з утворенням хлориду натрію:
2Na+Cl2→2NaCl
Половинні реакції такі:
Oxidation:Na→Na++e−Reduction:Cl+e−→Cl−
Ми займемося балансуванням цих рівнянь в інший час.
Резюме
- Окислювально-відновна реакція, або окислювально-відновна реакція, - це реакція, яка передбачає повну або часткову передачу електронів від одного реагенту до іншого.
- Окислення - це повна або часткова втрата електронів або посилення кисню.
- Зменшення - це повне або часткове посилення електронів або втрата кисню.
- Половинна реакція - це рівняння, яке показує або окислення, або реакцію відновлення, яка виникає під час окислювально-відновної реакції.
- Наведено приклади окислювально-відновних реакцій.