22.4: Молекулярні окислювально-відновні реакції
- Page ID
- 19402
Ацетон - універсальна хімічна речовина, що використовується як у виробництві пластмас, так і в якості розчинника. Це основна складова таких продуктів, як засіб для зняття лаку, фарби та рідина для чищення. Виготовлення ацетону передбачає утворення проміжного пероксидного з'єднання шляхом окислення з подальшим утворенням кінцевого продукту.
Молекулярні окислювально-відновні реакції
Втрату і посилення електронів легко помітити в реакції, в якій утворюються іони. Однак у багатьох реакціях такого перенесення електронів не відбувається. У молекулярній сполуці електрони поділяються між атомами у типі зв'язку, який називається ковалентним зв'язком. Тим не менш, це все ще поширене явище для реакцій, що включають молекулярні сполуки, класифікуються як окислювально-відновні реакції
Коли газ водню вступає у реакцію з газом кисню, як продукт утворюється вода.
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O} \left( l \right)\nonumber \]
В окремих молекулах водню пара сполучних електронів ділиться порівну між атомами водню (неполярна ковалентна зв'язок). Так само зв'язуючі електрони в молекулі кисню також поділяються порівну між двома атомами кисню. Однак, коли атоми перебудовуються з утворенням молекули води, обмін електронами більше не дорівнює. У кожному воднево-кисневому зв'язку в молекулі води сполучні електрони більше притягуються до атома кисню, ніж до атома водню. Ми знаємо це тому, що кисень має більш високу електронегативність, ніж водень.
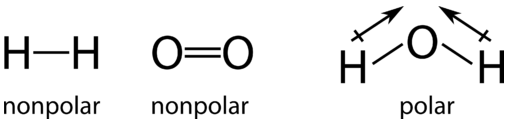
В ході цієї реакції електрони зміщуються від кожного атома водню і в бік атома кисню. Водень окислюється, оскільки зазнає часткової втрати електронів. Незважаючи на те, що втрати недостатньо повні для утворення іонів, атоми водню у воді мають меншу щільність електронів поблизу них, ніж у\(\ce{H_2}\) молекулі. Кисень зменшується, оскільки він зазнає часткового посилення електронів. Атом кисню у воді має більшу електронну щільність, ніж у\(\ce{O_2}\) молекулі.
Інший підхід до цього типу проблеми полягає в тому, щоб повернутися до наших попередніх визначень окислення - це збільшення кисню або втрата водню, а зменшення - посилення водню або втрата кисню. Це значно полегшує рішення про окислювально-відновні реакції. Водень окислюється, оскільки він додав водень для утворення води. І навпаки, кисень зменшується, оскільки він додав водень для утворення води.