17.10: Теплоти плавлення та затвердіння
Припустимо, що ви тримаєте в руці кубик льоду. Він відчуває холод, тому що теплова енергія залишає вашу руку і потрапляє в кубик льоду. Що відбувається з кубиком льоду? Він тане. Однак температура під час зміни фази залишається постійною. Тож тепло, яке втрачається вашою рукою, не піднімає температуру льоду вище температури його танення0^\text{o} \text{C}. Швидше все тепло йде в зміну стану. Енергія поглинається в процесі зміни льоду в воду. Вода, яка виробляється, також залишається до тих пір,0^\text{o} \text{C} поки весь лід не розтане.
Теплоти плавлення та затвердіння
Всі тверді речовини поглинають тепло, коли вони плавиться, перетворюючись в рідини. Приріст тепла при цьому ендотермічному процесі переходить в зміну стану, а не в зміну температури. Молярна теплота\left( \Delta H_\text{fus} \right) плавлення речовини - це тепло, поглинене одним моль цієї речовини, коли воно перетворюється з твердої речовини в рідину. Оскільки плавлення будь-якої речовини поглинає тепло, то з цього випливає, що при заморожуванні будь-якої речовини виділяється тепло. Молярне тепло затвердіння\left( \Delta H_\text{solid} \right) речовини - це тепло, що виділяється одним моль цієї речовини, коли воно перетворюється з рідини в тверду речовину. Оскільки плавлення і затвердіння даної речовини є абсолютно протилежними процесами, числове значення молярної теплоти плавлення таке ж, як і числове значення молярної теплоти затвердіння, але протилежне за знаком. Іншими словами,\Delta H_\text{fus} = - \Delta H_\text{solid}. На малюнку нижче показані всі можливі зміни стану разом з напрямком теплового потоку під час кожного процесу.
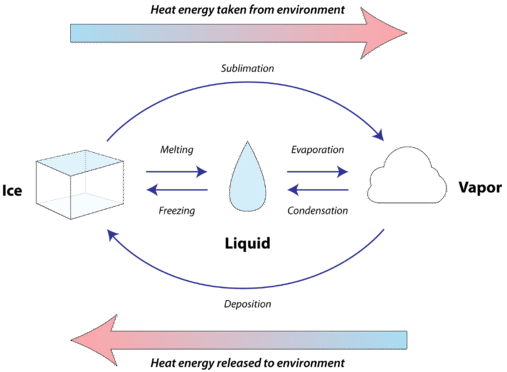
Кожна речовина має унікальне значення для його молярної теплоти плавлення, залежно від кількості енергії, необхідної для порушення міжмолекулярних сил, присутніх у твердому тілі. Коли1 \: \text{mol} льоду at0^\text{o} \text{C} перетворюється на1 \: \text{mol} рідку воду в0^\text{o} \text{C}, тепла6.01 \: \text{kJ} поглинаються з навколишнього середовища. Коли1 \: \text{mol} вода при0^\text{o} \text{C} замерзає до льоду при0^\text{o} \text{C},6.01 \: \text{kJ} тепла виділяється в навколишнє середовище.
\begin{array}{ll} \ce{H_2O} \left( s \right) \rightarrow \ce{H_2O} \left( l \right) & \Delta H_\text{fus} = 6.01 \: \text{kJ/mol} \\ \ce{H_2O} \left( l \right) \rightarrow \ce{H_2O} \left( s \right) & \Delta H_\text{solid} = -6.01 \: \text{kJ/mol} \end{array}\nonumber
Молярні теплоти плавлення та затвердіння даної речовини можуть бути використані для розрахунку тепла, поглиненого або виділяється при розплавленні або заморожуванні різних кількостей.
Приклад\PageIndex{1}
Розрахуйте тепло, поглинене31.6 \: \text{g}, коли льоду при0^\text{o} \text{C} повному розтануванні.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Маса= 31.6 \: \text{g} льоду
- Молярна маса\ce{H_2O} = 18.02 \: \text{g/mol}
- Молярна теплота плавлення= 6.01 \: \text{kJ/mol}
Невідомий
Маса льоду спочатку перетворюється на родимки. Потім це множиться на коефіцієнт перетворення для\left( \frac{6.01 \: \text{kJ}}{1 \: \text{mol}} \right) того, щоб знайти\text{kJ} поглинене тепло.
Крок 2: Вирішіть.
31.6 \: \text{g ice} \times \frac{1 \: \text{mol ice}}{18.02 \: \text{g ice}} \times \frac{6.01 \: \text{kJ}}{1 \: \text{mol ice}} = 10.5 \: \text{kJ}\nonumber
Крок 3: Подумайте про свій результат.
Дана кількість трохи менше, ніж 2 молі льоду, і так просто менше тепла12 \: \text{kJ} поглинається процесом танення.
Резюме
- Молярна теплота\left( \Delta H_\text{fus} \right) плавлення речовини - це тепло, поглинене одним моль цієї речовини, коли воно перетворюється з твердої речовини в рідину.
- Молярне тепло затвердіння\left( \Delta H_\text{solid} \right) речовини - це тепло, що виділяється одним моль цієї речовини, коли воно перетворюється з рідини в тверду речовину.
- Описані розрахунки теплових змін при плавленні і затвердінні.