14.4: Закон Чарльза
- Page ID
- 19698
Свіжовипечений хліб виходить легким і пухнастим в результаті дії дріжджів на цукор. Дріжджі перетворюють цукор в вуглекислий газ, який при високих температурах змушує тісто розширюватися. Кінцевий результат - приємне ласощі, особливо при покритті розтопленим вершковим маслом.
Закон Чарльза
Французький фізик Жак Шарль (1746-1823) вивчав вплив температури на об'єм газу при постійному тиску. Закон Чарльза стверджує, що обсяг даної маси газу змінюється безпосередньо в залежності від абсолютної температури газу, коли тиск підтримується постійним. Абсолютна температура - це температура, виміряна за шкалою Кельвіна. Шкала Кельвіна повинна використовуватися, оскільки нуль за шкалою Кельвіна відповідає повній зупинці молекулярного руху.
Математично прямий зв'язок Закону Карла можна представити наступним рівнянням:
\[\frac{V}{T} = k\nonumber \]
Як і у випадку з законом Бойла,\(k\) є постійним тільки для даного зразка газу. У таблиці нижче наведені дані про температуру і обсяг для заданої кількості газу при постійному тиску. Третій стовпець є постійною для цього конкретного набору даних і завжди дорівнює обсягу, поділеному на температуру Кельвіна.
| Температура\(\left( \text{K} \right)\) | Обсяг\(\left( \text{mL} \right)\) | \(\frac{V}{T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) |
|---|---|---|
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">50 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">20 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 100 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">40 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 150 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">60 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 200 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">80 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">300 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 120 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 500 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 200 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
| \ (\ left (\ text {K}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 1000 | \ (\ left (\ text {mL}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">400 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;" >0.40 |
Коли ці дані позначені графіком, результатом є пряма лінія, що свідчить про пряму залежність, показану на малюнку нижче.
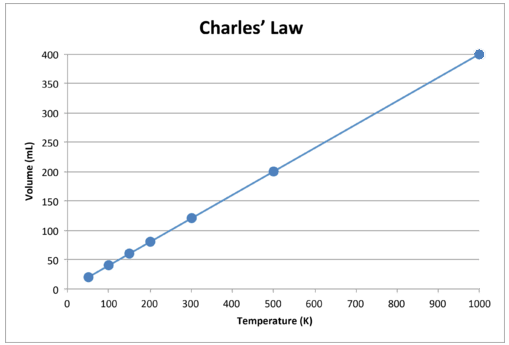
Малюнок\(\PageIndex{2}\): Обсяг газу збільшується зі збільшенням температури Кельвіна.
Зверніть увагу, що лінія йде точно до початку, а це означає, що в міру наближення абсолютної температури газу до нуля її обсяг наближається до нуля. Однак, коли газ доводиться до надзвичайно холодних температур, його молекули зрештою конденсуються в рідкому стані до досягнення абсолютного нуля. Температура, при якій відбувається ця зміна в рідкий стан, змінюється для різних газів.
Закон Чарльза також може бути використаний для порівняння мінливих умов для газу. Тепер використовуємо\(V_1\) і\(T_1\) відстоювати початковий об'єм і температуру газу, поки\(V_2\) і\(T_2\) витримуємо кінцевий обсяг і температуру. Математичним співвідношенням Закону Чарльза стає:
\[\frac{V_1}{T_1} = \frac{V_2}{T_2}\nonumber \]
Це рівняння може бути використано для обчислення будь-якої з чотирьох величин, якщо відомі інші три. Пряма залежність буде триматися тільки в тому випадку, якщо температури виражені в Кельвіні. Температури в Цельсієм не працюватимуть. Згадайте відносини, які\(\text{K} = \: ^\text{o} \text{C} + 273\).
Приклад\(\PageIndex{1}\)
Повітряна куля наповнюється до обсягу при\(2.20 \: \text{L}\) температурі\(22^\text{o} \text{C}\). Потім балон нагрівають до температури\(71^\text{o} \text{C}\). Знайдіть новий обсяг повітряної кулі.
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- \(V_1 = 2.20 \: \text{L}\)
- \(T_1 = 22^\text{o} \text{C} = 295 \: \text{K}\)
- \(T_2 = 71^\text{o} \text{C} = 344 \: \text{K}\)
Невідомий
Використовуйте закон Чарльза, щоб вирішити для невідомого тому\(\left( V_2 \right)\). Температури вперше були перетворені на Кельвіна.
Крок 2: Вирішіть.
По-перше, переставити рівняння алгебраїчно, щоб вирішити для\(V_2\).
\[V_2 = \frac{V_1 \times T_2}{T_1}\nonumber \]
Тепер підставляємо відомі величини в рівняння і вирішуємо.
\[V_2 = \frac{2.20 \: \text{L} \times 344 \: \text{K}}{295 \: \text{K}} = 2.57 \: \text{L}\nonumber \]
Крок 3: Подумайте про свій результат.
Обсяг збільшується з підвищенням температури. Результат має три значущі цифри.