13.19: Загальна діаграма етапу
Багато ракети використовують для свого палива комбінацію гасу і рідкого кисню. Кисень можна зменшити до рідкого стану або шляхом охолодження, або за допомогою високого тиску. У випадку з ракетою, оскільки кисень знаходиться в контейнері, по суті, поза відкритим небом, підтримувати температуру−183oC (температуру кипіння кисню) не дуже практично. Однак високий тиск може бути використаний для примусового потрапляння кисню в баки, змушуючи його розріджуватися, щоб він змішувався з гасом, і забезпечити потужне запалювання для переміщення ракети.
Фазові діаграми
Взаємозв'язок між твердим, рідким і паровим (газовим) станами речовини можна показати як функцію температури і тиску на єдиній діаграмі. Фазова діаграма - це графік, що показує умови температури та тиску, при яких речовина існує у твердій, рідкій та газовій фазах. Вивчіть загальну діаграму стану, показану на малюнку нижче. У кожній з трьох кольорових областей діаграми речовина знаходиться в єдиному стані (або фазі). Темні лінії, які діють як межа між цими регіонами, представляють умови, за яких дві фази знаходяться в рівновазі.
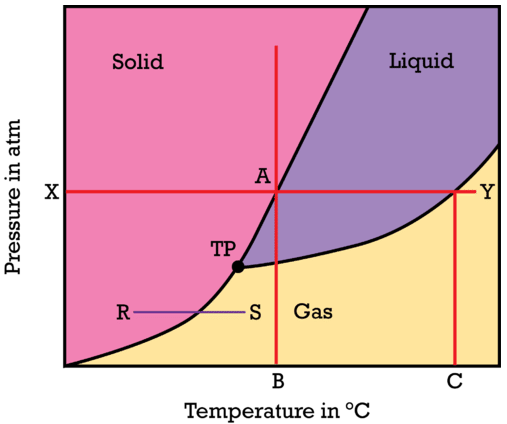
ЗнайтиX на осі тиску і припустити, що значенняX є стандартним тиском1atm. Коли один рухається зліва направо через червону лінію, температура твердої речовини підвищується, тоді як тиск залишається постійним. ПриA досягненні точки речовина плавиться і температураB на горизонтальній осі представляє нормальну температуру плавлення речовини. Рухаючись далі вправо, речовина закипає в точціY і так точкаC на горизонтальній осі представляє нормальну температуру кипіння речовини. У міру підвищення температури при постійному тиску речовина змінюється з твердого на рідке на газ.
Почніть прямо над точкоюB на температурній осі і дотримуйтесь червоної лінії вертикально. При дуже низькому тиску частинки речовини знаходяться далеко один від одного і речовина знаходиться в газовому стані. У міру підвищення тиску частинки речовини змушують все ближче і зближувати один до одного. Врешті-решт частинки проштовхуються настільки близько один до одного, що сили притягання змушують речовина конденсуватися в рідкому стані. Постійне підвищення тиску на рідину в кінцевому підсумку призведе до затвердіння речовини. Для більшості речовин твердий стан щільніше, ніж рідкий, і тому введення рідини під великим тиском призведе до того, що вона перетвориться на тверде тіло. Лінійний відрізокR -S являє собою процес сублімації, де речовина змінюється безпосередньо з твердого тіла на газ. При досить низькому тиску рідкої фази не існує. Позначена точкаTP називається потрійною точкою. Потрійна точка - це одна умова температури та тиску, де тверді, рідкі та парові стани речовини можуть співіснувати в рівновазі.
Резюме
- Фазова діаграма відображає умови температури та тиску, при яких речовина існує у твердому, рідкому та газовому станах.
- Потрійна точка - це одна умова температури та тиску, де тверді, рідкі та парові стани речовини можуть співіснувати в рівновазі.