13.18: Криві нагріву та охолодження
- Page ID
- 19255
За життя Марка Твена (справжнє ім'я: Samuel Langhorne Clemens, 1835-1910) пароплав був основним засобом пересування по річках і озерах США. Сам Твен був пілотом пароплава на річці Міссісіпі протягом певного періоду часу, і взяв своє перо ім'я з вимірювання глибини води (дванадцять футів, що було безпечною глибиною для човнів). Човни отримали свою потужність від пари - рідкої води, перетвореної в газ при високих температурах. Пара штовхала б поршні двигуна, змушуючи лопатеві колеса обертатися і приводити в рух човен.
Криві нагріву
Уявіть, що у вас є брила льоду, яка знаходиться при температурі\(-30^\text{o} \text{C}\), значно нижче її температури плавлення. Лід знаходиться в закритій ємності. Оскільки тепло постійно додається до крижаної брили, молекули води почнуть вібрувати все швидше і швидше, оскільки вони поглинають кінетичну енергію. Врешті-решт, коли лід нагріється до\(0^\text{o} \text{C}\), додана енергія почне руйнувати водневий зв'язок, який утримує молекули води на місці, коли вона знаходиться в твердій формі. У міру танення льоду його температура не підвищується. Вся енергія, яка вкладається в лід, йде в процес танення, а не в будь-яке підвищення температури. Під час процесу плавлення два стани - тверде і рідке - знаходяться в рівновазі один з одним. Якщо система була ізольована в цей момент, і енергії не було дозволено входити або виходити, то суміш з крижаною водою\(0^\text{o} \text{C}\) залишиться. Температура завжди постійна під час зміни стану.
Продовження нагрівання води після того, як лід повністю розтане, тепер збільшить кінетичну енергію молекул рідини і температура підвищиться. Якщо припустити, що атмосферний тиск є стандартним, температура буде неухильно підвищуватися, поки не досягне\(100^\text{o} \text{C}\). У цей момент додана енергія від тепла призведе до того, що рідина почне випаровуватися. Як і при попередньому зміні стану, температура залишатиметься на рівні,\(100^\text{o} \text{C}\) поки молекули води переходять з рідини в стан газу або пари. Як тільки вся рідина повністю википить, тривале нагрівання пара (так як ємність закрита) підвищить його температуру вище\(100^\text{o} \text{C}\).
Описаний вище експеримент можна узагальнити в графіку, званому кривою нагріву (малюнок нижче).
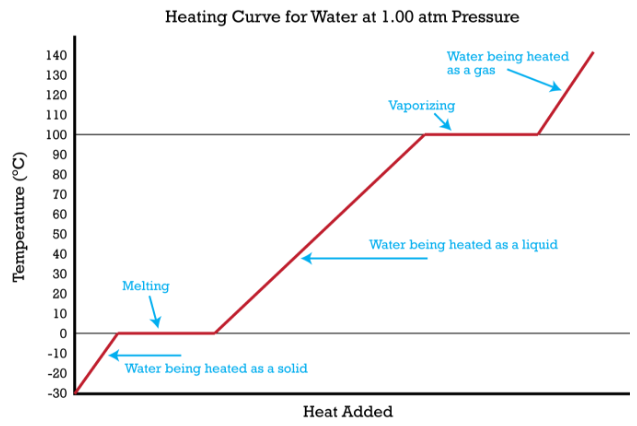
Зміна поведінки стану всіх речовин можна представити кривою нагрівання даного типу. Точки плавлення і кипіння речовини можна визначити по горизонтальних лініях або плато на кривій. Інші речовини мають температури плавлення та кипіння, які відрізняються від температури води. Винятком з цієї кривої нагріву є така речовина, як вуглекислий газ, яка підноситься, а не плавиться при стандартному тиску. Крива нагріву для вуглекислого газу мала б лише одне плато, при температурі сублімації\(\ce{CO_2}\).
Весь експеримент можна було запустити в зворотному напрямку. Пар вище\(100^\text{o} \text{C}\) міг бути стабільно охолоджений до\(100^\text{o} \text{C}\), і в цей момент він буде конденсуватися до рідкої води. Потім воду можна було охолодити\(0^\text{o} \text{C}\), і в цей момент тривале охолодження заморозить воду до льоду. Потім лід можна було охолодити до точки нижче\(0^\text{o} \text{C}\). Це може бути побудовано на схемі кривої охолодження, яка була б зворотною кривою нагріву.
Короткий зміст державних змін
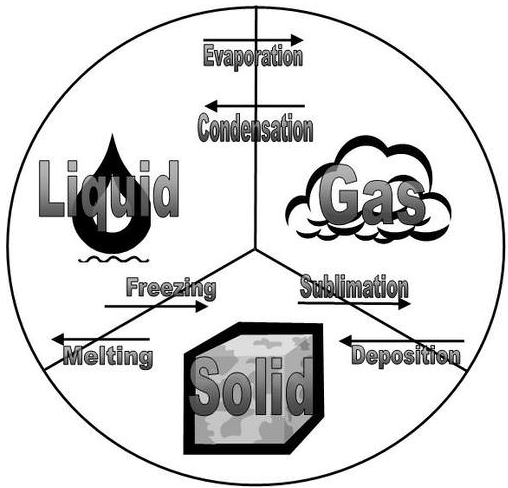
Всі зміни стану, що відбуваються між твердим, рідким і газом, зведені на діаграмі на малюнку нижче. Заморожування є протилежністю плавлення, і обидва являють собою рівновагу між твердим і рідким станами. Випаровування відбувається, коли рідина перетворюється на газ. Конденсація протилежна випаровуванню, і обидва представляють рівновагу між рідким і газовим станами. Осадження протилежне сублімації, і обидва являють собою рівновагу між твердим і газовим станами.
Резюме
- Зміна стану може бути спричинена шляхом введення тепла в систему або видалення його з системи.
- Температура системи не зміниться до тих пір, поки речовина зазнає зміни від твердого до рідкого на газ, а також зворотного.
- Заморожування - протилежність плавлення.
- Випаровування відбувається, коли рідина перетворюється на газ.
- Конденсація - протилежність пароутворення.
- Осадження - протилежність сублімації.