9.15: Молекулярні форми - Самотня пара (и) на центральному атомі
- Page ID
- 19137
Як вся ця одяг може поміститися в такому маленькому просторі?
Коли ми подорожуємо, ми часто беремо набагато більше речей, ніж нам потрібно. Спроба вмістити все це у валізу може стати справжнім викликом. Можливо, нам доведеться перепакувати або просто стиснути все це. Атомам часто доводиться переставляти там, де знаходяться електрони, щоб створити більш стійку структуру.
Центральний атом з однією або декількома одинокими парами
Молекулярна геометрія молекул змінюється, коли центральний атом має одну або кілька одиноких пар електронів. Загальна кількість електронних пар, як пар зв'язку, так і одиноких пар, призводить до того, що називається геометрією електронного домену. Коли одна або кілька сполучних пар електронів замінюються самотньою парою, молекулярна геометрія (фактична форма) молекули змінюється. Відповідно до символів A та B, встановлених у попередньому розділі, ми будемо використовувати E для представлення одинокої пари на центральному атомі (A). Індексний індекс буде використовуватися, коли існує більше однієї одинокої пари. Самотні пари на навколишніх атомах (B) не впливають на геометрію.
AB\(_3\) E: Аміак,\(\ce{NH_3}\)
Молекула аміаку містить три одиночних зв'язку і одну одиночну пару на центральному атомі азоту (див. Малюнок нижче).
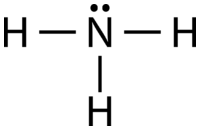
Геометрія домену для молекули з чотирма парами електронів є чотиригранною, як було видно з\(\ce{CH_4}\). У молекулі аміаку одна з електронних пар є самотньою парою, а не сполучною парою. Молекулярна геометрія\(\ce{NH_3}\) називається тригональної пірамідальної (див. Малюнок нижче).
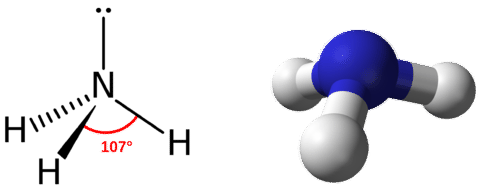
Нагадаємо, що кут зв'язку в чотиригранної\(\ce{CH_4}\) молекулі є\(109.5^\text{o}\). Знову ж таки, заміна однієї з зв'язаних електронних пар одинокою парою стискає кут трохи. \(\ce{H-N-H}\)Кут дорівнює приблизно\(107^\text{o}\).
AB\(_2\) E\(_2\): Вода,\(\ce{H_2O}\)
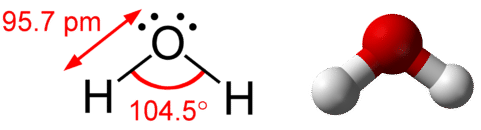
Молекула води складається з двох пар зв'язку і двох одиноких пар (див. Малюнок нижче).

Що стосується метану і аміаку, геометрія домену для молекули з чотирма парами електронів чотиригранна. У молекулі води дві електронні пари є самотніми парами, а не сполучними парами. Молекулярна геометрія молекули води зігнута. Кут\(\ce{H-O-H}\) зв'язку є\(104.5^\text{o}\), який менше, ніж кут зв'язку в\(\ce{NH_3}\) (див. Малюнок нижче).
AB\(_4\) E: Тетрафторид сірки,\(\ce{SF_4}\)
Структура Льюїса для\(\ce{SF_4}\) містить чотири одиночні зв'язки і одиничну пару на атомі сірки (див. Малюнок нижче).
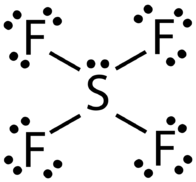
Атом сірки має навколо себе п'ять електронних груп, що відповідає тригональної геометрії біпірамідного домену, як в\(\ce{PCl_5}\) (див. Малюнок нижче). Нагадаємо, що тригональна біпірамідна геометрія має три екваторіальних атома і два осьових атома, прикріплених до центрального атома. Через більшого відштовхування самотньої пари, це один з екваторіальних атомів, які замінюються самотньою парою. Геометрію молекули називають спотвореним тетраедром, або гойдалкою.
| Загальна кількість пар електронів | Кількість пар склеювання | Кількість самотніх пар | Геометрія електронного домену | молекулярна геометрія | Приклади |
|---|---|---|---|---|---|
| 3 | 2 | 1 | Тригональний площинний | Зігнутий | \(\ce{O_3}\) |
| 4 | 3 | 1 | Тетраедричний | Трикутна пірамідальна | \(\ce{NH_3}\) |
| 4 | 2 | 2 | Тетраедричний | Зігнутий | \(\ce{H_2O}\) |
| 5 | 4 | 1 | Тригональний біпірамідний | Спотворений тетраедр (гойдалки) | \(\ce{SF_4}\) |
| 5 | 3 | 2 | Тригональний біпірамідний | Т-подібний | \(\ce{ClF_3}\) |
| 5 | 2 | 3 | Тригональний біпірамідний | Лінійний | \(\ce{I_3^-}\) |
| 6 | 5 | 1 | Восьмигранний | Квадратна пірамідальна | \(\ce{BrF_5}\) |
| 6 | 4 | 2 | Восьмигранний | Квадратний площинний | \(\ce{XeF_4}\) |
Резюме
- Наявність одиноких парних електронів впливає на тривимірну форму молекули.
Рецензія
- Чому вода має гнуту геометрію?
- Чому аміак не є плоскою молекулою?
- Як би ми написали конфігурацію тетрафториду ксенону за допомогою системи ABE?
