9.16: Полярність Бонда
- Page ID
- 19168
Що змушує людей ділитися?
Ви коли-небудь проводили час з кимось, кого ви дійсно не любили? Ви не мали з ними нічого спільного і не хотіли мати до них ніякого відношення. З іншого боку, є люди, з якими вам подобається бути. У вас багато спільного і любите ділитися з ними. Атоми працюють так само. Якщо є сильні відмінності в їх тяжінні електронів, один атом отримує електрони, а інший атом втрачає їх. Якщо вони схожі, вони поділяють електрони, утворюючи ковалентний зв'язок.
Полярність облігацій
Електронегативність визначається як здатність атома притягувати електрони, коли атоми знаходяться в з'єднанні. Електронегативність елементів наведені в таблиці Менделєєва нижче.
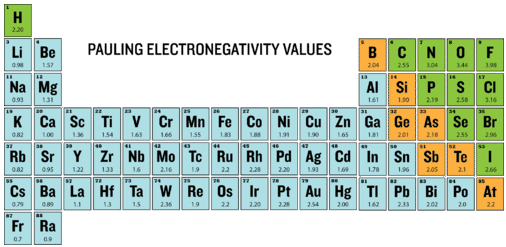
Ступінь, до якої даний зв'язок є іонним або ковалентним, визначається шляхом обчислення різниці електронегативності між двома атомами, що беруть участь в зв'язку.
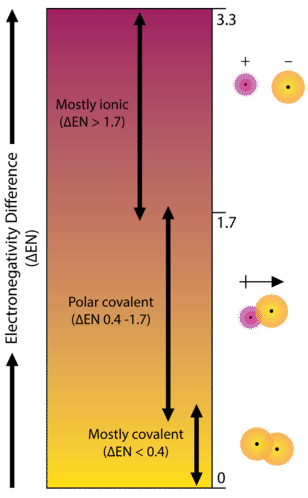
Як приклад розглянемо зв'язок, що виникає між атомом калію і атомом фтору. Використовуючи таблицю, різниця в електронегативності дорівнює\(4.0 - 0.8 = 3.2\). Оскільки різниця в електронегативності відносно велика, зв'язок між двома атомами є іонною. Оскільки атом фтору має набагато більшу привабливість для електронів, ніж атом калію, валентний електрон від атома калію повністю передається атому фтору. На діаграмі нижче показано, як різниця в електронегативності відноситься до іонного або ковалентного характеру хімічного зв'язку.
Неполярні ковалентні зв'язки
Зв'язок, в якій різниця електронегативності менше 1,7, вважається здебільшого ковалентною за характером. Однак на даний момент нам потрібно розрізняти два загальних типи ковалентних зв'язків. Неполярний ковалентний зв'язок - це ковалентний зв'язок, в якій електрони зв'язку поділяються порівну між двома атомами. У неполярному ковалентному зв'язку розподіл електричного заряду збалансований між двома атомами.
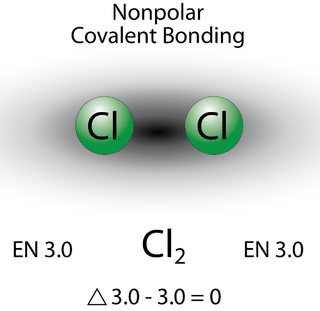
Два атоми хлору поділяють пару електронів в одному ковалентному зв'язку однаково, а електронна щільність, що оточує\(\ce{Cl_2}\) молекулу, симетрична. Зверніть увагу, що молекули, в яких різниця електронегативності дуже мала (<0,4), також вважаються неполярними ковалентними. Прикладом може бути зв'язок між хлором і бромом (\(\Delta\)EN\(=3.0 - 2.8 = 0.2\)).
Полярні ковалентні зв'язки
Зв'язок, в якій різниця електронегативності між атомами становить від 0,4 до 1,7, називається полярним ковалентним зв'язком. Полярний ковалентний зв'язок - це ковалентний зв'язок, в якій атоми мають нерівне тяжіння для електронів, і тому поділ нерівний. У полярному ковалентному зв'язку, іноді просто званому полярним зв'язком, розподіл електронів навколо молекули вже не симетричний.
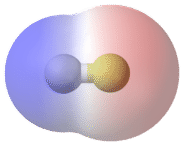
Простий спосіб проілюструвати нерівномірний розподіл електронів у полярному ковалентному зв'язку - використовувати грецьку букву дельта\(\left( \delta \right)\).

Атом з більшою електронегативністю набуває частковий негативний заряд, в той час як атом з меншою електронегативністю набуває частковий позитивний заряд. Символ дельта використовується для позначення того, що кількість заряду менше одиниці. Схрещена стрілка також може використовуватися для позначення напрямку більшої електронної щільності.
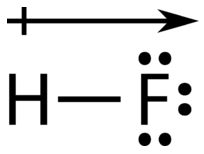
Джерело: CK-12 Foundation; Ліцензія: CC BY-NC 3.0 (відкривається в новому вікні))
Якби не наше розуміння полярності зв'язків, у нас був би дуже важкий час чищення одягу. Використовуйте це моделювання, щоб зрозуміти, як унікальна полярність молекул мила допомагає очистити наш одяг!
Резюме
- Електронегативність атома визначає, наскільки сильно він притягує до себе електрони.
- На полярність зв'язку впливають значення електронегативності двох атомів, що беруть участь у цьому зв'язку.
Рецензія
- Якщо два атоми, пов'язані між собою, мають різницю електронегативності 1,9, який тип зв'язку?
- Яким буде тип облігації для BH 2?
- Ваш друг каже вам, що зв'язок LiF є ковалентною. Чи правильно вони? Чому чи чому ні.