9.14: Молекулярні форми - немає самотніх пар на центральних атомах
- Page ID
- 19194
Як працює електроскоп?
Електроскоп - це пристрій, що використовується для дослідження заряду. Коли позитивно заряджений предмет (стрижень) наближається до верхнього стовпа, електрони надходять до верхньої частини банки, залишаючи два золотих листа позитивно зарядженими. Листя відштовхують один одного, оскільки обидва тримають позитивні, як заряди. Теорія VSEPR говорить, що електронні пари, також набір подібних зарядів, будуть відштовхувати один одного таким чином, що форма молекули буде регулюватися, так що валентні електронні пари залишаються якомога далі один від одного.
Центральний атом без одиноких пар
Для того щоб легко зрозуміти можливі типи молекул, ми будемо використовувати просту систему ідентифікації частин будь-якої молекули:
- A = центральний атом в молекулі
- B = атоми, що оточують центральний атом
Індекси після B будуть позначати кількість атомів B, які пов'язані з центральним атомом А. Наприклад, АВ\(_4\) - це молекула з центральним атомом, оточена чотирма ковалентно зв'язаними атомами. Знову ж таки, не має значення, чи є ці облігації одинарними, подвійними або потрійними.
AB\(_2\): Берилій гідрид\(\left( \ce{BeH_2} \right)\)
Гідрид берилію складається з центрального атома берилію з двома одиночними зв'язками з атомами водню. Нагадаємо, що це порушує правило октету.
\[\ce{H-Be-H}\nonumber \]
Відповідно до вимоги, щоб електронні пари максимізували свою відстань одна від одної, дві пари зв'язку в\(\ce{BeH_2}\) молекулах розташовуватимуться прямо протилежними сторонами центрального\(\ce{Be}\) атома. Отримана геометрія являє собою лінійну молекулу, показану на малюнку нижче в моделі «куля і палиця».
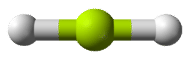
Кут зв'язку від\(\ce{H-Be-H}\) обумовлений\(180^\text{o}\) його лінійною геометрією.
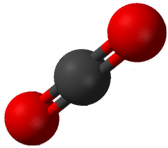
Вуглекислий газ - ще один приклад молекули, яка підпадає під\(_2\) категорію AB. Його структура Льюїса складається з подвійних зв'язків між центральним вуглецем і атомами кисню (див. Малюнок нижче).
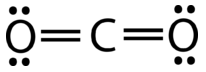
Відштовхування між двома групами з чотирьох електронів (дві пари) нічим не відрізняється від відштовхування двох груп двох електронів (однієї пари) в\(\ce{BeH_2}\) молекулі. Вуглекислий газ також лінійний (див. Малюнок нижче).
AB\(_3\): Трифторид бору\(\left( \ce{BF_3} \right)\)
Трифторид бору складається з центрального атома бору з трьома поодинокими зв'язками з атомами фтору (див. Малюнок нижче). Атом бору також має неповний октет.
Геометрія\(\ce{BF_3}\) молекули називається тригональної плоскою (малюнок\(\PageIndex{3}\)). Атоми фтору розташовані у вершині рівностороннього трикутника. \(\ce{F-B-F}\)Кут є\(120^\text{o}\) і всі чотири атома лежать в одній площині.
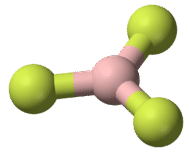
AB\(_4\): Метан\(\left( \ce{CH_4} \right)\)
Метан - органічна сполука, яка є первинним компонентом природного газу. Його структура складається з центрального атома вуглецю з чотирма одиночними зв'язками з атомами водню (див. Малюнок нижче). Для того щоб максимізувати їх відстань один від одного, чотири групи сполучних електронів не лежать в одній площині. Натомість кожен з атомів водню лежить у кутах геометричної форми, яка називається тетраедр. Атом вуглецю знаходиться в центрі тетраедра. Кожна грань тетраедра - це рівносторонній трикутник.
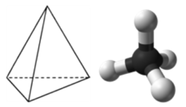
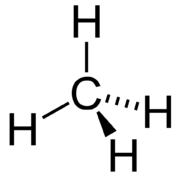
Молекулярна геометрія молекули метану чотиригранна (див. Малюнок\(\PageIndex{5}\)). Кути\(\ce{H-C-H}\) зв'язку є\(109.5^\text{o}\), які більше, ніж ті,\(90^\text{o}\) що вони були б, якби молекула була плоскою. При складанні структурної формули такої молекули, як метан, вигідно мати можливість вказати тривимірний характер її форми. Структурна формула нижче називається перспективним кресленням. Пунктирну лінію зв'язок повинен бути візуалізований як відступаючий на сторінку, тоді як суцільний зв'язок трикутника повинен бути візуалізований як вихід зі сторінки.
Резюме
- Електронні пари відштовхуються один від одного і впливають на кути зв'язку і молекулярну форму.
Рецензія
- Які кути зв'язку в вуглекислому газу?
- Яка молекула має кути зв'язку 109,5 °?
- Яка геометрія молекули BF 3?