9.6: Одиночні ковалентні облігації
- Page ID
- 19117
Що тримає молекули разом?
У тій чи іншій формі ідея атомів, що з'єднуються з утворенням більших речовин, була з нами вже давно. Грецький філософ Демокріт (460-370 рр. До н.е.) вважав, що атоми мають гачки, які дозволяли їм з'єднуватися один з одним. Сьогодні ми вважаємо, що атоми утримуються зв'язками, утвореними, коли два атоми поділяють набір електронів - набагато складніша картина, ніж прості гачки, в які вірив Демокріт.
Поодинокі ковалентні облігації
Ковалентний зв'язок утворюється, коли дві орбіталі з одним електроном перекривають один одного. Для молекули водню це можна показати як:
При утворенні\(\ce{H_2}\) молекули спільні електрони повинні мати протилежний спін, тому вони показані з протилежним спіном в атомній\(1s\) орбіталі.
Галогени також утворюють поодинокі ковалентні зв'язки у своїх двоатомних молекулах. Атом будь-якого галогену, наприклад фтору, має сім валентних електронів. Його непарний електрон розташований в\(2p\) орбіталі.
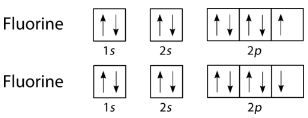
Одиночні електрони в третій\(2p\) орбіталі об'єднуються, утворюючи ковалентний зв'язок:
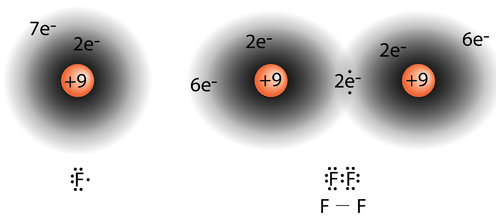
Двоатомна молекула фтору\(\left( \ce{F_2} \right)\) містить одну спільну пару електронів. Кожен\(\ce{F}\) атом також має три пари електронів, які не поділяються з іншим атомом. Одинока пара - це пара електронів в електронно-точковій структурі Льюїса, яка не поділена між атомами. Атом кисню в молекулі води, показаної нижче, має дві одиничні пари наборів електронів. Кожен\(\ce{F}\) атом має три самотні пари. У поєднанні з двома електронами в ковалентному зв'язку кожен\(\ce{F}\) атом слідує правилу октету.
Приклад\(\PageIndex{1}\)
Намалюйте електронну точкову структуру Льюїса для води.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Молекулярна формула води\(= \ce{H_2O}\)
- \(1 \: \ce{O}\)атомні\(= 6\) валентні електрони
- \(2 \: \ce{H}\)атоми\(=2 \times 1 = 2\) валентних електронів
- Загальна кількість валентних електронів\(=8\)
Використовуйте таблицю Менделєєва для визначення кількості валентних електронів для кожного атома і загальної кількості валентних електронів. Розташуйте атоми і розподіліть електрони так, щоб кожен атом слідував правилу октета. Атом кисню матиме 8 електронів, тоді як атоми водню - по 2.
Крок 2: Вирішіть.
Електронні точкові діаграми для кожного атома:
Кожен атом водню зі своїм єдиним електроном утворює ковалентний зв'язок з атомом кисню, де він має один електрон. Отримана електронна точкова структура Льюїса є:
Крок 3: Подумайте про свій результат.
Атом кисню слідує правилу октету з двома парами зв'язкових електронів і двома одинокими парами. Кожен атом водню слідує правилу октету з однією сполучною парою електронів.
Резюме
- Ковалентні зв'язки утворюються, коли електрони в двох атомах утворюють перекриваються орбіталі.
- Самотні парні електрони в атомі не поділяються з будь-яким іншим атомом.
Рецензія
- Як утворюється ковалентний зв'язок?
- Яку взаємозв'язок мають спини спільних електронів один з одним?
- Чи утворюють одиночні парні електрони ковалентні зв'язки?