9.5: Електронно-точкові структури Льюїса
- Page ID
- 19157
Як насправді виглядає холестерин?
Ми можемо написати будову молекули холестерину парою різних способів. Найпростіший підхід - просто писати\(\ce{C_{27}H_{46}O}\). Ця «структура» не дуже корисна, оскільки вона не говорить нам про те, як вуглеці, водні та кисень пов'язані один з одним. Структура на малюнку вище набагато корисніша - ми бачимо, як різні атоми з'єднуються між собою, утворюючи молекулу.
Електронно-точкові структури Льюїса
У попередньому розділі ви дізналися, що валентні електрони атома можна показати простим способом за допомогою електронної точкової діаграми. Атом водню показаний як\(\ce{H} \cdot\) через його одного валентного електрона. Структури молекул, які утримуються разом ковалентними зв'язками, можуть бути побудовані за допомогою електронно-точкових структур Льюїса. Молекула водню показана на малюнку нижче.
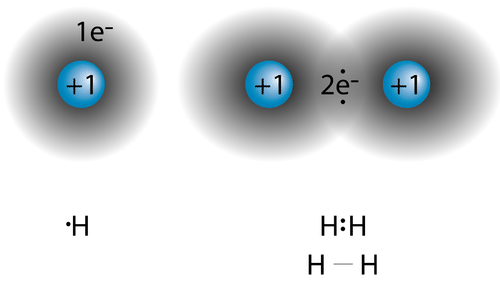
Спільна пара електронів показана у вигляді двох точок між двома\(\ce{H}\) символами\(\left( \ce{H:H} \right)\). Це називається єдиним ковалентним зв'язком, коли два атоми з'єднуються спільним використанням однієї пари електронів. Один ковалентний зв'язок також може бути показаний тире між двома символами\(\left( \ce{H-H} \right)\). Структурна формула - це формула, яка показує розташування атомів в молекулі і являє собою ковалентні зв'язки між атомами тире.
Правило октету та ковалентні зв'язки
Коли утворюються іони, вони відповідають правилу октету, втрачаючи або отримуючи електрони, щоб досягти електронної конфігурації найближчого благородного газу. Аналогічним чином неметалеві атоми поділяють електрони при утворенні ковалентного зв'язку таким чином, що кожен з атомів, що беруть участь в зв'язку, може досягти дворянсько-газової електронної конфігурації. Спільні електрони «підраховуються» для кожного з атомів, що беруть участь у спільному використанні. Для водню\(\left( \ce{H_2} \right)\) спільна пара електронів означає, що кожен з атомів здатний досягти електронної конфігурації гелію, благородного газу з двома електронами. Для атомів, відмінних від водню, спільне використання електронів зазвичай забезпечує кожен з атомів вісьмома валентними електронами.
Резюме
- Електронно-точкові структури Льюїса показують зв'язок у ковалентних молекулах.
- Ковалентні зв'язки між атомами можуть бути позначені\(\left( \ce{:} \right)\) або точками, або тире\(\left( \ce{-} \right)\).
Рецензія
- Що таке одиночний ковалентний зв'язок?
- Як можуть ковалентно зв'язані атоми підкорятися правилу октету?
- Чи підкоряється молекула водню правилу октету?