9.7: Кілька ковалентних облігацій
- Page ID
- 19177
Що ви робите зі своїми залишками?
При роботі з ковалентними структурами іноді виглядає так, ніби там залишилися електрони. Можливо, ви застосували правила, які ви вивчили досі, але там все ще є деякі електрони, що висять, неприв'язані. Ви не можете просто залишити їх там... Отже, куди ви їх поклали?
Множинні ковалентні облігації
Деякі молекули не здатні задовольнити правило октета, складаючи між атомами лише поодинокі ковалентні зв'язки. Розглянемо з'єднання етена, яке має молекулярну формулу\(\ce{C_2H_4}\). Атоми вуглецю пов'язані між собою, причому кожен вуглець також пов'язаний з двома атомами водню.
два\(\ce{C}\) атоми\(= 2 \times 4 = 8\) валентних електронів
чотири\(\ce{H}\) атоми\(= 4 \times 1 = 4\) валентних електронів
= всього 12 валентних електронів в молекулі
Якби електронна точкова структура Льюїса була намальована єдиним зв'язком між атомами вуглецю та правилом октету, це виглядало б так:
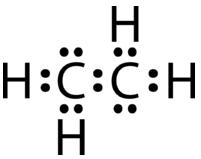
Ця структура Льюїса неправильна, оскільки містить загалом 14 електронів. Однак структуру Льюїса можна змінити, усунувши одинокі пари на атомах вуглецю і маючи атоми вуглецю поділяють дві пари, замість однієї пари, електронів.
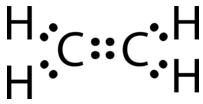
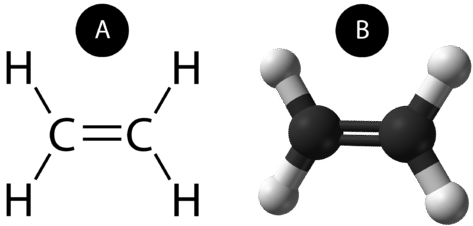
Подвійний ковалентний зв'язок - це ковалентний зв'язок, утворена атомами, які поділяють дві пари електронів. Подвійний ковалентний зв'язок, який виникає між двома атомами вуглецю в етані, також може бути представлений структурною формулою та молекулярною моделлю, як показано на малюнку нижче.
Потрійний ковалентний зв'язок - це ковалентний зв'язок, утворена атомами, які поділяють три пари електронів. Елемент азот - це газ, який становить більшу частину атмосфери Землі. Атом азоту має п'ять валентних електронів, які можуть бути показані як одна пара, так і три одиночних електронів. При поєднанні з іншим атомом азоту, утворюючи двоатомну молекулу, три поодинокі електрони на кожному атомі об'єднуються, утворюючи три спільні пари електронів.
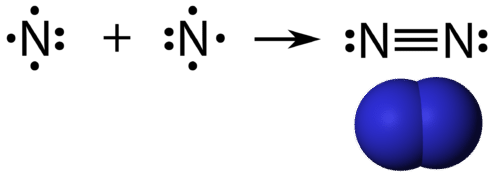
Кожен атом азоту дотримується правила октету з однією самотньою парою електронів і шістьма електронами, які поділяються між атомами.
Резюме
- Структури Льюїса можуть бути намальовані для молекул, які поділяють кілька пар електронів.
- Подвійний ковалентний зв'язок - це ковалентний зв'язок, утворена атомами, які поділяють дві пари електронів.
- Потрійний ковалентний зв'язок - це ковалентний зв'язок, утворена атомами, які поділяють три пари електронів.
Рецензія
- Чому перша структура Етена Льюїса неправильна?
- Що роблять одиночні електрони в азоті, щоб утворити потрійний зв'язок?
- Намалюйте структуру Льюїса для етину C 2 H 2.