18: Співпраця
- Page ID
- 17780
У молекулярній біології часто спостерігається, що нанорозмірні структури зі складними архітектурами збираються спонтанно, без введення зовнішньої енергії. Тому поведінка регулюється фізичними принципами, які ми можемо описати за допомогою термодинаміки та статистичної механіки. Приклади включають:
- Згортання білка і РНК
- гібридизація ДНК
- Збірка білкових комплексів і вірусних капсидів
- Освіта міцел і бульбашок
Хоча кожен з цих процесів має різні характеристики, їх можна широко описати як процеси самостійної збірки.
Характеристика самозбірки полягає в тому, що вона виглядає термодинамічно і кінетично як простий «двостанний перехід», навіть якщо задіяні тисячі атомних ступенів свободи. Тобто в міру зміни термодинамічних регулюючих змінних, таких як температура, експериментально спостерігається зібраний стан і розібране стан, але рідко проміжне, частково зібране стан. Крім того, невеликі зміни цих термодинамічних змінних можуть призвести до різких змін, тобто плавлення ДНК або білків протягом декількох градусів. Ця бінарна або схожа на перемикач поведінка сильно відрізняється від плавно змінних кривих розгортання, які ми вивели для простих ґратчастих моделей полімерів.
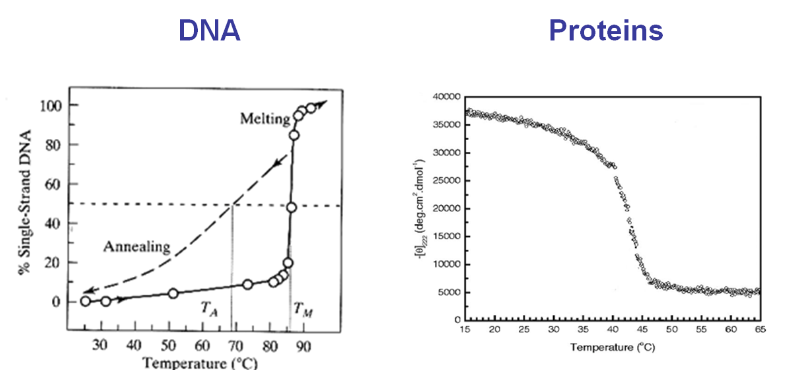
Фазові переходи і фазові рівноваги - це пов'язані явища, описані наявністю (або співіснуванням) двох станів. Вони проявляються великою зміною макроскопічних властивостей системи лише з невеликими змінами температури або іншими термодинамічними змінними. Нагрівання рідкої води від 99° C до 101° C має глибокий вплив на щільність, якої зміна 2° при 25° C не мала б.
Такий фазовий перехід «першого порядку» виникає внаслідок розриву у вільній енергії як функції інтенсивної термодинамічної змінної. 1 Термодинамічний опис поведінки двох станів, що регулюють фазовий перехід, проілюстровано нижче для рівноваги між фазами A і B. Профіль вільної енергії побудовано як функція параметра порядку, змінної, що відрізняє фізичні характеристики, що мають відношення до зміна фази. Наприклад, для фазового переходу рідина-газ об'єм або щільність - це параметри порядку, які різко змінюються. У міру підвищення температури вільна енергія кожного стану, що характеризується його вільною енергією мінімум (G i), знижується плавно і безперервно. Однак стан B зменшується швидше, ніж стан А. Хоча стан А є глобальним мінімумом вільної енергії при низьких температурах, стан B знаходиться при високій температурі. Фази знаходяться в рівновазі один з одним при температурі, де G A = G B.
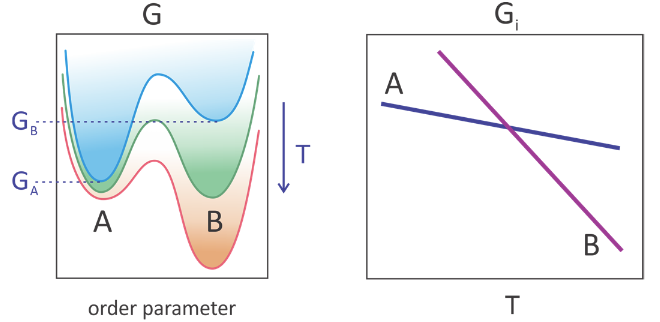
Наявність фазового переходу залежить від всіх молекул системи, що змінюють стан разом, або спільно. У фазовому переході першого порядку ця зміна є нескінченно різкою або переривчастою, але перехід спіраль - котушка та пов'язані з ними кооперативні явища можуть бути безперервними. Кооперативність - це термін, який може ставитися як до макроскопічних явищ, так і до молекулярної шкали. Ми використовуємо його для позначення багатьох ступенів свободи, що змінюються узгоджено. Розмір або кількість частинок або молекул, які беруть участь у кооперативному процесі, є кооперативною одиницею. У разі переходу рідина-газ кооперативною одиницею є макроскопічний зразок, тоді як для згортання білка він може залучати більшу частину молекули.
Що лежить в основі кооперативності? Ми виявляємо, що вільна енергія системи - це не просто добавка в частині. Енергія конкретного конфігураційного стану залежить від конфігурації його сусідів. Наприклад, наявність одного контакту або молекулярної взаємодії збільшує або зменшує схильність до другого контакту або взаємодії. Ми називаємо це позитивною чи негативною співпрацею. Крім самостійної збірки, кооперативність відіграє певну роль у зв'язуванні декількох лігандів та алостерії. Тут ми хочемо обговорити основні поняття, що мають відношення до кооперативності та її взаємозв'язку з поведінкою двох держав.
Виходячи з спостережень, які ми раніше робили в інших контекстах, ми можемо очікувати, що кооперативна поведінка повинна включати конкуруючі термодинамічні ефекти. Структура формується за рахунок великої втрати ентропії, але численні сприятливі контакти, які утворюються, знижують ентальпію ще більше. Зміна вільної енергії може бути невеликою, але це є результатом двох протилежних ефектів великої величини та протилежного знака (H проти TS). Невелика настройка температури може повністю змінити систему.
________________________________________________
1. Перехід першого порядку описується як розрив у G/S або G/V. Перехід другого порядку - це той, в якому дві фази зливаються в одну в критичній точці і описується розривом теплоємності або експансії/стисливості системи (S/T, S/P, V/T, V/T або V/P).