5.1: Гідрофобна сольватія - Термодинаміка
- Page ID
- 18101
Чому масло і вода не змішуються? Що таке гідрофобність? По-перше, термін є неправильним. Жирні молекули, які не змішуються з водою, зазвичай мають сприятливі енергії взаємодії, тобто\(∆H_{int} < 0\). Вальтер Каузманн вперше використав термін «гідрофобне склеювання» в 1954 році. Це найменування було суперечливим з самого початку, але воно, мабуть, застрягло, тому що в цьому випадку\(\Delta G\) саме визначає спорідненість однієї речовини до іншої, а не просто\(\Delta H\). Взагалі кажучи, ентропія змішування керує спостереженням, що дві слабо взаємодіючі рідини будуть спонтанно змішуватися. Однак міжмолекулярні взаємодії рідкої води досить сильні, щоб вона вважала за краще зв'язуватися з собою водню, ніж сольватні неполярні молекули. Він намагатиметься уникнути порушення мережі водневих зв'язків, якщо це можливо.
Гідрофобний ефект відноситься до штрафу за вільну енергію, яку людина платить, щоб сольватувати слабо взаємодіючу розчинену речовину. Посилаючись на термодинамічний цикл вище\(\Delta G_{\text{sol}}\), оборотна робота, необхідна для сольватування гідрофобної молекули, переважає етап 1, процес формування порожнини у воді. Вільна енергія сольватування гідрофобного розчиненого речовини велика і позитивна, що виникає внаслідок двох факторів:
- \(\Delta G_{\text{sol}} < 0\). Ентропія штраф створення порожнини у воді. Обмежуємо конфігураційний простір, доступне для води всередині порожнини. Цьому ефекту і ентропія змішування (що стосується будь-якої проблеми розв'язання) сприяють\(\Delta S_1\).
- \(\Delta G_{\text{sol}} > 0\). Енергетичний штраф за розрив мережі водневих зв'язків (\(\Delta H _1\)) є домінуючим фактором ентальпії. Це можна оцінити за підрахунком чистої кількості H-зв'язків, які потрібно розбити для розміщення розчиненої речовини:\(\Delta H_{\text{sol}}\) збільшується на 1-3 ккал моль\(^{-1}\) водневих зв'язків. Енергія взаємодії між вуглеводнем і водою (\(\Delta H_2\)) слабо сприятлива в результаті дисперсійних взаємодій, але це менший ефект. (При тісному контакті сили ван дер Ваальса знижують енергію на\(\sim\) 0,1-1,0 ккал моль\(^{-1}\)). Тому\(\Delta H_{\text{sol}} \approx \Delta H_1\).
Чистий результат -\(\Delta G_{\text{sol}}\) великий і позитивний, що очікується, оскільки вода і масло не змішуються.
Ці ідеї спочатку були виведені з класичної термодинаміки і висунуті Френком та Евансом (1945) у «моделі айсберга», яка припускала, що вода завжди буде прагнути виконати стільки водневих зв'язків, скільки могла - обгортання мережі навколо розчиненої речовини. Це ще один неправильний номер, оскільки гідрофобний ефект є граничною проблемою щодо зменшення конфігураційного простору, а не фактичного заморожування коливань. Водневі зв'язки продовжують розриватися і реформуватися в рідині, але для цього існує значний виключений конфігураційний простір. Давайте подумаємо про це як реорганізацію мережі водневих зв'язків, спричиненої розчином.
Конфігураційна ентропія води
Давайте зробимо кошторис\(\Delta G_{\text{sol}}\). Якісно ми говоримо про обмеження конфігураційного простору, який молекули води можуть прийняти в межах обмежень чотиригранного потенціалу.


Отже, оцінка ентропії гідрофобної сольватації, якщо ці конфігурації однаково вірогідні,\(\Delta S_{\text{sol}} = k_B \ln (\Omega_{\text{surf}} /\Omega_{\text{bulk}}) = -k \ln 2\) становить на водневий зв'язок втраченого конфігураційного простору:
\[-T \Delta S_{\text{sol}}=k_{B} T \ln 2 \nonumber\]
Оцінюючи при\(300\ K\),
\[\begin{array} {rcl} {-T \Delta G_{\text{sol}}} & = & {1.7 \text{ kJ/mol water molecules @ 300 K}} \\ {} & = & {\text{0.4 kcal/mol water molecules}} \end{array}\nonumber\]
Це значення менше, ніж типова ентальпія для утворення водневих зв'язків, що є ще одним способом сказати, що водневі зв'язки люблять залишатися переважно неушкодженими, але мають великі коливання амплітуди.
Температурна залежність гідрофобної сольватації
Від\(\Delta S_{\text{sol}}\) нас\(\Delta G_{\text{sol}}\) очікують підвищення температури в результаті ентропного терміну. Це класичний підпис гідрофобного ефекту: сила, що рухає конденсацію або поділ фаз, збільшується з температурою. Оскільки зв'язок міцності водневого зв'язку та коливання воднево-зв'язкової мережі води змінюються з температурою, зважування ентальпічних та ентропних факторів у гідрофобній сольватії також змінюється\(T\). Розглянемо типову температурну залежність\(\Delta G_{\text{sol}}\) для малих гідрофобних молекул:
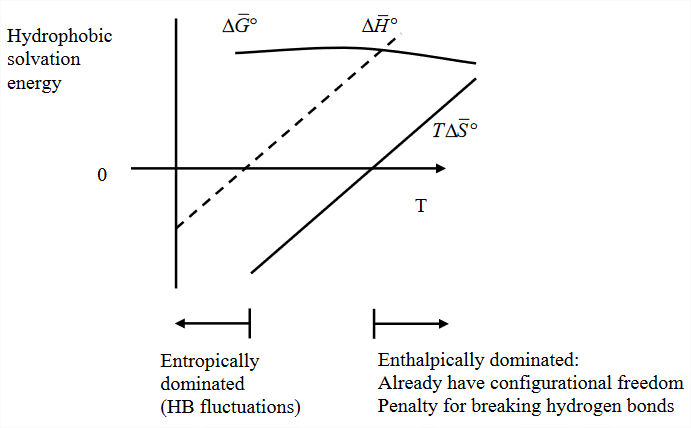
Ентальпічний та ентропний внесок - це два сильно залежні від температури ефекти, які конкурують, щоб призвести до набагато слабкішої температури вільної енергії. Зауважте, що це суттєво відрізняється від температурної залежності хімічних рівноваг, описаних рівнянням Ван Гоффа, яке передбачає,\(\Delta H\) що не залежить від температури. Температурну залежність всіх цих змінних можна описати в плані великої позитивної теплоємності.
\[\begin{array} {rcl} {\Delta C_{\text{p, sol}}} & = & {\dfrac{\partial \Delta H_{\text{sol}}^0}{\partial T} = T\dfrac{\partial \Delta S_{\text{sol}}^0}{\partial T}} \\ {} & = & {-T \dfrac{\partial^2 G_{\text{sol}}^0}{\partial T^2} \ \ \ \ (\text{Curvature of } \Delta G^0)} \end{array} \nonumber\]
При низьких температурах, при більш міцній, жорсткій мережі водневих зв'язків,\(\Delta S\) термін домінує. Але при високій температурі, що наближається до кипіння, ентропний штраф набагато менше.