7.7: Спектроскопія кругового дихроизму та її застосування для визначення вторинної структури оптично активних видів
- Page ID
- 18501
Спектроскопія кругового дихроизму (CD) є одним з небагатьох методів оцінки структури, які можуть бути використані в якості альтернативи і посилення багатьох звичайних методів аналізу з такими перевагами, як швидкий збір даних і простота використання. Оскільки більша частина зусиль і часу, витрачених на розвиток хімічних наук, присвячена з'ясуванню та аналізу структури і складу синтезованих молекул або ізольованих природних продуктів, а не їх приготування, слід знати всі наявні методи і знати, які інструмент можна використовувати як альтернативу будь-якій іншій техніці.
Метою цього модуля є ознайомлення з технікою компакт-дисків та обговорення того, яку інформацію можна зібрати за допомогою компакт-диска. Крім того, будуть показані переваги CD порівняно з іншими методами аналізу та його обмеження.
Оптична активність
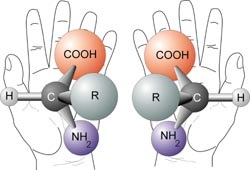
Оскільки спектроскопія CD може аналізувати лише оптично активні види, зручно запускати модуль з коротким введенням оптичної активності. У природі передається практично кожна життєва форма, а це означає, що існує певна ступінь асиметрії, як і в наших руках. Не можна накладати праву руку на ліву, оскільки вони є неоднаковими дзеркальними відображеннями один одного. Так само і хіральні (передаються) молекули, вони існують у вигляді енантіомерів, які дзеркально відображають один одного (рис.\(\PageIndex{1}\)). Одним з цікавих явищ, пов'язаних з хіральними молекулами, є їх здатність обертати площину поляризованого світла. Властивість оптичної активності використовується для визначення питомого обертання, [α] T λ, чистого енантіомеру. Ця функція використовується в поляриметрії, щоб знайти енантіомерний надлишок, (ee), присутній у зразку.
Круговий дихроїзм
Спектроскопія кругового дихроизму (CD) є потужним, але простим методом для вивчення різних аспектів оптично активних органічних і неорганічних молекул. Циркулярний дихроїзм має застосування в різних сучасних наукових областях, починаючи від біохімії до неорганічної хімії. Таке широке застосування методики виникає через її істотну властивість надавати структурну інформацію, яку неможливо отримати іншими способами. Ще однією похвальною особливістю CD є його швидка, легка техніка, яка робить аналіз лічені хвилини. Проте, як і всі методи, CD має ряд обмежень, про які піде мова при порівнянні CD з іншими методами аналізу.
Спектроскопія CD та пов'язані з ними методи розглядалися як езотеричні методи аналізу, необхідні і доступні лише невеликій підпільній групі професіоналів. Для того щоб читач був більш знайомий з технікою, в першу чергу, буде показаний принцип роботи CD і кілька його видів, а також супутні прийоми. Після цього підготовка зразків та використання інструментів будуть покриті для дослідження вторинної структури білка.
Залежно від джерела світла, що використовується для генерації кругополяризованого світла, бувають:
- Far UV CD, використовується для вивчення вторинної структури білків.
- Близько УФ CD, використовується для дослідження третинної структури білків.
- Видимий CD, використовується для моніторингу взаємодії білка іонів металів.
принцип роботи
У спектрометрі CD зразок поміщається в кювету і промінь світла пропускається через зразок. Світло (в теперішньому контексті всі електромагнітні хвилі будуть називатися світлом), що надходить від джерела, піддається кругової поляризації, а це означає, що його площина поляризації робиться для обертання або за годинниковою стрілкою (права кругова поляризація) або проти годинникової стрілки (ліва кругова поляризація) з часом, поки поширення див\(\PageIndex{2}\). Рис.
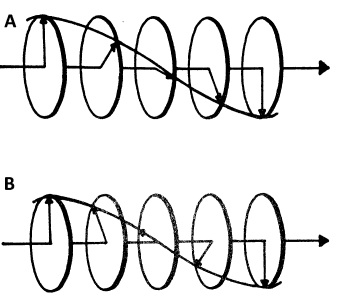
Зразок спочатку опромінюється лівим обертовим поляризованим світлом, а поглинання визначається\ ref {1}. Друге опромінення проводиться правим поляризованим світлом. Тепер, через внутрішню асиметрію хіральних молекул, вони будуть взаємодіяти з циркулярно поляризованим світлом по-різному залежно від напрямку обертання, буде тенденція поглинати більше для одного з напрямків обертання. Різниця між поглинанням лівого і правого кругополяризованого світла - це дані, які отримані з\ ref {2}, де εL і εR - молярні коефіцієнти екстинкції для лівого і правого кругополяризованого світла, c - молярна концентрація, l - довжина шляху, ширина кювети (в см). Різниця в поглинанні може бути пов'язана з різницею в згасанні, Δε, по\ ref {3}.
\[ A\ = \varepsilon c l \label{1} \]
\[ \Delta A\ =\ A_{L}-A_{R}\ =\ (\varepsilon _{L}\ -\ \varepsilon _{R} ) c l \label{2} \]
\[ \Delta \varepsilon \ =\ \varepsilon _{L} \ -\ \varepsilon _{R} \label{3} \]
Зазвичай з історичних причин КД повідомляється не тільки як різниця в коефіцієнтах поглинання або екстинкції, але як ступінь еліптичності, [θ]. Співвідношення між [θ] і Δε задається\ ref {4}.
\[ [\theta ]\ =\ 3,298 \Delta \varepsilon \label{4} \]
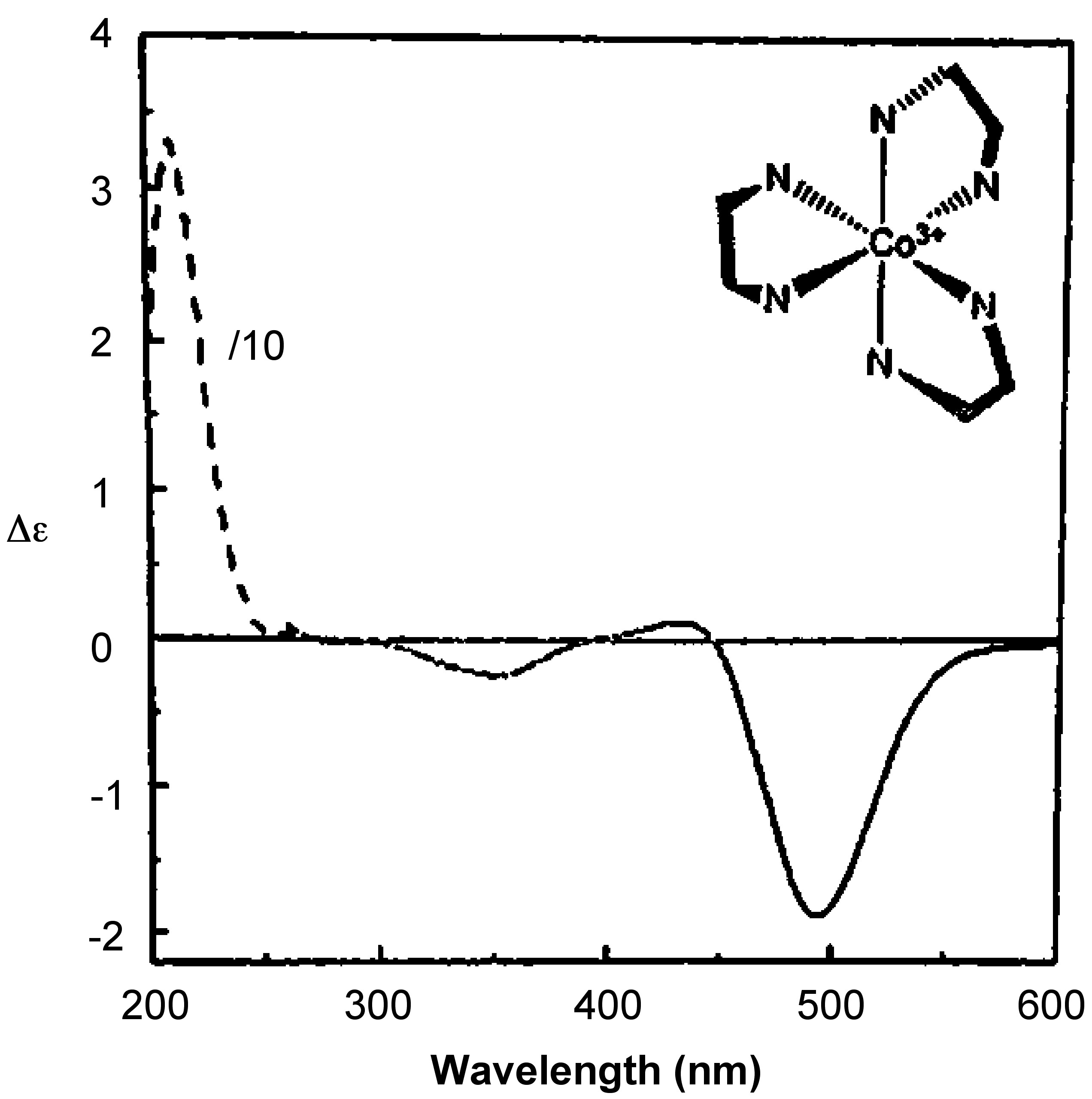
Оскільки поглинання контролюється в діапазоні довжин хвиль, вихід - це графік [θ] проти довжини хвилі або Δε проти довжини хвилі. \(\PageIndex{3}\)На малюнку показаний спектр CD Δ— [Co (en) 3] Cl 3.
Супутні методи
Магнітний круговий дихроїзм
Магнітний круговий дихроїзм (MCD) є сестринською технікою для CD, але є кілька відмінностей:
- MCD не вимагає, щоб зразок мав внутрішню асиметрію (тобто хіральність/оптичну активність), оскільки оптична активність індукується прикладанням магнітного поля паралельно світлу.
- MCD та CD мають різні правила вибору, тому інформація, отримана з цих двох сестринських методів, відрізняється. CD добре оцінює середовище поглинаючої частини зразків, тоді як MCD перевершує отримання детальної інформації про електронну структуру поглинаючої частини.
MCD є потужним методом дослідження магнітних властивостей матеріалів і останнім часом використовується для аналізу залізо-азотної сполуки, найсильнішого з відомих магнітів. Крім того, MCD та його варіація, MCD зі змінною температурою є доповнюючими методами спектроскопії Моссбауера та спектроскопії електронного парамагнітного резонансу (EPR). Отже, ці методи можуть дати корисне посилення до глави про Mossbauer та EPR спектроскопії.
Лінійний дихроїзм
Лінійний дихросім (LD) також є дуже тісно пов'язаною технікою з CD, в якій вимірюється різниця між поглинанням перпендикулярно і паралельно поляризованого світла. У цій техніці площина поляризації світла не обертається. ЛД використовується для визначення орієнтації поглинаючих деталей в просторі.
Переваги та обмеження CD
Як і будь-який інший інструмент CD має свої сильні сторони і межі. Порівняння між CD і ЯМР, наведене в таблиці,\(\PageIndex{1}\) дає гарне уявлення про можливості CD.
| КОМПАКТ-ДИСК | ЯМР |
|---|---|
| Молекули будь-якого розміру можуть бути вивчені | Є обмеження за розмірами |
| Експерименти швидко виконуються; вимірювання однієї довжини хвилі вимагають мілісекунд | Це не так весь час. |
| Унікальна чутливість до асиметрії в структурі зразка. | Для розмежування енантіомерів потрібні спеціальні умови. |
| Може працювати з дуже малими концентраціями, подовжуючи ширину кювети, поки не буде досягнуто помітного поглинання. | Існує межа чутливості приладу. |
| Тимчасовий масштаб значно коротший (УФ), що дозволяє вивчати динамічні системи та кінетику. | Терміни тривалі, використання радіохвиль дає середнє значення всіх динамічних систем. |
| Можливий тільки якісний аналіз даних. | Кількісний аналіз даних може бути проведений для оцінки хімічного складу. |
| Не забезпечує аналіз структури атомного рівня | Дуже потужний для аналізу атомного рівня, надаючи важливу інформацію про хімічні зв'язки в системі. |
| Спостережуваного спектра недостатньо для того, щоб претендувати на одну і єдину можливу структуру. | Спектр ЯМР є ключовою інформацією для присвоєння унікальної структури. |
Які дані отримані з компакт-диска?
Одним з ефективних способів продемонструвати можливості спектроскопії CD є охоплення випадку дослідження вторинної структури білка, оскільки спектроскопія CD є усталеною методикою з'ясування вторинної структури білків, а також будь-яких інших макромолекул. За допомогою CD можна оцінити ступінь конформаційного порядку (який відсоток білків зразка знаходиться в α-спіралі та/або β-аркуші конформації), див\(\PageIndex{4}\). Рис.
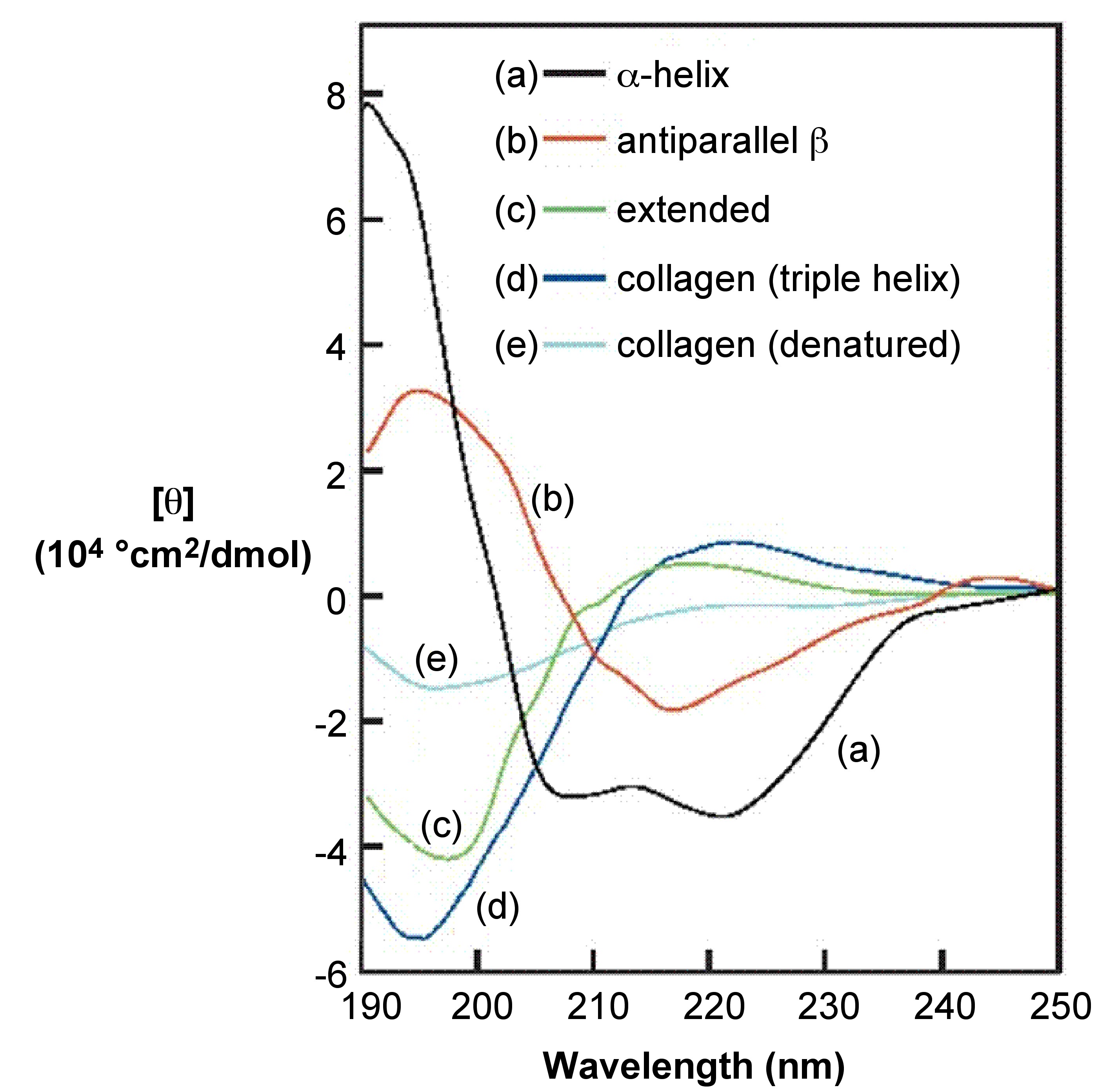
Ключові моменти для візуальної оцінки вторинної структури шляхом розгляду спектру CD:
- α-спіральні білки мають негативні смуги при 222 нм і 208 нм і позитивну смугу при 193 нм.
- β-спіралі мають негативні смуги на 218 нм і позитивні смуги на 195 нм.
- Білки, які не мають будь-якої впорядкованої вторинної структури, не матимуть піків вище 210 нм.
Оскільки спектри CD білків однозначно представляють їх конформацію, CD можна використовувати для моніторингу структурних змін (внаслідок складноутворення, згортання/розгортання, денатурації через підвищення температури, денатурантів, зміни послідовності/мутації амінокислот тощо) в динамічних системах та для вивчення кінетики білок. Іншими словами, CD можна використовувати для виконання досліджень стійкості та моделювання взаємодії.
CD Інструмент
\(\PageIndex{5}\)На малюнку зображений типовий компакт-диск інструмент.

Протокол збору спектра компакт-дисків
Більшість білків і пептидів потребують використання буферів, щоб запобігти денатурації. Слід проявляти обережність, щоб уникнути використання будь-яких оптично активних буферів. Потрібні чіткі рішення. CD береться в кварцових кюветах високої прозорості, щоб забезпечити найменші перешкоди. Є кювети, які мають довжину шляху від 0,01 см до 1 см. Залежно від УФ-активності використовуваних буферів слід вибирати кювету з довжиною шляху (відстань, через яку промінь світла проходить через зразок), що компенсує поглинання буфера УФ. Розчини слід готувати відповідно до кювети, які будуть використовуватися, див\(\PageIndex{2}\). табл.
| Шляхи кювети (см) | Концентрація зразка (мг/мл) |
|---|---|
| 0.01-0.02 | 0,2-1,0 |
| 0.1 | 0,05-0,2 |
| 1 | 0,005-0,01 |
Крім того, так само, як солі, що використовуються для підготовки піддонів у FT-IR, буфери на компакт-диску показуватимуть зрізи в певній точці в області низьких хвиль, що означає, що буфери починають поглинати після певної wavelengh. Значення зрізу для більшості поширених буферів відомі і їх можна знайти у виробника. Кисень поглинає світло нижче 200 нм. Тому для видалення перешкод буфери слід готувати з дистильованої води або воду перед використанням дегазувати. Ще одним важливим моментом є точне визначення концентрації зразка, оскільки концентрація повинна бути відома для аналізу даних CD. Концентрацію зразка можна визначити за коефіцієнтами екстинкції, якщо такі повідомляються в літературі, також для білкових проб може бути використаний кількісний аналіз амінокислот.
Багато приладів CD поставляються в комплекті з блоком контролю температури відсіку для зразків. Це дуже зручно при проведенні досліджень стабільності та розгортання/денатурації білків. Перевірте, щоб радіатор заповнений водою. Увімкніть блок регулювання температури і встановіть на обрану температуру.
Джерело ультрафіолетового випромінювання в CD є дуже потужною лампою і може генерувати велику кількість озону в своїй камері. Озон значно скорочує термін служби лампи. Тому кисень слід видалити перед включенням основної лампи (інакше він буде перетворений в озон біля лампи). Для цього газ азот постійно змивається в відсік лампи. Дайте азоту промивати принаймні протягом 15 хв. перед включенням лампи.
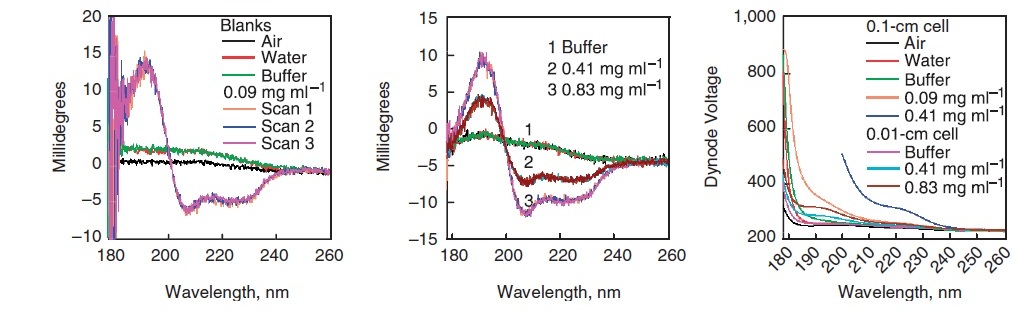
Збір спектрів для порожнього, води, буфера фону та зразка
- Зберіть спектр повітряної заготовки (рис.\(\PageIndex{6}\)). Це буде по суті лінія, що лежить на осі х спектра, нульового поглинання.
- Наповніть кювету водою і візьміть спектр.
- Краплі води, залишені в кюветі, можуть змінити концентрацію вашого зразка, особливо при роботі з розведеними зразками. Значить, важливо ретельно просушити кювету. Після висихання кювети зберіть спектр буфера точно такої ж концентрації, як використовується для зразка (рис.\(\PageIndex{6}\)). Це крок, коли буфер підтверджується відповідним спектром буфера, і вода повинна перекриватися в межах експериментальної помилки, за винятком області низької довжини хвилі, де відношення сигнал/шум є низьким.
- Очистіть кювету, як описано вище, і заповніть розчином зразка. Зберіть спектр CD три рази для кращої точності (рис.\(\PageIndex{6}\)). Для білків багаторазові сканування повинні перекриватися і не дрейфувати з часом.
Обробка та аналіз даних
Після збереження даних як для спектрів вибірки, так і заготовки згладжуються за допомогою вбудованих команд програмного забезпечення контролера. Згладжена базова лінія віднімається з згладженого спектра зразка. Наступним кроком є використання програмних пакетів, які мають алгоритми оцінки вторинної структури білків. Ввести дані в обраний програмний пакет і обробити його. Виходом з алгоритмів буде відсоток певної вторинної конформації структури у вибірці. Дані, наведені на малюнку,\(\PageIndex{7}\) перераховують часто використовувані методи і порівнюють їх для декількох білків. Орієнтовна вторинна структура порівнюється з рентгенівськими даними, і можна помітити, що найкраще використовувати кілька методів для найкращої точності.

Висновок
Які переваги CD має перед іншими методами аналізу? CD спектроскопія є відмінним, швидким методом оцінки вторинної структури білків і проведення досліджень динамічних систем, таких як згортання і зв'язування білків. Варто зазначити, що CD не надає інформації про положення тих субодиниць з конкретною конформацією. Однак КД перевершує інші методи швидкої оцінки структури невідомих зразків білка та моніторингу структурних змін відомих білків, спричинених перев'язкою та комплексоутворенням, зміною температури, мутаціями, денатурантами. CD також широко використовується для зіставлення злитих білків з аналогами дикого типу, оскільки спектри CD можуть визначити, чи зберігав злитий білок структуру дикого типу або зазнав змін.
