13.3: Радіохімія
- Page ID
- 24830
Атоми, які мають однакову кількість протонів, але різну кількість нейтронів, є ізотопами. Для ідентифікації ізотопу ми використовуємо позначення\({}_Z^A E\), де E - атомний символ елемента, Z - атомний номер елемента, а A - номер атомної маси елемента. Хоча різні ізотопи елемента мають однакові хімічні властивості, їх ядерні властивості не ідентичні. Найголовніша відмінність ізотопів - їх стабільність. Ядерна конфігурація стабільного ізотопу залишається постійною з часом. Нестабільні ізотопи, однак, розпадаються спонтанно, випромінюючи радіоактивні частинки, коли вони перетворюються в більш стабільну форму.
Атомний номер елемента, Z, дорівнює числу протонів і його атомна маса, A, дорівнює сумі кількості протонів і нейтронів. Ми представляємо ізотоп вуглецю-13 як\(_{6}^{13} \text{C}\) тому, що вуглець має шість протонів і сім нейтронів. Іноді ми опускаємо Z з цього позначення - ідентифікація елемента, а атомний номер повторюється, оскільки всі ізотопи вуглецю мають шість протонів, а будь-який атом, який має шість протонів, є ізотопом вуглецю. Таким чином, 13 С і С—13 є альтернативними позначеннями для цього ізотопу вуглецю.
Найважливішими типами радіоактивних частинок є альфа-частинки, бета-частинки, гамма-промені та рентгенівські промені. Альфа-частинка\(\alpha\), еквівалентна гелієвому ядру,\({}_2^4 \text{He}\). Коли атом випромінює альфа-частинку, продукт у новому атомі, атомний номер і атомний масовий номер якого відповідно на 2 і 4 менше, ніж його нестійкий батько. Розпад урану на торій є одним із прикладів альфа-емісії.
\[_{92}^{238} \text{U} \longrightarrow _{90}^{234} \text{Th}+\alpha \nonumber\]
Бета-частинка поставляється в одній з двох форм.\(\beta\) Негатрон виробляється\(_{-1}^0 \beta\), коли нейтрон змінюється в протон, збільшуючи атомний номер на одиницю, як показано тут для свинцю.
\[_{82}^{214} \mathrm{Pb} \longrightarrow_{83}^{214} \mathrm{Bi} + _{-1}^{0} \beta \nonumber\]
Перетворення протона в нейтрон призводить до випромінювання позитрона,\(_{1}^0 \beta\).
\[_{15}^{30} \mathrm{P} \longrightarrow_{14}^{30} \mathrm{Si} + _{1}^{0} \beta \nonumber\]
Негатрон, який є більш поширеним типом бета-частинок, еквівалентний електрону.
Емісія альфа або бета-частинки часто виробляє ізотоп в нестабільному, високоенергетичному стані. Ця надлишкова енергія виділяється у вигляді гамма-променя\(\gamma\), або у вигляді рентгенівського випромінювання. Гамма-випромінювання та рентгенівське випромінювання також можуть відбуватися без вивільнення альфа-частинки або бета-частинки.
Теорія і практика
Швидкість розпаду радіоактивного ізотопу, або активність, слідує кінетиці першого порядку
\[A=-\frac{d N}{d t}=\lambda N \label{13.1}\]
де A - активність ізотопу, N - кількість радіоактивних атомів, присутніх у зразку в момент t, і\(\lambda\) є постійною розпаду ізотопу. Активність виражається у вигляді кількості розпусків за одиницю часу.
Як і будь-який процес першого порядку, ми можемо переписати Equation\ ref {13.1} в інтегрованому вигляді.
\[N_{t}=N_{0} e^{-\lambda t} \label{13.2}\]
Підстановка рівняння\ ref {13.2} у рівняння\ ref {13.2} дає
\[A=\lambda N_{0} e^{-\lambda t}=A_{0} e^{-\lambda t} \label{13.3}\]
Якщо виміряти активність зразка в момент t, ми можемо визначити початкову активність зразка, A 0, або кількість радіоактивних атомів, спочатку присутніх у зразку, N 0.
Важливою характерною властивістю радіоактивного ізотопу є його період напіврозпаду, t 1/2, який є кількістю часу, необхідного для розпаду половини радіоактивних атомів. Для кінетики першого порядку період напіврозпаду становить
\[t_{1 / 2}=\frac{0.693}{\lambda} \label{13.4}\]
Оскільки період напіврозпаду не залежить від кількості радіоактивних атомів, він залишається постійним протягом усього процесу розпаду. Наприклад, якщо 50% радіоактивних атомів залишаються після одного періоду напіврозпаду, то 25% залишаються після двох періодів напіврозпаду, а 12,5% - після трьох періодів напіврозпаду.
Припустимо, ми починаємо з N 0 з 1200 атомів. Протягом першого періоду напіврозпаду 600 атомів розпадаються і 600 залишаються. Протягом другого періоду напіврозпаду 300 з 600 атомів, що залишилися, розпадаються, залишаючи 300 атомів або 25% вихідних 1200 атомів. З 300 атомів, що залишилися, тільки 150 залишаються після третього періоду напіврозпаду, або 12,5% від вихідних 1200 атомів.
Кінетична інформація про радіоактивний ізотоп зазвичай дається з точки зору його періоду напіврозпаду, оскільки вона забезпечує більш інтуїтивне відчуття стабільності ізотопу. Знання, наприклад, що константа розпаду для\(_{38}^{90}\text{Sr}\) становить 0,0247 рік —1, не дає безпосереднього відчуття того, як швидко вона розпадається. З іншого боку, знаючи, що його період напіврозпаду становить 28.1 рік дає зрозуміти, що концентрація\(_{38}^{90}\text{Sr}\) в зразку залишається по суті постійною протягом короткого періоду часу.
Контрольно-вимірювальні прилади
Альфа-частинки, бета-частинки, гамма-промені та рентгенівські промені вимірюються за допомогою енергії частинки для отримання посиленого імпульсу електричного струму в детекторі. Ці імпульси підраховуються, щоб дати швидкість розпаду. Існує три поширені типи детекторів: газонаповнені детектори, сцинтиляційні лічильники та напівпровідникові детектори. Газонаповнений детектор складається з трубки, яка містить інертний газ, такий як Ar. Коли радіоактивна частинка потрапляє в трубку, вона іонізує інертний газ, утворюючи Ar +/e — іонну пару. Рух електрона до анода і Ar + до катода генерує вимірюваний електричний струм. Лічильник Гейгера - один із прикладів газонаповненого детектора. Лічильник сцинтиляції використовує флуоресцентний матеріал для перетворення радіоактивних частинок у легко вимірювані фотони. Наприклад, один твердотільний сцинтиляційний лічильник складається з кристала NaI, який містить 0,2% TLi, який виробляє кілька тисяч фотонів для кожної радіоактивної частинки. Нарешті, в напівпровідниковому детекторі адсорбція однієї радіоактивної частинки сприяє тисячам електронів до смуги провідності напівпровідника, збільшуючи провідність.
Кількісні програми
У цьому розділі розглянуто три поширені кількісні радіохімічні методи аналізу: прямий аналіз радіоактивного ізотопу шляхом вимірювання швидкості його розпаду, активації нейтронів та розведення ізотопів.
Прямий аналіз радіоактивних аналітів
Концентрація довгоживучого радіоактивного ізотопу залишається по суті постійною протягом періоду аналізу. Як показано в прикладі Template:index, ми можемо використовувати активність зразка для обчислення кількості радіоактивних частинок у зразку.
Активність у пробі стічних вод 10,00 мл, яка містить,\(_{38}^{90}\text{Sr}\)\(9.07 \times 10^6\) є розпаданнями/с Яка молярна концентрація\(_{38}^{90}\text{Sr}\) у зразку? Період напіввиведення для\(_{38}^{90}\text{Sr}\) становить 28,1 рік.
Рішення
Розв'язування рівняння\ ref {13.4} для\(\lambda\), підставляючи в рівняння\ ref {13.1}, і розв'язування для N дає
\[N=\frac{A \times t_{1 / 2}}{0.693} \nonumber\]
Перш ніж ми зможемо визначити кількість атомів\(_{38}^{90}\text{Sr}\) у зразку, ми повинні висловити його активність та період напіврозпаду, використовуючи ті ж одиниці. Перетворення періоду напіврозпаду в секунди дає t 1/2 як\(8.86 \times 10^8\) s; таким чином, є
\[\frac{\left(9.07 \times 10^{6} \text { disintegrations/s }\right)\left(8.86 \times 10^{8} \text{ s}\right)}{0.693} = 1.16 \times 10^{16} \text{ atoms} _{38}^{90}\text{Sr} \nonumber\]
Концентрація\(_{38}^{90}\text{Sr}\) в зразку становить
\[\frac{1.16 \times 10^{16} \text { atoms } _{38}^{90} \text{Sr}}{\left(6.022 \times 10^{23} \text { atoms/mol }\right)(0.01000 \mathrm{L})} = 1.93 \times 10^{-6} \text{ M } _{38}^{90}\text{Sr} \nonumber\]
Прямий аналіз короткоживучого радіоактивного ізотопу методом, описаним у прикладі Template:index, є менш корисним, оскільки забезпечує лише перехідний показник концентрації ізотопу. Натомість ми можемо виміряти його активність через минулий час, t, і використовувати Equation\ ref {13.3} для обчислення N 0.
Аналіз активації нейтронів
Мало аналітів є природним радіоактивним. Однак для багатьох аналітів ми можемо індукувати радіоактивність, опромінюючи зразок нейтронами в процесі, який називається аналізом активації нейтронів (NAA). Радіоактивний елемент, утворений при активації нейтронів, розпадається до стійкого ізотопу, випромінюючи гамма-промінь, і, можливо, і інші ядерні частинки. Швидкість випромінювання гамма-випромінювання пропорційна початковій концентрації аналіту в зразку. Наприклад, якщо ми помістимо зразок, що містить нерадіоактивний,\(_{13}^{27}\text{Al}\) в ядерний реактор і опромінюємо його нейтронами, відбувається наступна ядерна реакція.
\[_{13}^{27} \mathrm{Al}+_{0}^{1} \mathrm{n} \longrightarrow_{13}^{28} \mathrm{Al} \nonumber\]
Радіоактивний ізотоп 13 Al має характерний процес розпаду, який включає вивільнення бета-частинки і гамма-променя.
\[_{13}^{28} \mathrm{Al} \longrightarrow_{14}^{28} \mathrm{Al}+_{-1}^{0} \beta + \gamma \nonumber\]
Коли опромінення завершено, ми видаляємо зразок з ядерного реактора, дозволяємо будь-яким короткочасним радіоактивним перешкодам розпастися на задній план, і вимірюємо швидкість випромінювання гамма-випромінювання.
Початкова активність в кінці опромінення залежить від кількості атомів, які присутні. Це, в свою чергу, дорівнює різниці між швидкістю утворення для\(_{13}^{28}\text{Al}\) і швидкістю її розпаду
де\(\Phi\) - потік нейтронів і\(\sigma\) перетин реакції, або ймовірність того, що\(_{13}^{27}\text{Al}\) ядро захоплює нейтрон. Інтегруючи рівняння\ ref {13.5} за час опромінення, t i, і множення на\(\lambda\) дає початкову активність, A 0, в кінці опромінення як
\[A_0 = \lambda N_{_{13}^{28}\text{Al}} = \Phi \sigma N_{_{13}^{27}\text{Al}} (1-e^{-kt}) \nonumber\]
Якщо ми знаємо значення для A 0,,\(\Phi\)\(\sigma\)\(\lambda\), і t i, то ми можемо обчислити кількість атомів\(_{13}^{27}\text{Al}\) спочатку присутніх у зразку.
Більш простий підхід полягає у використанні одного або декількох зовнішніх стандартів. Допускаючи\((A_0)_x\) і\((A_0)_s\) представляючи початкову активність аналіта в невідомому та зовнішньому стандарті, а також дозволяючи\(w_x\) та\(w_s\) представляючи вагу аналіта в невідомому та зовнішньому стандарті, отримаємо наступну пару рівнянь
\[\left(A_{0}\right)_{x}=k w_{x} \label{13.6}\]
\[\left(A_{0}\right)_{s}=k w_{s} \label{13.7}\]
що ми можемо вирішити для визначення маси аналіта в зразку.
Як зазначалося раніше, випромінювання гамма-променів вимірюється після періоду, протягом якого ми дозволяємо короткочасним перешкодам розпастися на задній план. Як показано на рисунку Template:index, ми визначаємо початкову активність вибірки або еталону шляхом екстраполяції кривої активності проти часу назад до t = 0. Крім того, якщо ми опромінюємо зразок і стандарт одночасно, і якщо ми вимірюємо їх діяльність одночасно, то ми можемо замінити ці дії на (A 0) x і (A 0) s. Це стратегія, яка використовується в наступному прикладі.
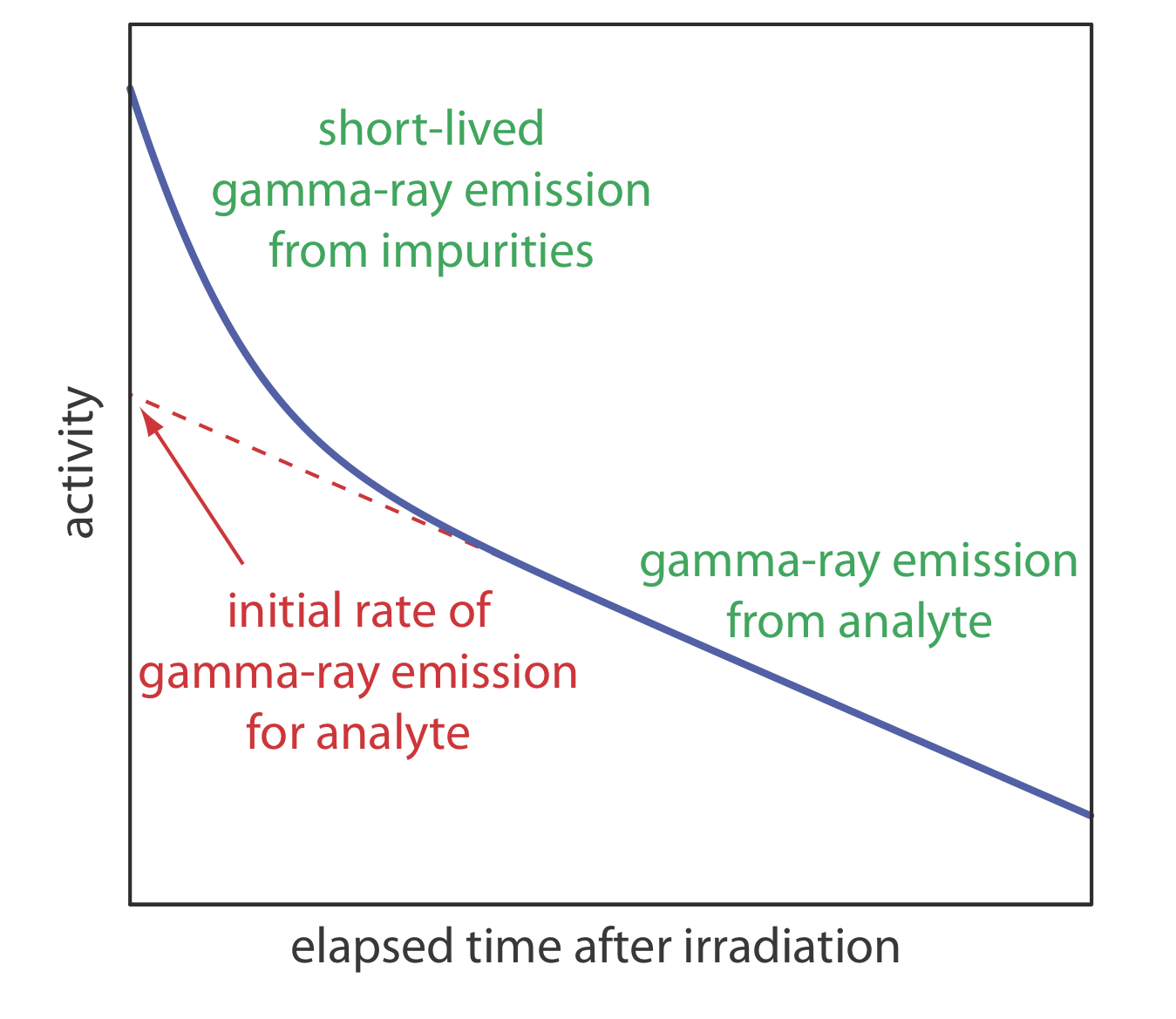
Концентрація Mn в сталі визначається аналізом активації нейтронів методом зовнішніх стандартів. Зразок 1,000 г невідомого зразка сталі і 0,950-г зразка стандартної сталі, яка, як відомо, містить 0,463% w/w Mn опромінюються нейтронами протягом 10 ч в ядерному реакторі. Після 40-хвилинної затримки випромінювання гамма-випромінювання становить 2542 cpm (відраховується в хвилину) для невідомого та 1984 cpm для зовнішнього стандарту. Що таке %w/w Mn у невідомому зразку сталі?
Рішення
Об'єднання рівнянь\ ref {13.6} і\ ref {13.7} дає
\[w_{x}=\frac{A_{x}}{A_{s}} \times w_{s} \nonumber\]
Вага Mn в зовнішньому стандарті дорівнює
\[w_{s}=\frac{0.00463 \text{ g } \text{Mn}}{\text{ g } \text { steel }} \times 0.950 \text{ g} \text { steel }=0.00440 \text{ g} \text{ Mn} \nonumber\]
Підстановка в вищевказане рівняння дає
\[w_{x}=\frac{2542 \text{ cpm}}{1984 \text{ cpm}} \times 0.00440 \text{ g} \text{ Mn}=0.00564 \text{ g} \text{ Mn} \nonumber\]
Оскільки початкова маса сталі становить 1.000 г, %w/w Mn становить 0,564%.
Серед переваг нейтронної активації є її застосовність практично до всіх елементів таблиці Менделєєва і те, що вона неруйнівна для зразка. Отже, НАА є важливим прийомом аналізу археологічних та криміналістичних зразків, а також творів мистецтва.
Розведення ізотопу
Ще одним важливим радіохімічним методом аналізу нерадіоактивних аналітів є розведення ізотопів. Зовнішнє джерело аналіту готується в радіоактивній формі з відомою активністю, A T, для його радіоактивного розпаду - ми називаємо цю форму аналіту трасувачем. Для підготовки зразка до аналізу додаємо відому масу трасера, w T, до частини зразка, яка містить невідому масу, w x, аналіту. Після гомогенізації зразка та простежувача ми виділяємо г А грам аналіту, використовуючи серію відповідних хімічних та фізичних процедур. Оскільки ці хімічні та фізичні процедури не можуть розрізняти радіоактивні та нерадіоактивні форми аналіту, ізольований матеріал містить обидва. Нарешті, виміряємо активність ізольованого зразка, А А. Якщо ми відновимо весь аналіт - як радіоактивний трактор, так і нерадіоактивний аналіт - тоді A A і A T рівні, а w x = w A - w T. Як правило, ми не в змозі відновити всі аналіти. У цьому випадку A A менше, ніж A T, і
\[A_{A}=A_{T} \times \frac{w_{A}}{w_{x}+w_{T}} \label{13.8}\]
Співвідношення ваг в Equation\ ref {13.8} становить будь-яку втрату активності, яка є наслідком нашої нездатності відновити весь аналіт. Розв'язування рівняння\ ref {13.8} для w x дає
\[w_{x}=\frac{A_{T}}{A_{A}} w_{A}-w_{T} \label{13.9}\]
Те, як ми обробляємо зразок, залежить від аналіту та матриці зразка. Ми можемо, наприклад, переварити зразок, щоб привести аналіт у розчин. Після фільтрування зразка для видалення залишкових твердих речовин ми можемо осад аналіту, ізолювати його фільтрацією, висушити в печі та отримати його вагу.
Враховуючи, що метою аналізу є визначення кількості нерадіоактивного аналіту в нашому зразку, усвідомлення того, що ми не можемо відновити весь аналіт, може вразити вас як тривожне. Нагадаємо з глави 7.7, що одна рідина-рідка екстракція рідко має ефективність екстракції 100%. Однією з переваг розведення ізотопів є те, що ефективність вилучення для нерадіоактивного аналіту та для трасера однакова. Якщо ми відновлюємо 50% трасера, то ми також відновлюємо 50% нерадіоактивного аналіту. Оскільки ми знаємо, скільки трасера ми додали до зразка, ми можемо визначити, скільки нерадіоактивного аналіту знаходиться в зразку.
Концентрація інсуліну у виробничому чані визначається розведенням ізотопів. 1,00-мг зразка інсуліну, міченого 14 С, що має активність 549 cpm, додають до зразка 10,0-мл, взятого з виробничого чана. Після гомогенізації зразка частина інсуліну відокремлюється і очищається, отримуючи 18,3 мг чистого інсуліну. Активність для виділеного інсуліну вимірюється при 148 cpm. Скільки мг інсуліну в вихідному зразку?
Рішення
Підстановка відомих значень у рівняння\ ref {13.8} дає
\[w_{x}=\frac{549 \text{ cpm}}{148 \text{ cpm}} \times 18.3 \text{ mg}-1.00 \text{ mg}=66.9 \text{ mg} \text { insulin } \nonumber\]
Рівняння\ ref {13.8} і Equation\ ref {13.9} дійсні лише в тому випадку, якщо період напіврозпаду трасера значно довший за час, необхідний для проведення аналізу. Якщо це не так, то зниження активності обумовлено як неповним відновленням, так і природним зниженням активності трасера. У таблиці Template:index наведено список кількох поширених засобів розведення ізотопів.
| ізотопу | період напіврозпаду |
|---|---|
| 3 Ч | 12,5 років |
| 14 С | 5730 років |
| 32 П | 14.3 днів |
| 35 С | 87,1 днів |
| 45 Са | 152 дні |
| 55 Лт | 2, 91 років |
| 60 Ко | 5,3 років |
| 131 Я | 8 днів |
Важливою особливістю розведення ізотопів є те, що не потрібно відновлювати весь аналіт, щоб визначити кількість аналіту, присутнього в вихідному зразку. Отже, розведення ізотопів корисно для аналізу зразків зі складними матрицями, де повне відновлення аналіту утруднено.
Характеристика додатків
Одним із прикладів застосування характеристики є визначення віку зразка на основі розпаду радіоактивного ізотопу, природно присутнього у зразку. Найбільш поширеним прикладом є датування вуглець-14, яке використовується для визначення віку природних органічних матеріалів.
Коли космічні промені проходять через верхню атмосферу, деякі\(_7^{14}\text{N}\) атоми в атмосфері захоплюють високоенергетичні нейтрони, перетворюючи їх в\(_6^{14}\text{C}\). \(_6^{14}\text{C}\)Потім мігрує в нижню атмосферу, де окислюється, утворюючи C-14 мічений CO 2. Згодом тварини та рослини включають цей мічений CO 2 у свої тканини. Оскільки це сталий процес, всі рослини і тварини мають однакове співвідношення\(_6^{14}\text{C}\) до\(_6^{12}\text{C}\) в своїх тканині. Коли організм гине, радіоактивний розпад\(_6^{14}\text{C}\) до\(_7^{14}\text{N}\) шляхом\(_{-1}^0 \beta\) викиду (t = 5730 років) призводить до передбачуваного зниження\(_6^{12}\text{C}\) співвідношення\(_6^{14}\text{C}\) до. Ми можемо використовувати зміну цього співвідношення на сьогоднішній день зразки, які досягають 30000 років, хоча точність аналізу найкраща, коли вік вибірки менше 7000 років. Точність датування вуглець-14 залежить від нашого припущення, що природне\(_6^{12}\text{C}\) співвідношення\(_6^{14}\text{C}\) в атмосфері є постійним з часом. Деяка різниця в співвідношенні відбулася в результаті збільшення споживання викопного палива і виробництва\(_6^{14}\text{C}\) під час випробувань ядерної зброї. Калібрувальна крива, підготовлена з використанням зразків відомого віку - приклади зразків включають кільця дерев, глибоководні відкладення океану, зразки коралів та печерні відкладення - обмежує це джерело невизначеності.
Немає необхідності готувати калібрувальну криву для кожного аналізу. Натомість існує універсальна калібрувальна крива, відома як IntCal. Найновіша така крива, IntCal13, описана в наступній роботі: Reimer, P J., et. al. «IntCal13 та морська 13 Крива калібрування радіовуглецевого віку 0-50,000 років Cal BP,» Радіовуглець 2013, 55, 1869—1887. Ця калібрування охоплює 50 000 років до теперішнього часу (BP).
Для визначення віку зразка тканини\(_6^{12}\text{C}\) було виміряно відносне співвідношення\(_6^{14}\text{C}\) до, що дає результат 80,9% від того, що виявлено в сучасних волокні. Скільки років тканини?
Рішення
Рівняння\ ref {13.3} і Equation\ ref {13.4} надають нам метод перетворення зміни співвідношення\(_6^{14}\text{C}\)\(_6^{12}\text{C}\) до до віку тканини. Допускаючи A 0 відношення\(_6^{14}\text{C}\) до\(_6^{12}\text{C}\) в сучасних волокнам, ми присвоюємо йому значення 1,00. Співвідношення\(_6^{14}\text{C}\) до\(_6^{12}\text{C}\) в зразку, А, становить 0,809. Рішення дає
\[t=\ln \frac{A_{0}}{A} \times \frac{t_{1 / 2}}{0.693}=\ln \frac{1.00}{0.809} \times \frac{5730 \text { yr }}{0.693}=1750 \text { yr } \nonumber\]
Інші ізотопи можуть бути використані для визначення віку зразка. Вік гірських порід, наприклад, був визначений із відношення числа\(_{92}^{238}\text{U}\) до числа стабільних\(_{82}^{206}\text{Pb}\) атомів, що утворюються при радіоактивному розпаді. Для гірських порід, які не містять уран, датування здійснюється шляхом порівняння співвідношення радіоактивного\(_{19}^{40}\text{K}\) до стабільного\(_{18}^{40}\text{Ar}\). Іншим прикладом є датування відкладень, зібраних з озер шляхом вимірювання кількості\(_{82}^{210}\text{Pb}\), яка присутня.
Оцінка
Радіохімічні методи зазвичай використовуються для аналізу слідових аналітів в макро- і мезозразках. Точність і точність радіохімічних методів, як правило, знаходяться в межах 1— 5%. Ми можемо підвищити точність - яка обмежена випадковою природою радіоактивного розпаду - підраховуючи викиди радіоактивних частинок протягом тривалого часу, наскільки це практично. Якщо кількість рахунків, М, досить велика (M ≥ 100), а період підрахунку значно менше, ніж період напіврозпаду ізотопу, то відсоток відносного стандартного відхилення для діяльності\((\sigma_A)_{rel}\), приблизно
\[\left(\sigma_{A}\right)_{\mathrm{rel}}=\frac{1}{\sqrt{M}} \times 100 \nonumber\]
Наприклад, якщо визначити активність шляхом підрахунку 10 000 радіоактивних частинок, то відносне стандартне відхилення становить 1%. Чутливість радіохімічного методу обернено пропорційна, а це означає\((\sigma_A)_{rel}\), що ми можемо покращити чутливість, підрахувавши більше частинок.
Вибірковість рідко викликає занепокоєння при використанні радіохімічного методу, оскільки більшість зразків мають лише один радіоактивний ізотоп. Коли присутні кілька радіоактивних ізотопів, ми можемо визначити активність кожного ізотопу, скориставшись відмінностями енергій відповідних радіоактивних частинок або відмінностей у відповідних швидкостях розпаду.
У порівнянні з більшістю інших аналітичних методів, радіохімічні методи зазвичай коштують дорожче і вимагають більше часу для завершення аналізу. Радіохімічні методи також підлягають значним занепокоєнням безпеки через потенційний вплив аналітика високоенергетичним випромінюванням та необхідністю безпечної утилізації радіоактивних відходів.
