13.5: Проблеми
- Page ID
- 24831
1. Рівняння 13.2.18 показує, як [A] 0 визначається за допомогою двоточкового інтегрального методу з фіксованим часом, в якому концентрація А для реакції псевдопершого порядку
\[A+R \longrightarrow P \nonumber\]
вимірюється в рази t 1 і t 2. Вивести аналогічне рівняння для випадку, коли твір контролюється за умов псевдопершого порядку.
2. Концентрацію фенілацетату визначають з кінетики його реакції гідролізу псевдопершого порядку в етиламіновому буфері. При аналізі стандартного розчину фенілацетату 0,55 мМ концентрація фенілацетату через 60 с становить 0,17 мМ. При аналізі зразка концентрація фенілацетату, що залишається через 60 с, становить 0,23 мМ. Яка концентрація фенілацетату в зразку?
3. У присутності кислоти йодид окислюється перекисом водню
\[2 \mathrm{I}^{-}(a q)+\mathrm{H}_{2} \mathrm{O}_{2}(a q)+2 \mathrm{H}_{3} \mathrm{O}^{+}(a q) \longrightarrow 4 \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{I}_{2}(a q) \nonumber\]
Коли I - і H 3 O + присутні в надлишку, ми можемо використовувати кінетику реакції реакції, яка є псевдо-першим порядком в Н 2 О 2, для визначення концентрації Н 2 О 2, слідуючи виробленню I 2 з часом. В одному аналізі було виміряно поглинання розчину при 348 нм через 240 с, а аналіз набору стандарту дає результати, наведені нижче.
| [Н 2 О 2] (мкМ) | поглинання |
|---|---|
| 100.0 | 0,236 |
| 200,0 | 0,471 |
| 400,0 | 0.933 |
| 800,0 | 1,872 |
Яка концентрація Н 2 О 2 в зразку, якщо його поглинання становить 0,669 через 240 с?
4. Концентрацію хромової кислоти визначають шляхом її зниження в умовах, які є псевдо-першого порядку в аналіті. Одним з підходів є моніторинг поглинання реакції на довжині хвилі 355 нм. Стандарт\(5.1 \times 10^{-4}\) M хромової кислоти дає поглинання 0,855 і 0,709 через 100 с і 300 с після початку реакції. При аналізі зразка в однакових умовах поглинання складають 0,883 і 0,706. Яка концентрація хромової кислоти в зразку?
5. Мальмштадт і Пардью розробили метод змінного часу для визначення глюкози на основі її окислення ферментом глюкозоксидазою [Malmstadt, H.V.; Pardue, H.L. Anal. Хім. 1961 33, 1040—1047]. Для контролю прогресу реакції до зразків і стандартів додають йодид. Н 2 О 2, що утворюється при окисленні глюкози, вступає в реакцію з I —, утворюючи I 2 як продукт. Час, необхідний для отримання фіксованої кількості I 2, визначають спектрофотометрично. Наступні дані були повідомлені для набору стандартів калібрування
| [глюкоза] (проміле) | час (и) | ||
|---|---|---|---|
| 5.0 | 146.5 | 150.0 |
149.6 |
| 10.0 | 69.2 | 67.1 |
66.0 |
| 20.0 | 34,8 | 35.0 |
34.0 |
| 30.0 | 22.3 | 22.7 |
22.6 |
| 40.0 | 16.7 | 16.5 | 17,0 |
| 50.0 | 13,3 | 13,3 | 13,8 |
Для перевірки методу стандартний розчин глюкози 20,0 проміле аналізували так само, як і стандарти, вимагаючи 34,6 с для отримання такої ж ступеня реакції. Визначте концентрацію глюкози в стандарті і процентну похибку для аналізу.
6. Демінг і Пардю вивчали кінетику гідролізу р -нітрофенілфосфату ферментом лужної фосфатази [Демінг, С.Н.; Pardue, H. L. Хім. 1971, 43, 192—200]. Прогрес реакції контролювався шляхом вимірювання поглинання р -нітрофенолу, який є одним з продуктів реакції. Графік швидкості реакції (з одиницями мкмоль мл—1 сек-1) у порівнянні з об'ємом, V, в мілілітрах стандарту калібрування сироватки, який містив фермент, дав пряму лінію з наступним рівнянням.
\[\text { rate } = 2.7 \times 10^{-7} \mu \text{mol } \mathrm{mL}^{-1} \text{ s}^{-1}+\left(3.485 \times 10^{-5} \mu \text{mol } \mathrm{mL}^{-2} \text{ s}^{-1}\right) V \nonumber\]
Аналізують 10,00-мл зразка сироватки крові, що дає швидкість\(6.84 \times 10^{-5}\) мкмоль мл —1 сек —1. Наскільки більше розбавлений фермент у зразку сироватки крові, ніж у стандарті калібрування сироватки?
7. Наступні дані були зібрані для реакції, яка, як відомо, псевдо-першого порядку в аналіті, А, протягом часу, коли реакція контролюється.
| час (и) | [А] т (мМ) |
|---|---|
| 2 |
1.36 |
| 4 |
1.24 |
| 6 |
1.12 |
| 8 |
1.02 |
| 10 | 0,924 |
| 12 | 0,838 |
| 14 | 0,760 |
| 16 | 0.690 |
| 18 | 0.626 |
| 20 | 0.568 |
Що таке константа швидкості і початкова концентрація аналіту в зразку?
8. Фермент ацетилхолінестераза каталізує розкладання ацетилхоліну до холіну і оцтової кислоти. За заданої множини умов фермент має K\(9 \times 10^{-5}\) m M і k 2\(1.4 \times 10^4\) s —1. Яка концентрація ацетилхоліну в пробі, якщо швидкість реакції 12,33 мкм с —1 в присутності ферменту\(6.61 \times 10^{-7}\) М? Можна припустити, що концентрація ацетилхоліну значно менша, ніж K m.
9. Фермент фумараза каталізує стереоспецифічне додавання води до фумарату з утворенням l-малату. Стандартний 0,150 мкм розчин фумарази має швидкість реакції 2,00 мкм хв —1 в умовах, в яких концентрація субстрату значно перевищує К м. Швидкість реакції для зразка при ідентичному стані становить 1,15 мМ хв —1. Яка концентрація фумарази в зразку?
10. Фермент уреаза каталізує гідроліз сечовини. Швидкість цієї реакції визначається для серії розчинів, в яких концентрація сечовини змінюється при збереженні фіксованої концентрації уреази 5,0 мМ. Отримані наступні дані.
| [сечовина] (мкМ) | швидкість (мкм с —1) |
|---|---|
|
0.100 |
6.25 |
| 0,200 | 12.5 |
| 0,300 | 18.8 |
| 0,400 | 25.0 |
| 0,500 | 31.2 |
| 0.600 | 37.5 |
| 0,700 | 43.7 |
| 0,800 | 50.0 |
| 0.900 | 56.2 |
| 1.00 | 62.5 |
Визначте значення V max, k 2, і K m для уреази.
11. Для дослідження дії інгібітора ферменту V max і K m вимірюють для декількох концентрацій інгібітора. З підвищенням концентрації інгібітора V max залишається по суті постійним, але значення K m збільшується. Який механізм інгібування ферментів діє?
12. У разі конкурентного інгібування рівновага між ферментом Е, інгібітором, I та комплексом фермент—інгібітор EI описується постійною рівноваги K EI. Показати, що для конкурентного інгібування рівняння швидкості реакції
\[\frac{d[P]}{d t}=\frac{V_{\max }[S]}{K_{m}\left\{1+\left([I] / K_{E l}\right)\right\}+[S]} \nonumber\]
де K I - константа освіти для комплексу ЕІ
\[E+I \rightleftharpoons E I \nonumber\]
Можна припустити, що k 2 << k —1.
13. Аналіти А і В реагують із загальним реагентом R з кінетикою першого порядку. Якщо 99,9% A повинні реагувати до того, як 0,1% B відреагував, яке мінімально прийнятне співвідношення для відповідних констант швидкості?
14. Суміш двох аналітів, А і В, аналізується одночасно шляхом контролю їх комбінованої концентрації, C = [A] + [B], як функції часу, коли вони реагують із загальним реагентом. Відомо, що і А, і В, як відомо, слідують кінетиці першого порядку з реагентом, а А, як відомо, реагує швидше, ніж В. З огляду на дані в наступній таблиці, визначають початкові концентрації А і В, а також константи швидкості першого порядку, k A і k B.
| час (хв) | [C] (мМ) |
|---|---|
| 1 | 0,313 |
| 6 | 0,200 |
| 11 | 0.136 |
| 16 | 0.098 |
| 21 | 0.074 |
| 26 | 0,058 |
| 31 | 0,047 |
| 36 | 0,038 |
| 41 | 0,032 |
| 46 | 0,027 |
| 51 | 0,023 |
| 56 | 0,019 |
| 61 | 0,016 |
| 66 | 0,014 |
| 71 | 0,012 |
15. У таблиці 13.3.1 наведено перелік декількох ізотопів, що використовуються в якості простежувачів. Період напіврозпаду для цих ізотопів також перераховані. Яка постійна швидкість радіоактивного розпаду кожного ізотопу?
16. 60 Co - довгоживучий ізотоп (t 1/2 = 5.3 рік), який часто використовується як радіотрактор. Активність в 5,00-мл пробі розчину 60 СО становить\(2.1 \times 10^7\) розпади/сек. Яка молярна концентрація 60 Co у зразку?
17. Концентрація Ni в новому сплаві визначається аналізом нейтронної активації. Зразок сплаву 0,500-г і 1,000-г зразка стандартного сплаву, що становить 5,93% w/w Ni, опромінюються нейтронами в ядерному реакторі. Коли опромінення завершено, зразку та стандарту дозволяється охолоджувати та вимірювати їх активність гамма-променів. З огляду на, що активність становить 1020 cpm для зразка і 3540 cpm для стандарту, визначають %w/w Ni в сплаві.
18. Вміст вітаміну В 12 в полівітамінній таблетці визначається наступною процедурою. Пробу з 10 таблеток розчиняють у воді і розводять до об'єму в об'ємній колбі об'ємом 100 мл. Видаляють порцію по 50,00 мл і додають 0,500 мг радіоактивного вітаміну В 12, що має активність 572 cpm в якості трасера. Зразок і трасер гомогенізуються, а вітамін В 12 виділяють і очищують, виробляючи 18,6 мг з активністю 361 cpm. Розрахуйте міліграм вітаміну В 12 в полівітамінній таблетці.
19. Найстаріший зразок, який може датуватися 14 С, становить приблизно 30 000 рік. Який відсоток 14 С залишається після цього проміжку часу?
20. Калій-аргон датування засноване на ядерному розпаді від 40 К до 40\(1.3 \times 10^9\) Ar (t 1/2 = рік). Якщо в скелі спочатку немає 40 Ar, а якщо 40 Ar не може вирватися в атмосферу, то відносні кількості 40 K і 40 Ar можуть бути використані для визначення віку породи. При аналізі зразка гірської породи 100.0-мг виявляється, що він містить\(4.63 \times 10^{-6}\) моль 40 К і\(2.09 \times 10^{-6}\) моль 40 Ar. Скільки років зразку гірської породи?
21. Активність стаціонарного стану при 14 С в пробі становить 13 cpm на грам вуглецю. Якщо підрахунок обмежений 1 годиною, яка маса вуглецю потрібна, щоб дати відсоток відносного стандартного відхилення 1% для активності зразка? Як довго ми повинні контролювати радіоактивний розпад з 0,50-г зразка вуглецю, щоб дати відсоток відносного стандартного відхилення 1,0% для активності?
22. Для підвищення чутливості аналізу FIA ви можете зробити будь-яке з наступного: вводити більший обсяг зразка, збільшити швидкість потоку, зменшити довжину та діаметр труб колектора або об'єднати окремі канали перед введенням зразка. Для кожної дії поясніть, чому воно призводить до поліпшення чутливості.
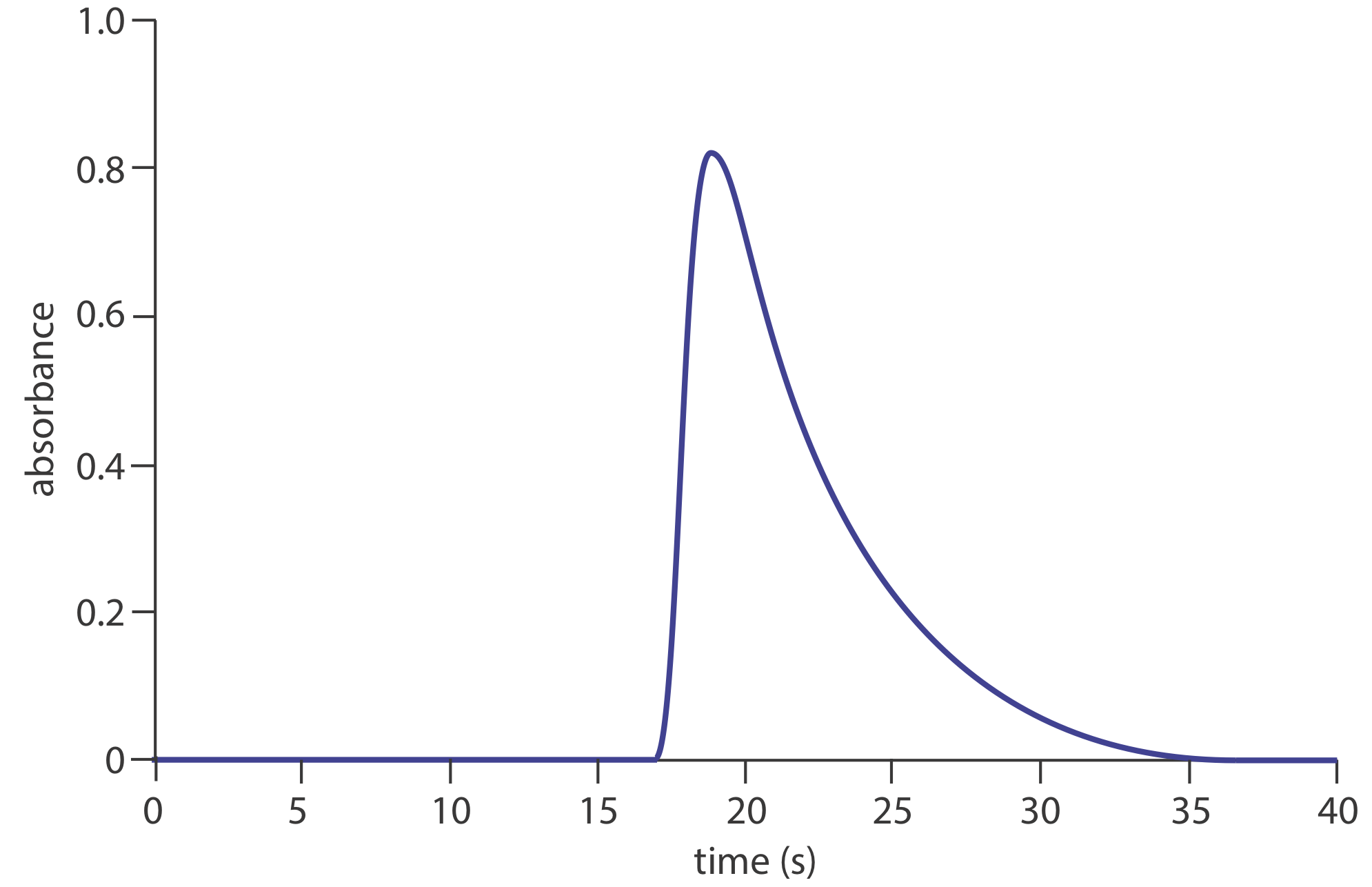
23. На малюнку нижче показана діаграма для розчину 50,0-проміле\(\text{PO}_4^{3-}\) за допомогою методу представницького методу 13.4.1. Визначте значення для h, t a, T, t ′\(\Delta t\), і T ′. Яка чутливість цього методу FIA, припускаючи лінійну залежність між поглинанням і концентрацією? Скільки зразків можна аналізувати на годину?
24. Чутливий метод проточного інжекційного аналізу Cu 2+ заснований на його здатності каталізувати окислення ді-2-піридилкетонового гідразону (ДПКХ) [Лазаро, Ф.; Luque de Castro, M.D.; Valcarcel, M. Analyst, 1984, 109, 333—337]. Продукт реакції є флуоресцентним і використовується для генерації сигналу при використанні флуориметра в якості детектора. Вихід реакції знаходиться на максимумі, коли розчин робиться основним з NaOH. Флуоресценція, однак, найбільша в присутності HCl. Намалюйте відповідний колектор FIA для цього аналізу.
25. Концентрація хлориду в морській воді визначається за допомогою аналізу нагнітання потоку. Аналіз набору калібрувальних стандартів дає наступні результати.
| [Cl —] (проміле) | поглинання | [Cl —] (проміле) | поглинання |
|---|---|---|---|
|
5.00 |
0,057 | 40.00 | 0,478 |
| 10.00 | 0.099 | 50.00 | 0.594 |
| 20.00 | 0,230 | 75.00 | 0,840 |
| 30.00 | 0,354 |
1,00-мл проба морської води поміщають в об'ємну колбу об'ємом 500 мл і розводять до об'єму дистильованою водою. При введенні в аналізатор нагнітання потоку вимірюється поглинання 0,317. Яка концентрація Cl — у зразку?
26. Рамзінг та колеги розробили метод FIA для титрування кислотно-основою з використанням потоку носія, який є\(2.0 \times 10^{-3}\) M NaOH і який містить кислотно-базовий індикатор бромотимол синій [Рамсинг, А.У.; Ruzicka, J.; Hansen, E.H. Anal. Чим. Акт 1981, 129, 1—17]. Стандартні розчини HCl вводили, а наступні значення\(\Delta t\) вимірювали з отриманих фіаграм.
| [HCl] (М) | \(\Delta t\)(и) | [HCl] (М) | \(\Delta t\)(и) |
|---|---|---|---|
| 0,008 | \ (\ Дельта t\) (s) ">3.13 | 0,080 | \ (\ Дельта t\) (s)» клас = «lt-chem-151886">
7.71 |
| 0,010 | \ (\ Дельта t\) (s) ">3.59 | 0.100 | \ (\ Дельта t\) (s)» клас = «lt-chem-151886">
8.13 |
| 0,020 | \ (\ Дельта t\) (s) ">5.11 | 0,200 | \ (\ Дельта t\) (s)» клас = «lt-chem-151886">
9.27 |
| 0,040 | \ (\ Дельта t\) (s) ">6.39 | 0,400 | \ (\ Дельта t\) (s)» клас = «lt-chem-151886">
10.45 |
| 0,060 | \ (\ Дельта t\) (s) ">7.06 | 0.600 | \ (\ Дельта t\) (s) ">11.40 |
Зразок з невідомою концентрацією HCl аналізують п'ять разів, даючи значення 7,43, 7,28, 7,41, 7,37 і 7,33 с для\(\Delta t\). Визначте концентрацію HCl в зразку.
27. Мілардовіч та його колеги використовували метод аналізу потоку ін'єкцій з амперометричним біосенсором для визначення концентрації глюкози в крові [Мілардович, С.; Крухак, І.; Івекович, Д.; Руменяк, В.; TKalcec, M.; Grabaric, Б.С. Чим. Акт 1997, 350, 91—96]. З огляду на, що зразок крові, який становить 6,93 мМ в глюкозі, має сигнал 7,13 нА, яка концентрація глюкози в зразку крові, якщо її сигнал становить 11,50 нА?
28. Фернандес-Абедул та Коста-Гарсія розробили метод FIA для визначення кокаїну в зразках за допомогою амперометричного детектора [Fernández-Абедул, М; Costa-Garcia, A. Anal. Чим. Акт 1996, 328, 67—71]. Наступні сигнали (довільні одиниці) були зібрані для 12 реплікаційних ін'єкцій\(6.2 \times 10^{-6}\) М зразка кокаїну, C 17 H 21 NO 4.
|
24.5 |
24.1 |
24.1 |
|
23.8 |
23.9 |
25.1 |
|
23.9 |
24.8 | 23.7 |
| 23,3 | 23.2 | 23.2 |
(а) Яке відносне стандартне відхилення для цього зразка?
(b) Доступні наступні дані калібрування
| [кокаїн] (мкМ) | сигнал (арб. одиниць) |
|---|---|
|
0,18 |
0.8 |
|
0,36 |
2.1 |
|
0,60 |
2.4 |
|
0,81 |
3.2 |
|
1.0 |
4.5 |
|
2.0 |
8.1 |
|
4.0 |
14.4 |
|
6.0 |
21.6 |
|
8.0 |
27.1 |
| 10.0 | 32.9 |
У типовому аналізі пробу 10,0-мг розчиняють у воді і розводять до об'єму в об'ємній колбі об'ємом 25 мл. 125-мл аліквоту переносять в об'ємну колбу об'ємом 25 мл і розбавляють до обсягу буфером рН 9. При введенні в проточний інжекторний апарат виходить сигнал 21,4 (арб. одиниць). Що таке% w/w кокаїну в зразку?
29. Холман, Крістіан та Ружицька описали метод FIA для визначення концентрації H 2 SO 4 у неводних розчинниках [Holman, D.A.; Christian, G.D.; Ruzicka, J. Anal. Хім. 1997, 69, 1763—1765. Намистини агарози діаметром 22—45 мм з індикатором зв'язаної кислотно-основи просочені NaOH і іммобілізовані в проточній комірці детектора. У потік носія вводять зразки H 2 SO 4 в n -бутанолі. Коли зразок проходить через проточну клітину, кислотно-основна реакція відбувається між H 2 SO 4 і NaOH. Кінцева точка реакції нейтралізації сигналізується зміною кольору пов'язаного індикатора і виявляється спектрофотометрично. Об'єм елюції, необхідний для досягнення кінцевої точки титрування, обернено пропорційний концентрації H 2 SO 4; таким чином, графік об'єму кінцевої точки проти [H 2 SO 4] —1 є лінійним. Наступні дані характерні для того, що отримані з використанням набору зовнішніх стандартів.
| [H 2 SO 4] (мМ) | Обсяг кінцевої точки (мл) |
|---|---|
|
0,358 |
0,266 |
|
0,436 |
0,227 |
|
0,560 |
0.176 |
|
0,752 |
0.136 |
| 1.38 | 0,075 |
| 2.98 | 0,037 |
| 5.62 | 0,017 |
Яка концентрація H 2 SO 4 в зразку, якщо його кінцевий об'єм становить 0,157 мл?
