9.2: Титрування на кислотно-основі
- Page ID
- 24860
До 1800 року більшість кислотно-лужних титрувань використовували H 2 SO 4, HCl або HNO 3 як кислотні титранти, а K 2 CO 3 або Na 2 CO 3 як основні титранти. Кінцеву точку титрування визначали за допомогою лакмусового лакмусу як індикатора, який є червоним у кислих розчинами і синім у базових розчинами, або припиненням шипучості СО 2 при нейтралізації\(\text{CO}_3^{2-}\). Ранні приклади кислотно-лужної титриметрії включають визначення кислотності або лужності розчинів і визначення чистоти карбонатів і лужноземельних оксидів.
Визначення кислотності та лужності продовжує залишатися важливим застосуванням кислотно-лужної титріметрії. Ми докладніше розглянемо ці програми пізніше в цьому розділі.
Три обмеження сповільнили розвиток кислотно-лужної титріметрії: відсутність сильного базового титранту для аналізу слабких кислот, відсутність відповідних показників та відсутність теорії кислотно-лужної реакційної здатності. Введення в 1846 р. NaOH як сильного базового титранту розширеної кислотно-лужної титриметрії для визначення слабких кислот. Синтез органічних барвників забезпечив безліч нових показників. Наприклад, фенолфталеїн був вперше синтезований Байєром в 1871 році і використовувався як індикатор для титрування кислотно-основи в 1877 році.
Незважаючи на підвищену доступність показників, відсутність теорії кислотно-лужної реактивності ускладнювало вибір індикатора. Розвиток теорії рівноваги наприкінці ХІХ століття призвів до значних покращень теоретичного розуміння кислотно-основної хімії та, у свою чергу, кислотно-лужної титриметрії. Встановлення Соренсоном шкали рН у 1909 році забезпечило суворі засоби для порівняння показників. Визначення констант дисоціації кислотно-основа дозволило обчислити теоретичну криву титрування, як окреслив Б'єррум в 1914 році. Вперше хіміки-аналітики мали раціональний метод підбору індикатора, що зробило кислотно-лужну титриметрію корисною альтернативою гравіметрії.
Криві титрування кислото—основи
В огляді цієї глави ми зазначили, що кінцева точка титрування повинна збігатися з точкою його еквівалентності. Щоб зрозуміти взаємозв'язок між кінцевою точкою титрування кислотно-основи та точкою його еквівалентності, ми повинні знати, як змінюється рН титранду під час титрування. У цьому розділі ми дізнаємося, як розрахувати криву титрування, використовуючи розрахунки рівноваги з глави 6. Ми також навчимося накидати гарне наближення будь-якої кривої титрування кислотно-основи, використовуючи обмежену кількість простих обчислень.
Титрування сильних кислот і сильних основ
Для нашої першої кривої титрування розглянемо титрування 50,0 мл 0,100 М HCl з використанням титранту 0,200 М NaOH. Коли сильна основа і сильна кислота реагують, єдиною важливою реакцією є
Хоча ми не писали реакцію\ ref {9.1} як реакцію рівноваги, вона знаходиться в рівновазі; однак, оскільки її константа рівноваги велика - вона є (K w) —1 або\(1.00 \times 10^{14}\) —ми можемо розглядати реакцію\ ref {9.1} так, ніби вона йде до завершення.
Перше завдання - обчислити обсяг NaOH, необхідний для досягнення точки еквівалентності, V екв. У точці еквівалентності ми знаємо з реакції\ ref {9.1}, що
\[\begin{aligned} \text { moles } \mathrm{HCl}=& \text { moles } \mathrm{NaOH} \\ M_{a} \times V_{a} &=M_{b} \times V_{b} \end{aligned} \nonumber\]
де індекс «a» вказує на кислоту, HCl, а індекс «b» вказує на основу, NaOH. Обсяг NaOH, необхідний для досягнення точки еквівалентності, дорівнює
\[V_{e q}=V_{b}=\frac{M_{a} V_{a}}{M_{b}}=\frac{(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})}{(0.200 \ \mathrm{M})}=25.0 \ \mathrm{mL} \nonumber\]
Перед точкою еквівалентності HCl присутній в надлишку і рН визначається концентрацією не прореагував HCl. На початку титрування розчин становить 0,100 М в HCl, що, оскільки HCl є сильною кислотою, означає рН
\[\mathrm{pH}=-\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=-\log \left[\text{HCl} \right] = -\log (0.100)=1.00 \nonumber\]
Після додавання 10,0 мл NaOH концентрація надлишку HCl становить
\[[\text{HCl}] = \frac {(\text{mol HCl})_\text{initial} - (\text{mol NaOH})_\text{added}} {\text{total volume}} = \frac {M_a V_a - M_b V_b} {V_a + V_b} \nonumber\]
\[[\mathrm{HCl}]=\frac{(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})-(0.200 \ \mathrm{M})(10.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}}=0.0500 \ \mathrm{M} \nonumber\]
а рН збільшується до 1,30.
У точці еквівалентності родимки HCl і родимки NaOH рівні. Оскільки ні кислота, ні основа не в надлишку, рН визначається дисоціацією води.
\[\begin{array}{c}{K_{w}=1.00 \times 10^{-14}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{OH}^{-}\right]=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]^{2}} \\ {\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=1.00 \times 10^{-7}}\end{array} \nonumber\]
Таким чином, рН в точці еквівалентності дорівнює 7,00.
Для об'ємів NaOH, більших за точку еквівалентності, рН визначається концентрацією надлишку ОН —. Наприклад, після додавання 30,0 мл титранту концентрація ОН — становить
\[[\text{OH}^-] = \frac {(\text{mol NaOH})_\text{added} - (\text{mol HCl})_\text{initial}} {\text{total volume}} = \frac {M_b V_b - M_a V_a} {V_a + V_b} \nonumber\]
\[\left[\mathrm{OH}^{-}\right]=\frac{(0.200 \ \mathrm{M})(30.0 \ \mathrm{mL})-(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})}{30.0 \ \mathrm{mL}+50.0 \ \mathrm{mL}}=0.0125 \ \mathrm{M} \nonumber\]
Для знаходження концентрації H 3 O + використовуємо вираз K w
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{K_{\mathrm{w}}}{\left[\mathrm{OH}^{-}\right]}=\frac{1.00 \times 10^{-14}}{0.0125}=8.00 \times 10^{-13} \ \mathrm{M} \nonumber\]
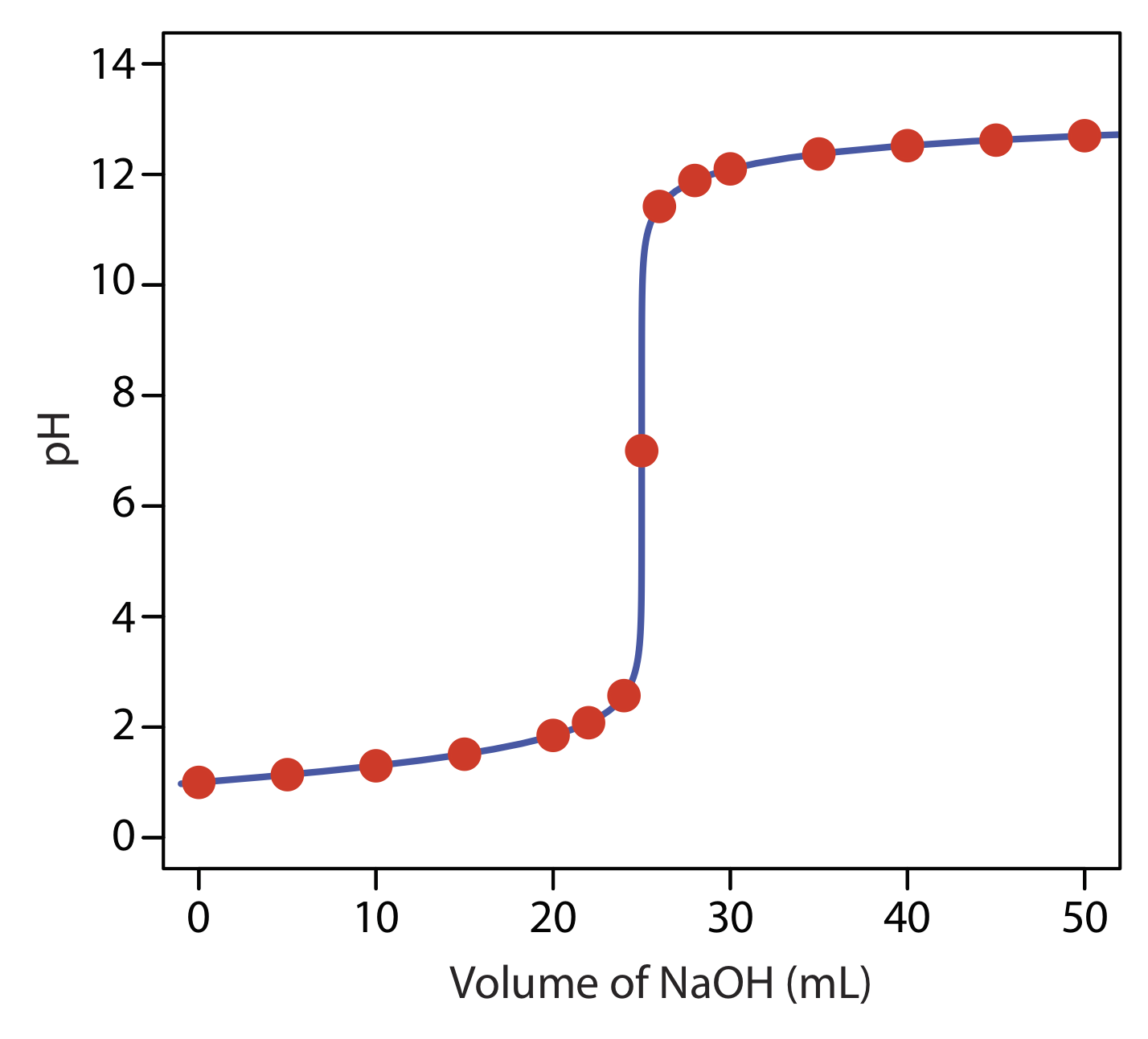
виявити, що рН дорівнює 12,10. Таблиця Template:index та рисунок Template:index показують додаткові результати для цієї кривої титрування. Ви можете використовувати цей самий підхід для розрахунку кривої титрування для титрування сильної основи сильною кислотою, за винятком того, що сильна основа знаходиться в надлишку до точки еквівалентності, а сильна кислота в надлишку після точки еквівалентності.
| обсяг NaOH (мл) | рН | обсяг NaOH (мл) | рН |
|---|---|---|---|
| 0.00 | 1.00 | 26.0 | 11.42 |
| 5.00 | 1.14 | 28.0 | 11.89 |
| 10.0 | 1.30 | 30.0 | 12.10 |
| 15,0 | 1.51 | 35.0 | 12.37 |
| 20.0 | 1,85 | 40.0 | 12.52 |
| 22.0 | 2.08 | 45.0 | 12.63 |
| 24.0 | 2.57 | 50.0 | 12.70 |
| 25.0 | 7.00 |
Побудувати криву титрування для титрування 25,0 мл 0,125 М NaOH з 0,0625 M HCl.
- Відповідь
-
Обсяг HCl, необхідний для досягнення точки еквівалентності, становить
\[V_{e q}=V_{a}=\frac{M_{b} V_{b}}{M_{a}}=\frac{(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})}{(0.0625 \ \mathrm{M})}=50.0 \ \mathrm{mL} \nonumber\]
Перед точкою еквівалентності NaOH присутній в надлишку і рН визначається концентрацією не прореагував ОН —. Наприклад, після додавання 10,0 мл HCl
\[\begin{array}{c}{\left[\mathrm{OH}^{-}\right]=\frac{(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})-(0.0625 \mathrm{M})(10.0 \ \mathrm{mL})}{25.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}}=0.0714 \ \mathrm{M}} \\ {\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{K_{w}}{\left[\mathrm{OH}^{-}\right]}=\frac{1.00 \times 10^{-14}}{0.0714 \ \mathrm{M}}=1.40 \times 10^{-13} \ \mathrm{M}}\end{array} \nonumber\]
рН - 12,85.
Для титрування сильної основи сильною кислотою рН в точці еквівалентності дорівнює 7,00.
Для обсягів HCl, більших за точку еквівалентності, рН визначається концентрацією надлишку HCl. Наприклад, після додавання 70,0 мл титранту концентрація HCl становить
\[[\mathrm{HCl}]=\frac{(0.0625 \ \mathrm{M})(70.0 \ \mathrm{mL})-(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})}{70.0 \ \mathrm{mL}+25.0 \ \mathrm{mL}}=0.0132 \ \mathrm{M} \nonumber\]
даючи рН 1,88. Деякі додаткові результати наведені тут.
обсяг HCl (мл) рН обсяг HCl (мл) рН 0 13.10 60 2.13 10 12.85 70 1.88 20 12.62 80 1.75 30 12.36 90 1.66 40 11.98 100 1.60 50 7.00
Титрування слабкої кислоти з сильною основою
Для цього прикладу розглянемо титрування 50,0 мл 0,100 М оцтової кислоти, СН 3 СООН, з 0,200 М NaOH. Знову ж таки, ми починаємо з обчислення обсягу NaOH, необхідного для досягнення точки еквівалентності; таким чином
\[\operatorname{mol} \ \mathrm{CH}_{3} \mathrm{COOH}=\mathrm{mol} \ \mathrm{NaOH} \nonumber\]
\[M_{a} \times V_{a}=M_{b} \times V_{b} \nonumber\]
\[V_{e q}=V_{b}=\frac{M_{a} V_{a}}{M_{b}}=\frac{(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})}{(0.200 \ \mathrm{M})}=25.0 \ \mathrm{mL} \nonumber\]
Перш ніж ми почнемо титрування рН, що для розчину 0,100 М оцтової кислоти. Оскільки оцтова кислота є слабкою кислотою, обчислюємо рН методом, викладеним у главі 6
\[\mathrm{CH}_{3} \mathrm{COOH}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons\mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{CH}_{3} \mathrm{COO}^{-}(a q) \nonumber\]
\[K_{a}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{COO}^-\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]}=\frac{(x)(x)}{0.100-x}=1.75 \times 10^{-5} \nonumber\]
виявивши, що рН дорівнює 2,88.
Додавання NaOH перетворює частину оцтової кислоти в її кон'югатну основу, CH 3 COO -.
Оскільки константа рівноваги для реакції\ ref {9.2} досить велика
\[K=K_{\mathrm{a}} / K_{\mathrm{w}}=1.75 \times 10^{9} \nonumber\]
ми можемо ставитися до реакції так, ніби вона йде до завершення.
Будь-який розчин, який містить порівнянну кількість слабкої кислоти, ГК, і її кон'югату слабку основу, А —, є буфером. Як ми дізналися в главі 6, ми можемо обчислити рН буфера за допомогою рівняння Хендерсона — Хассельбальха.
\[\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+\log \frac{\left[\mathrm{A}^{-}\right]}{[\mathrm{HA}]} \nonumber\]
До точки еквівалентності концентрація не прореагувала оцтової кислоти становить
\[\left[\text{CH}_3\text{COOH}\right] = \frac {(\text{mol CH}_3\text{COOH})_\text{initial} - (\text{mol NaOH})_\text{added}} {\text{total volume}} = \frac {M_a V_a - M_b V_b} {V_a + V_b} \nonumber\]
а концентрація ацетату становить
\[[\text{CH}_3\text{COO}^-] = \frac {(\text{mol NaOH})_\text{added}} {\text{total volume}} = \frac {M_b V_b} {V_a + V_b} \nonumber\]
Наприклад, після додавання 10,0 мл NaOH концентрації CH 3 COOH і CH 3 COO — складають
\[\left[\mathrm{CH}_{3} \mathrm{COOH}\right]=\frac{(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})-(0.200 \ \mathrm{M})(10.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}} = 0.0500 \text{ M} \nonumber\]
\[\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]=\frac{(0.200 \ \mathrm{M})(10.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}}=0.0333 \ \mathrm{M} \nonumber\]
що дає нам рН
\[\mathrm{pH}=4.76+\log \frac{0.0333 \ \mathrm{M}}{0.0500 \ \mathrm{M}}=4.58 \nonumber\]
У точці еквівалентності спочатку присутні родимки оцтової кислоти та додані родимки NaOH ідентичні. Оскільки їх реакція ефективно протікає до завершення, переважаючим іоном у розчині є CH 3 COO —, який є слабкою основою. Для розрахунку рН спочатку визначаємо концентрацію CH 3 COO —
\[\left[\mathrm{CH}_{3} \mathrm{COO}^-\right]=\frac{(\mathrm{mol} \ \mathrm{NaOH})_{\mathrm{added}}}{\text { total volume }}= \frac{(0.200 \ \mathrm{M})(25.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+25.0 \ \mathrm{mL}}=0.0667 \ \mathrm{M} \nonumber\]
Крім того, ми можемо розрахувати концентрацію ацетату, використовуючи початкові молі оцтової кислоти; таким чином
\[\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]=\frac{\left(\mathrm{mol} \ \mathrm{CH}_{3} \mathrm{COOH}\right)_{\mathrm{initial}}}{\text { total volume }} = \frac{(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+25.0 \ \mathrm{mL}} = 0.0667 \text{ M} \nonumber\]
Далі обчислюємо рН слабкої основи, як показано раніше в главі 6
\[\mathrm{CH}_{3} \mathrm{COO}^{-}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons\mathrm{OH}^{-}(a q)+\mathrm{CH}_{3} \mathrm{COOH}(a q) \nonumber\]
\[K_{\mathrm{b}}=\frac{\left[\mathrm{OH}^{-}\right]\left[\mathrm{CH}_{3} \mathrm{COOH}\right]}{\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]}=\frac{(x)(x)}{0.0667-x}=5.71 \times 10^{-10} \nonumber\]
\[x=\left[\mathrm{OH}^{-}\right]=6.17 \times 10^{-6} \ \mathrm{M} \nonumber\]
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{K_{\mathrm{w}}}{\left[\mathrm{OH}^{-}\right]}=\frac{1.00 \times 10^{-14}}{6.17 \times 10^{-6}}=1.62 \times 10^{-9} \ \mathrm{M} \nonumber\]
знаходячи, що рН в точці еквівалентності дорівнює 8,79.
Після точки еквівалентності титрант знаходиться в надлишку і титрующей сумішшю є розведений розчин NaOH. Ми можемо розрахувати рН, використовуючи ту ж стратегію, що і при титруванні сильної кислоти з сильною основою. Наприклад, після додавання 30,0 мл NaOH концентрація ОН — становить
\[\left[\mathrm{OH}^{-}\right]=\frac{(0.200 \ \mathrm{M})(30.0 \ \mathrm{mL})-(0.100 \ \mathrm{M})(50.0 \ \mathrm{mL})}{30.0 \ \mathrm{mL}+50.0 \ \mathrm{mL}}=0.0125 \ \mathrm{M} \nonumber\]
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{K_{\mathrm{w}}}{\left[\mathrm{OH}^{-}\right]}=\frac{1.00 \times 10^{-14}}{0.0125}=8.00 \times 10^{-13} \ \mathrm{M} \nonumber\]
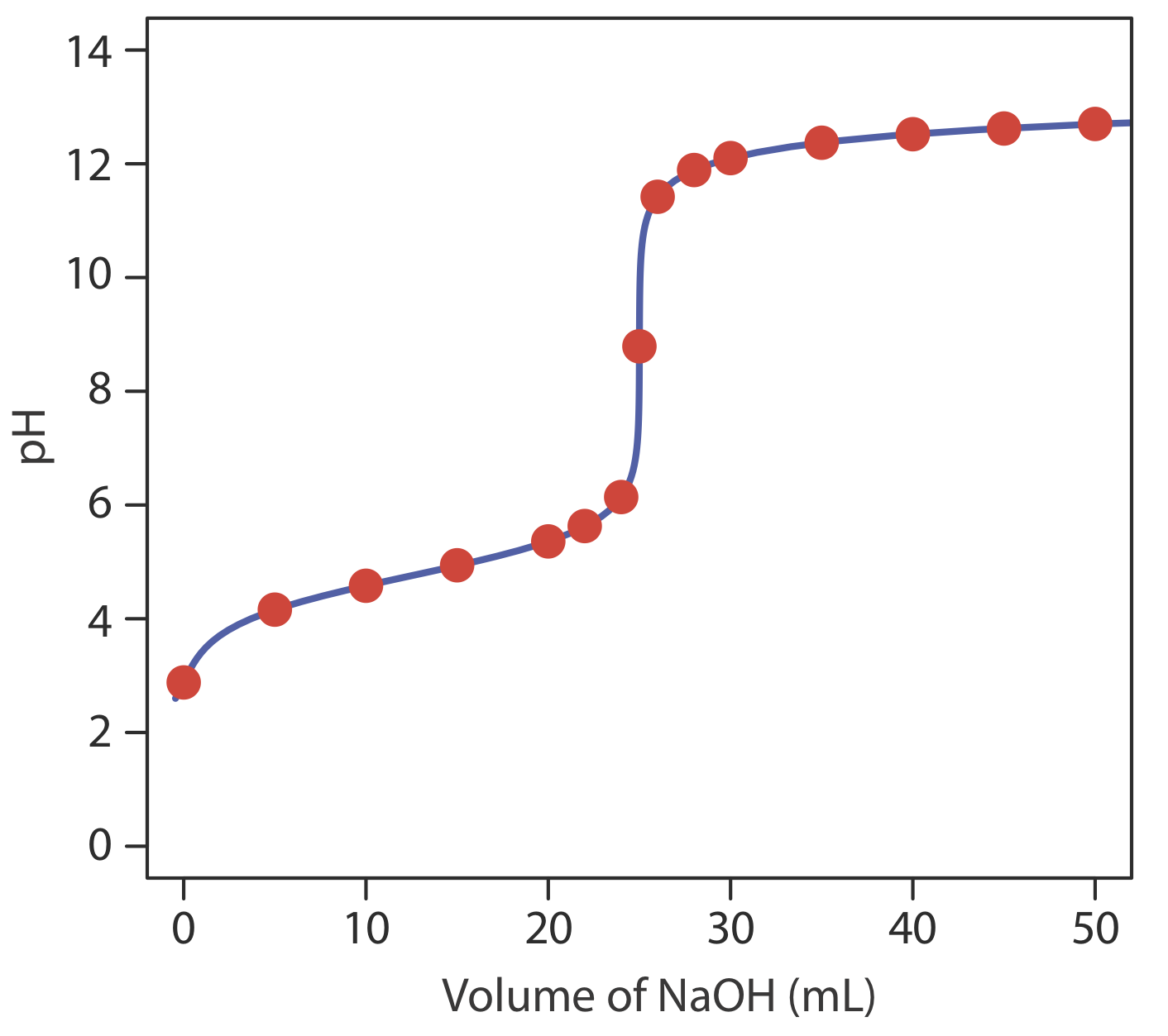
даючи рН 12,10. Таблиця Template:index та рисунок Template:index показують додаткові результати для цього титрування. Ви можете використовувати цей же підхід для розрахунку кривої титрування для титрування слабкої основи сильною кислотою, за винятком того, що початковий рН визначається слабкою основою, рН в точці еквівалентності - її кон'югатной слабкою кислотою, а рН після точки еквівалентності надлишком сильної кислоти.
| обсяг HCl (мл) | рН | обсяг HCl (мл) | рН |
|---|---|---|---|
| 0.00 | 2.88 | 26.0 | 11.43 |
| 5.00 | 4.16 | 28.0 | 11.89 |
| 10.0 | 4.58 | 30.0 | 12.10 |
| 15,0 | 4.94 | 35.0 | 12.37 |
| 20.0 | 5.36 | 40.0 | 12.52 |
| 22.0 | 5.63 | 45.0 | 12.63 |
| 24.0 | 6.14 | 50.0 | 12.70 |
| 25.0 | 8.79 |
Побудувати криву титрування для титрування 25,0 мл 0,125 М NH 3 з 0,0625 M HCl.
- Відповідь
-
Обсяг HCl, необхідний для досягнення точки еквівалентності, становить
\[V_{a q}=V_{a}=\frac{M_{b} V_{b}}{M_{a}}=\frac{(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})}{(0.0625 \ \mathrm{M})}=50.0 \ \mathrm{mL} \nonumber\]
Перед додаванням HCl рН полягає в тому, що для розчину 0,100 М NH 3.
\[K_{\mathrm{b}}=\frac{[\mathrm{OH}^-]\left[\mathrm{NH}_{4}^{+}\right]}{\left[\mathrm{NH}_{3}\right]}=\frac{(x)(x)}{0.125-x}=1.75 \times 10^{-5} \nonumber\]
\[x=\left[\mathrm{OH}^{-}\right]=1.48 \times 10^{-3} \ \mathrm{M} \nonumber\]
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{K_{\mathrm{w}}}{[\mathrm{OH}^-]}=\frac{1.00 \times 10^{-14}}{1.48 \times 10^{-3} \ \mathrm{M}}=6.76 \times 10^{-12} \ \mathrm{M} \nonumber\]
Значення рН на початку титрування, отже, становить 11,17.
Перед точкою еквівалентності рН визначається\(\text{NH}_3/\text{NH}_4^+\) буфером. Наприклад, після додавання 10,0 мл HCl
\[\left[\mathrm{NH}_{3}\right]=\frac{(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})-(0.0625 \ \mathrm{M})(10.0 \ \mathrm{mL})}{25.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}}=0.0714 \ \mathrm{M} \nonumber\]
\[\left[\mathrm{NH}_{4}^{+}\right]=\frac{(0.0625 \ \mathrm{M})(10.0 \ \mathrm{mL})}{25.0 \ \mathrm{mL}+10.0 \ \mathrm{mL}}=0.0179 \ \mathrm{M} \nonumber\]
\[\mathrm{pH}=9.244+\log \frac{0.0714 \ \mathrm{M}}{0.0179 \ \mathrm{M}}=9.84 \nonumber\]
У точці еквівалентності переважаючий іон у розчині є\(\text{NH}_4^+\). Для розрахунку рН спочатку визначаємо концентрацію\(\text{NH}_4^+\)
\[\left[\mathrm{NH}_{4}^{+}\right]=\frac{(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})}{25.0 \ \mathrm{mL}+50.0 \ \mathrm{mL}}=0.0417 \ \mathrm{M} \nonumber\]
а потім розрахувати рН
\[K_{\mathrm{a}}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{NH}_{3}\right]}{\left[\mathrm{NH}_{4}^{+}\right]}=\frac{(x)(x)}{0.0417-x}=5.70 \times 10^{-10} \nonumber\]
отримання значення 5,31.
Після точки еквівалентності рН визначається надлишком HCl. Наприклад, після додавання 70,0 мл HCl
\[[\mathrm{HCl}]=\frac{(0.0625 \ \mathrm{M})(70.0 \ \mathrm{mL})-(0.125 \ \mathrm{M})(25.0 \ \mathrm{mL})}{70.0 \ \mathrm{mL}+25.0 \ \mathrm{mL}}=0.0132 \ \mathrm{M} \nonumber\]
а рН становить 1,88. Деякі додаткові результати наведені тут.
обсяг HCl (мл) рН обсяг HCl (мл) рН 0 11.17 60 2.13 10 9.84 70 1.88 20 9.42 80 1.75 30 9.07 90 1.66 40 8.64 100 1.60 50 5.31
Ми можемо розширити цей підхід для розрахунку кривої титрування слабкої кислотно-сильної основи на реакції, які включають мультипротові кислоти або основи, а також суміші кислот або підстав. Однак зі збільшенням складності титрування необхідні розрахунки стають більш трудомісткими. Не дивно, що різноманітні алгебраїчні та електронні табличні підходи доступні для допомоги у побудові кривих титрування.
У наступних роботах представлена інформація про алгебраїчні підходи до обчислення кривих титрування: (a) Willis, C JJ Chem. Едук. 1981, 58, 659—663; (б) Накагава, К.Дж. Едук. 1990, 67, 673—676; (с) Гордус, А.А. Едук. 1991, 68, 759—761; (d) де Леві, Р.Дж. Едук. 1993, 70, 209—217; (е) Частон, С.Дж. Едук. 1993, 70, 878—880; (ф) де Леві, Р. анал. Хім. 1996, 68, 585—590.
Наступні статті надають інформацію про використання електронних таблиць для генерації кривих титрування: (а) Currie, J.O.; Whiteley, R.V.J. Chem. Едук. 1991, 68, 923—926; (б) Бренеман, Г.Л.; Паркер, О.Дж. Чем. Едук. 1992, 69, 46—47; (с) Картер, Д. Р.; Фрай, М.С.; Маттсон, В.А. Едук. 1993, 70, 67—71; (d) Фрайзер, H. Концепції та розрахунки в аналітичній хімії, CRC Преса: Бока-Ратон, 1992.
Ескіз кривої титрування «Кислота — основа»
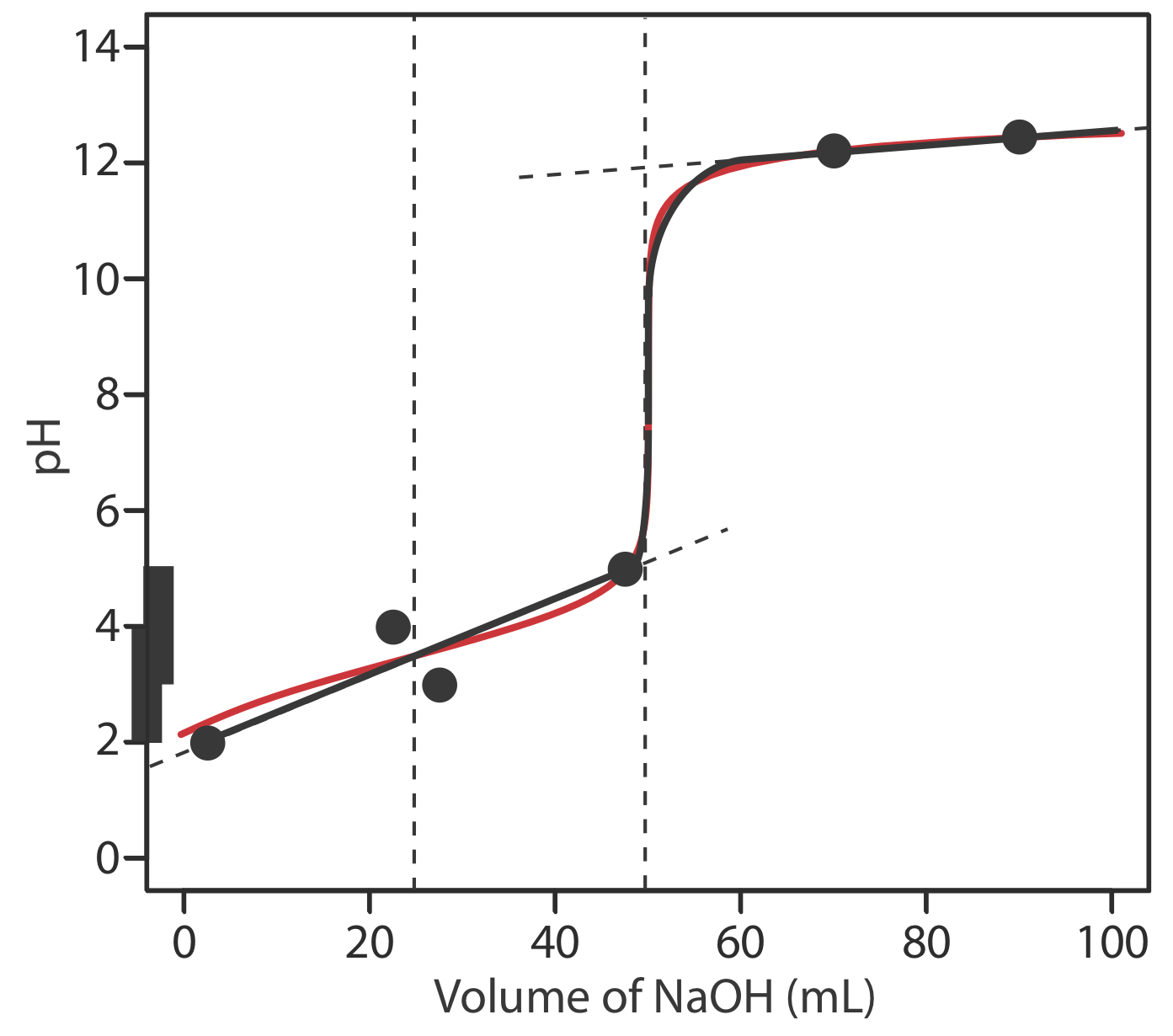
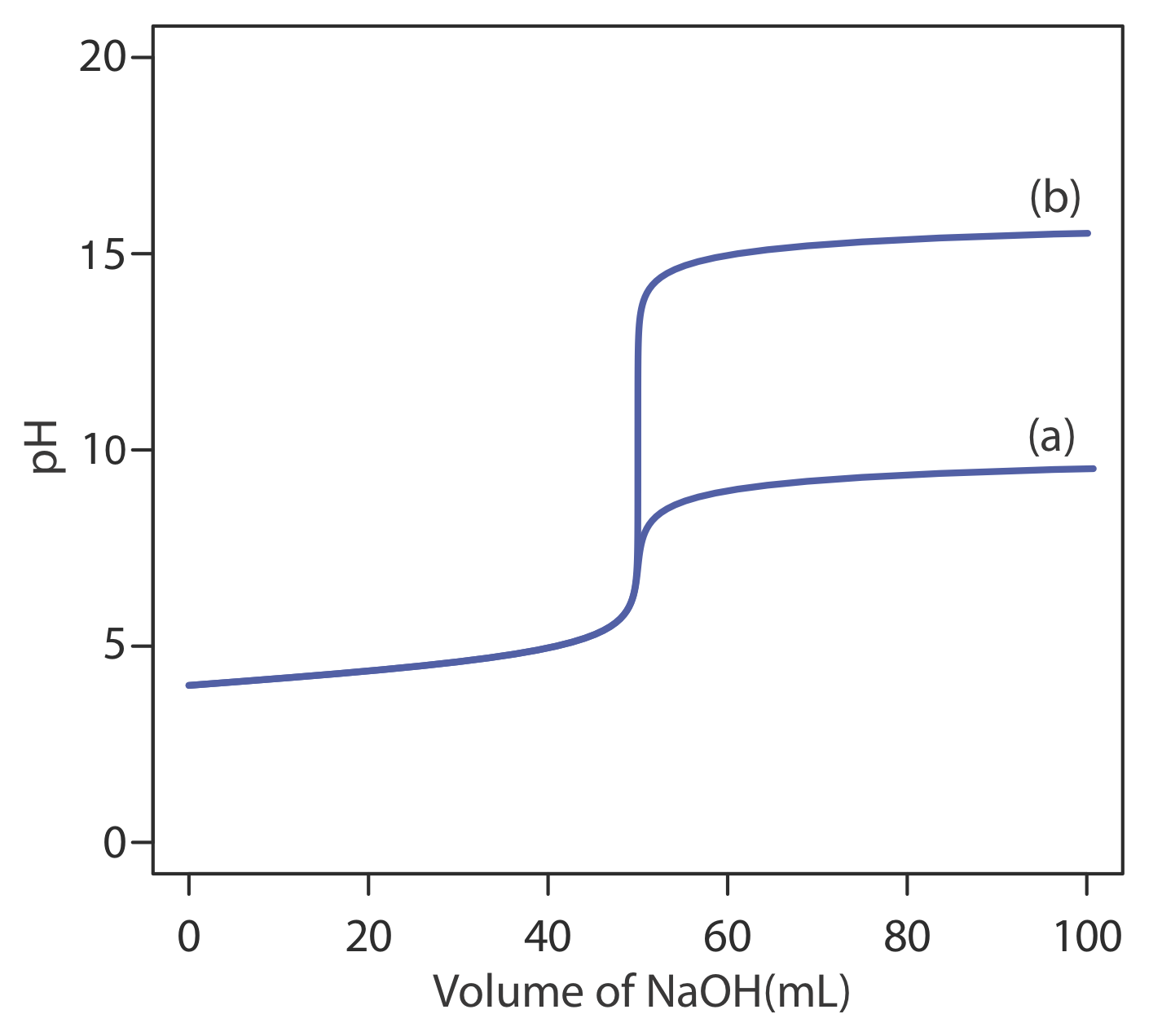
Для оцінки співвідношення між точкою еквівалентності титрування та її кінцевою точкою потрібно побудувати лише розумне наближення точної кривої титрування. У цьому розділі ми продемонструємо простий метод накреслення кривої титрування кислотно-основи. Наша мета - швидко намалювати криву титрування, використовуючи якомога менше розрахунків. Давайте використаємо титрування 50,0 мл 0.100 M CH 3 COOH з 0.200 M NaOH, щоб проілюструвати наш підхід. Це той самий приклад, який ми використовували для розробки розрахунків кривої титрування слабкої кислотно-сильної основи. Ви можете переглянути результати цього розрахунку у таблиці Template:index та на рисунку Template:index.
Почнемо з розрахунку об'єму точки еквівалентності титрування, який, як ми визначили раніше, становить 25,0 мл. Далі ми малюємо наші осі, розміщуючи pH на осі y і об'єм титранта на осі x. Для позначення обсягу точки еквівалентності проводимо вертикальну лінію, яка перетинає вісь x на 25,0 мл NaOH. Рисунок Template:index a показує перший крок нашого ескізу.
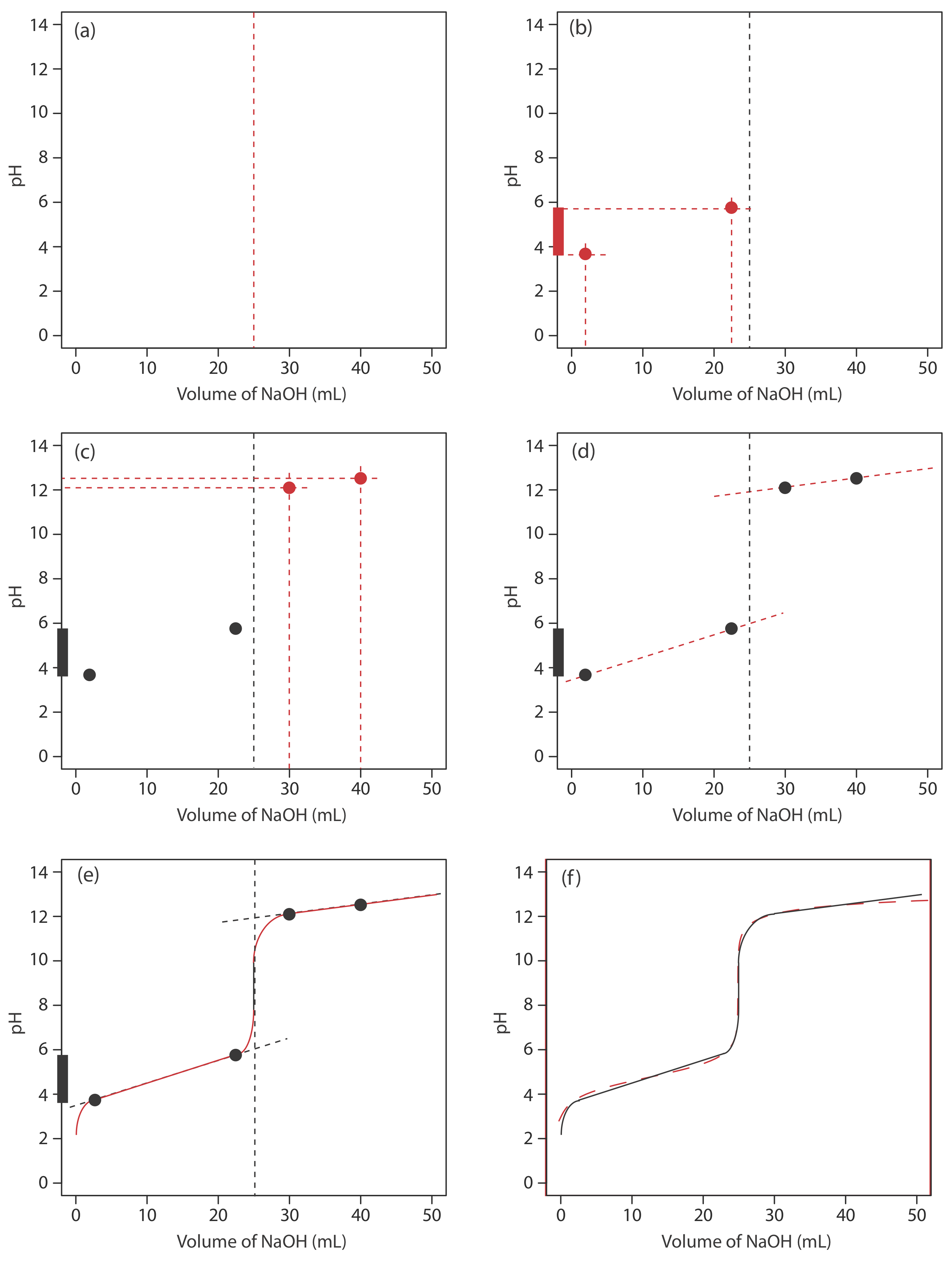
Перед точкою еквівалентності рН титранду визначають буфером оцтової кислоти СН 3 СООН та ацетату, CH 3 COO —. Хоча ми можемо обчислити рН буфера за допомогою рівняння Хендерсона - Хассельбальха, ми можемо уникнути цього розрахунку, зробивши просте припущення. Ви можете згадати з глави 6, що буфер працює в діапазоні рН, який поширюється приблизно ± 1 одиниця рН по обидва боки від значення p K слабкої кислоти. РН знаходиться в нижньому кінці цього діапазону, рН = p K a — 1, коли концентрація слабкої кислоти\(10 \times\) більше, ніж концентрація її кон'югатної слабкої основи. Буфер досягає верхньої межі рН, рН = p K a + 1, коли концентрація слабкої кислоти\(10 \times\) менша, ніж концентрація її кон'югатної слабкої основи. Коли ми титруємо слабку кислоту або слабку основу, буфер охоплює діапазон обсягів від приблизно 10% об'єму точки еквівалентності до приблизно 90% об'єму точки еквівалентності.
Фактичні значення - 9,09% і 90,9%, але для нашої мети використовувати 10% і 90% зручніше; тобто, врешті-решт, одна перевага наближення!
На малюнку Template:index b показано другий крок нашого ескізу. Спочатку накладаємо сходову діаграму оцтової кислоти на вісь y, включаючи її буферний діапазон, використовуючи її p K значення 4,76. Далі ми додаємо дві точки, одну для рН на 10% об'єму точки еквівалентності (рН 3,76 при 2,5 мл) і одну для рН при 90% об'єму точки еквівалентності (рН 5,76 при 22,5 мл).
Третій крок - додати дві точки після точки еквівалентності. РН після точки еквівалентності фіксується концентрацією надлишкового титранту, NaOH. Розрахувати рН міцної основи нескладно, як ми бачили раніше. Рисунок Template:index c містить точки (див. Таблицю Template:index) для значення рН після додавання 30,0 мл та після додавання 40,0 мл NaOH.
Далі проводимо пряму лінію через кожну пару точок, протягуючи кожну лінію через вертикальну лінію, яка представляє об'єм точки еквівалентності (Рисунок Template:index d). Нарешті, ми завершуємо наш ескіз, намалювавши плавну криву, яка з'єднує три прямолінійні відрізки (Рисунок Template:index e). Порівняння нашого ескізу з точною кривою титрування (Рисунок Template:index f) показує, що вони знаходяться в тісній згоді.
Намалюйте криву титрування для титрування 25,0 мл 0,125 М NH 3 з 0,0625 M HCl та порівняйте з результатом вправи Template:index.
- Відповідь
-
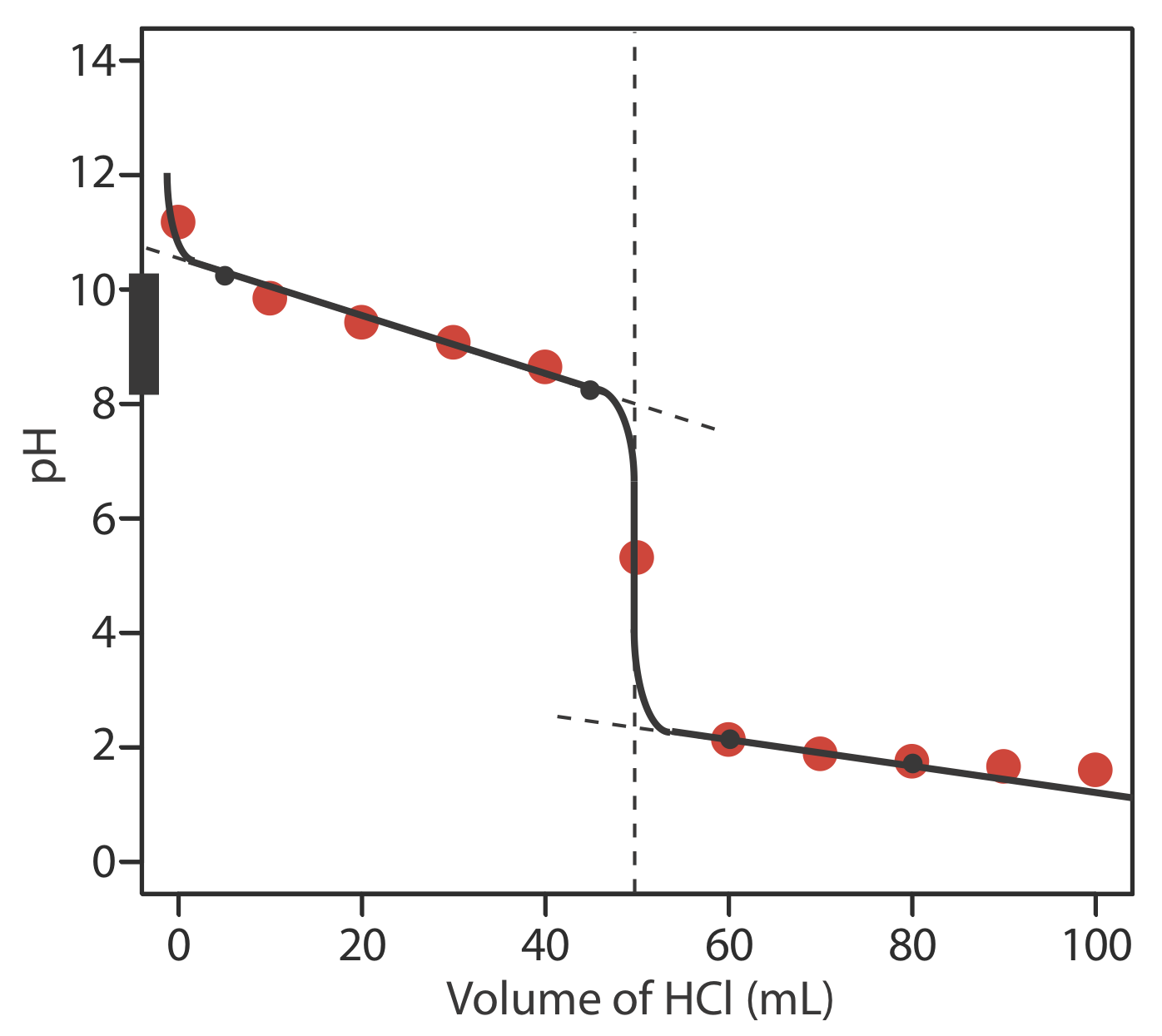
На малюнку нижче показаний ескіз кривої титрування. Чорні точки і крива є приблизним ескізом кривої титрування. Точки червоного кольору - це обчислення з вправи Template:index. Дві чорні точки перед точкою еквівалентності (V HCl = 5 мл, рН = 10,24 і V HCl = 45 мл, рН = 8,24) наносяться за допомогою p K a 9,244 для\(\text{NH}_4^+\). Дві чорні точки після точки еквівалентності (V HCl = 60 мл, рН = 2,13 і V HCl = 80 мл, рН = 1,75) є від відповіді на Вправа Template:index.
Як показано в наступному прикладі, ми можемо адаптувати цей підхід до будь-якого кислотно-лужного титрування, включаючи ті, де точні розрахунки є більш складними, включаючи титрування поліпротових слабких кислот і підстав, а також титрування сумішей слабких кислот або слабких підстав.
Ескізні криві титрування для наступних двох систем: (а) титрування 50,0 мл 0,050 М Н 2 А, дипротової слабкої кислоти з p K a1 3 і p K a2 7; і (б) титрування 50,0 мл суміші, що містить 0,075 М ГА, слабку кислоту з р К а 3, і 0,025 М НВ, слабка кислота з р К а 7. Для обох титрувань припустимо, що титрант дорівнює 0,10 М NaOH.
Рішення
Рисунок Template:index a показує криву титрування для H 2 A, включаючи діаграму сходів для H 2 A на осі y, дві точки еквівалентності на 25,0 мл і 50,0 мл, дві точки перед кожною точкою еквівалентності, дві точки після останньої точки еквівалентності, і прямі лінії, що використовуються для ескізу остаточної кривої титрування. Перед першою точкою еквівалентності рН контролюється буфером H 2 A і HA —. Буфер HA — /A 2— контролює рН між двома точками еквівалентності. Після другої точки еквівалентності рН відображає концентрацію надлишку NaOH.
На малюнку Template:index b показана крива титрування суміші HA та HB. Знову ж таки, є дві точки еквівалентності; однак у цьому випадку точки еквівалентності не однаково розташовані, оскільки концентрація ГК більша, ніж у HB. Оскільки ГК є сильнішою з двох слабких кислот, вона реагує першою; таким чином, рН перед першою точкою еквівалентності контролюється буфером HA та A -. Між двома точками еквівалентності рН відображає титрування НВ і визначається буфером НВ і В —. Після другої точки еквівалентності надлишок NaOH визначає рН.
Намалюйте криву титрування для 50,0 мл 0,050 M H 2 A, дипротової слабкої кислоти з p K a1 3 та p K a2 4, використовуючи 0.100 M NaOH як титрант. Той факт, що p K a2 потрапляє в буферний діапазон p K a1 представляє виклик, який вам потрібно буде розглянути.
- Відповідь
-
На малюнку нижче показаний ескіз кривої титрування. Крива титрування має дві точки еквівалентності: одна при 25,0 мл\((\text{H}_2\text{A} \rightarrow \text{HA}^-)\) і одна при 50,0 мл (\(\text{HA}^- \rightarrow \text{A}^{2-}\)). При замальовуванні кривої ми будуємо дві точки перед першою точкою еквівалентності, використовуючи p K a1 з 3 для H 2 A
\[V_{\mathrm{HCl}}=2.5 \ \mathrm{mL}, \mathrm{pH}=2 \text { and } V_{\mathrm{HCl}}=22.5 \ \mathrm{mL}, \mathrm{pH}=4 \nonumber\]
дві точки між точками еквівалентності з використанням p K a2 з 5 для HA —
\[V_{\mathrm{HCl}}=27.5 \ \mathrm{mL}, \mathrm{pH}=3, \text { and } V_{\mathrm{HCl}}=47.5 \ \mathrm{mL}, \mathrm{pH}=5 \nonumber\]
і дві точки після другої точки еквівалентності
\[V_{\mathrm{HCl}}=70 \ \mathrm{mL}, \mathrm{pH}=12.22 \text { and } V_{\mathrm{HCl}}=90 \ \mathrm{mL}, \mathrm{pH}=12.46 \nonumber\]
Проведення плавної кривої через ці точки представляє нам наступну дилему - рН, здається, збільшується, коли об'єм титранта наближається до першої точки еквівалентності, а потім, здається, зменшується, коли він проходить через першу точку еквівалентності. Це, звичайно, абсурдно; оскільки ми додаємо NaOH, рН не може знижуватися. Замість цього ми моделюємо криву титрування перед другою точкою еквівалентності шляхом проведення прямої лінії від першої точки (V HCl = 2,5 мл, рН = 2) до четвертої точки (V HCl = 47,5 мл, рН = 5), ігноруючи другу і третю точки. Результати є розумним наближенням точної кривої титрування.
Вибір та оцінка кінцевої точки
Раніше ми зробили важливу різницю між кінцевою точкою титрування та точкою її еквівалентності. Різниця між цими двома термінами важлива і заслуговує на повторення. Точка еквівалентності, яка виникає, коли ми реагуємо стехіометрично рівні кількості аналіту та титранту, є теоретичним, а не експериментальним значенням. Кінцева точка титрування - це експериментальний результат, який представляє нашу найкращу оцінку точки еквівалентності. Будь-яка різниця між точкою еквівалентності титрування та відповідною кінцевою точкою є джерелом визначальної помилки.
Де знаходиться точка еквівалентності?
Раніше ми дізналися, як розрахувати рН в точці еквівалентності для титрування сильної кислоти з міцною основою, і для титрування слабкої кислоти з міцною основою. Ми також навчилися малювати криву титрування лише з мінімумом розрахунків. Чи можемо ми також знайти точку еквівалентності, не виконуючи жодних розрахунків. Відповідь, як ви могли здогадатися, часто так!
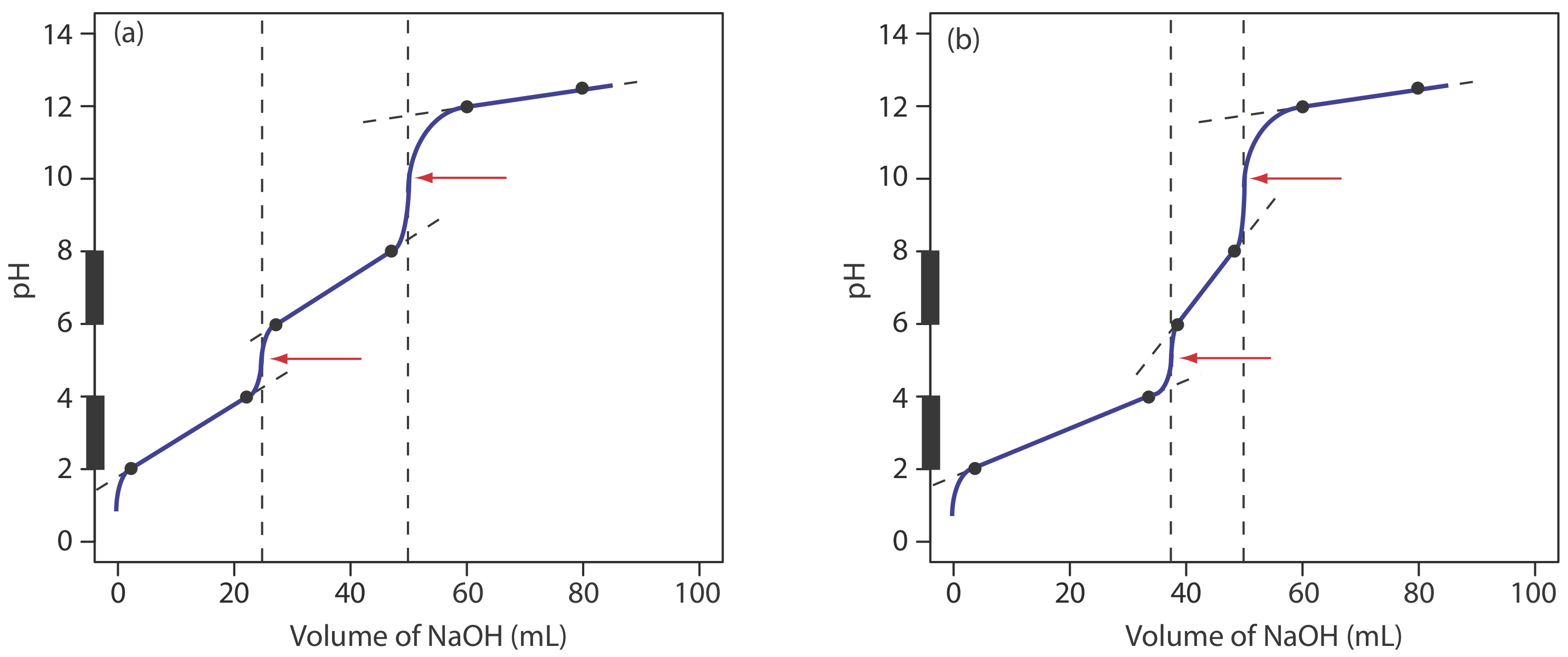
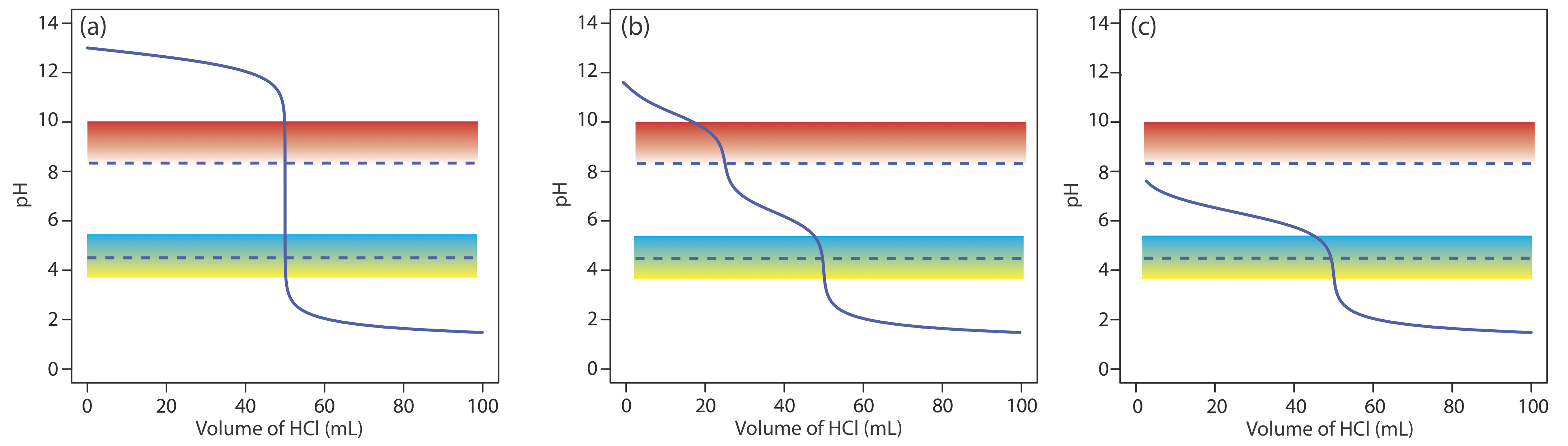
Для більшості кислотно-базових титрувань точка перегину - точка на кривій титрування, яка має найбільший нахил - дуже майже збігається з точкою еквівалентності титрування. Червоні стрілки на малюнку Template:index, наприклад, визначають точки еквівалентності кривих титрування у прикладі Template:index. Точка перегину фактично передує відповідній точці еквівалентності невеликою кількістю, при цьому похибка наближається до 0,1% для слабких кислот і слабких підстав з константами дисоціації меншими за 10 —9, або для дуже розбавлених розчинів [Meites, L.; Goldman, J.A. Anal. Чим. Акт 1963, с. 29, 472—479].
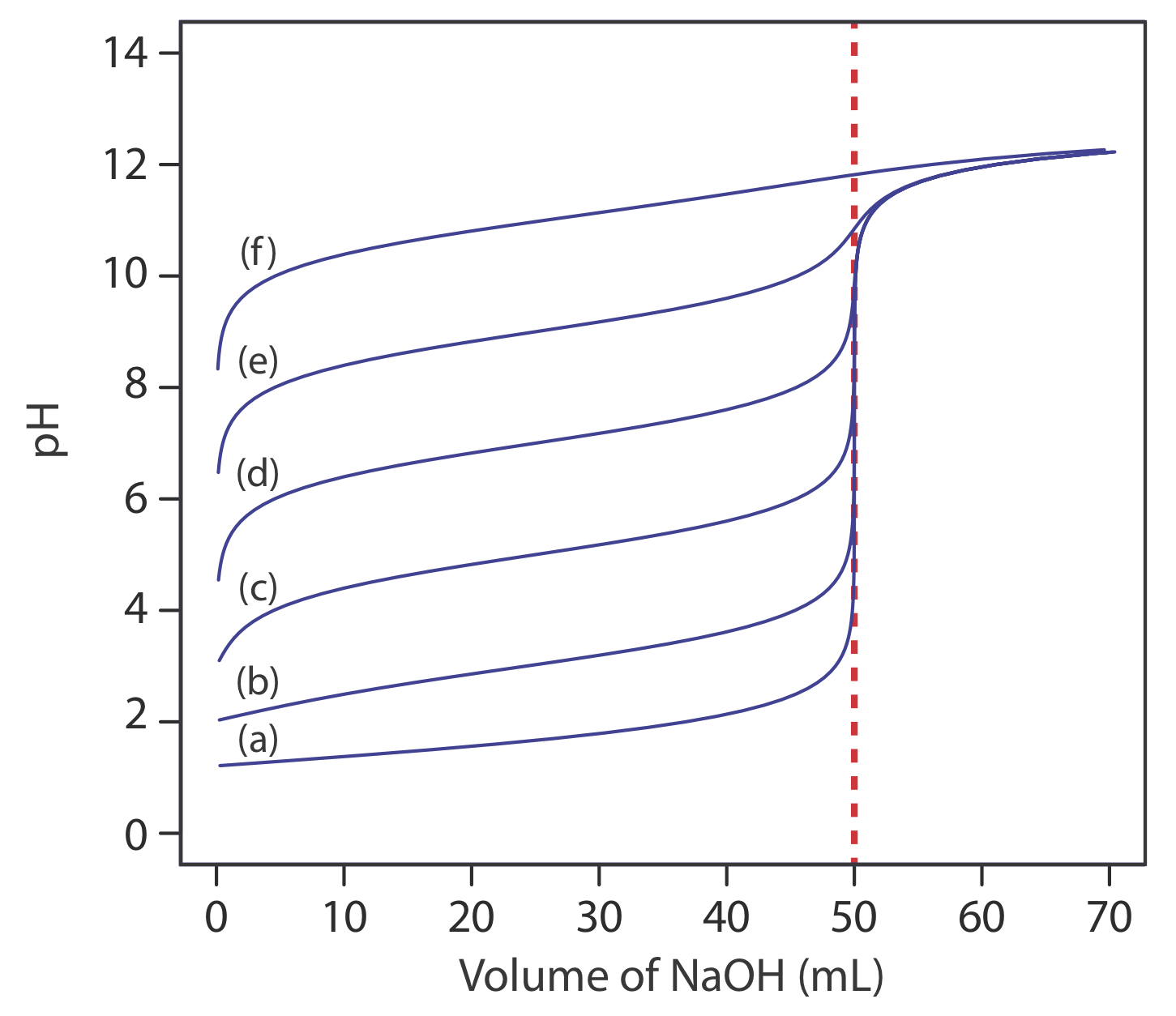
Основне обмеження точки перегину полягає в тому, що вона повинна бути присутнім і легко ідентифікуватися. Для деяких титрувань точка перегину відсутня або її важко знайти. Рисунок Template:index, наприклад, демонструє вплив константи дисоціації слабкої кислоти, K a, на форму кривої титрування. Точка перегину видно, навіть якщо ледве так, для констант дисоціації кислоти більше 10 —9, але відсутня, коли K a дорівнює 10 —11.
Точка перегину також може бути відсутнім або важко зрозуміти, чи є аналіт мультипротонной слабкою кислотою або слабкою основою з послідовними константами дисоціації, які схожі за величиною. Щоб оцінити, чому це правда, давайте розглянемо титрування дипротової слабкої кислоти, H 2 A, з NaOH. Під час титрування відбуваються дві наступні реакції.
Щоб побачити дві різні точки перегину, реакція\ ref {9.3} повинна бути повною перед початком реакції\ ref {9.4}.
Рисунок Template:index показує криві титрування для трьох діпротових слабких кислот. Крива титрування для малеїнової кислоти, для якої K a1 приблизно\(20000 \times\) більше K a2, має дві чіткі точки перегину. Малонова кислота, з іншого боку, має константи дисоціації кислоти, які відрізняються приблизно в 690 разів. Хоча крива титрування малонової кислоти показує дві точки перегину, перша не настільки різна, як друга. Нарешті, крива титрування бурштинової кислоти, для якої два значення K a відрізняються лише коефіцієнтом\(27 \times\), має лише одну точку перегину, яка відповідає нейтралізації\(\text{HC}_2\text{H}_4\text{O}_4^-\) до\(\text{C}_2\text{H}_4\text{O}_4^{2-}\). Загалом, ми можемо виявити окремі точки перегину, коли послідовні константи дисоціації кислоти відрізняються в рази не менше 500 (а\(\Delta\) К а не менше 2,7).
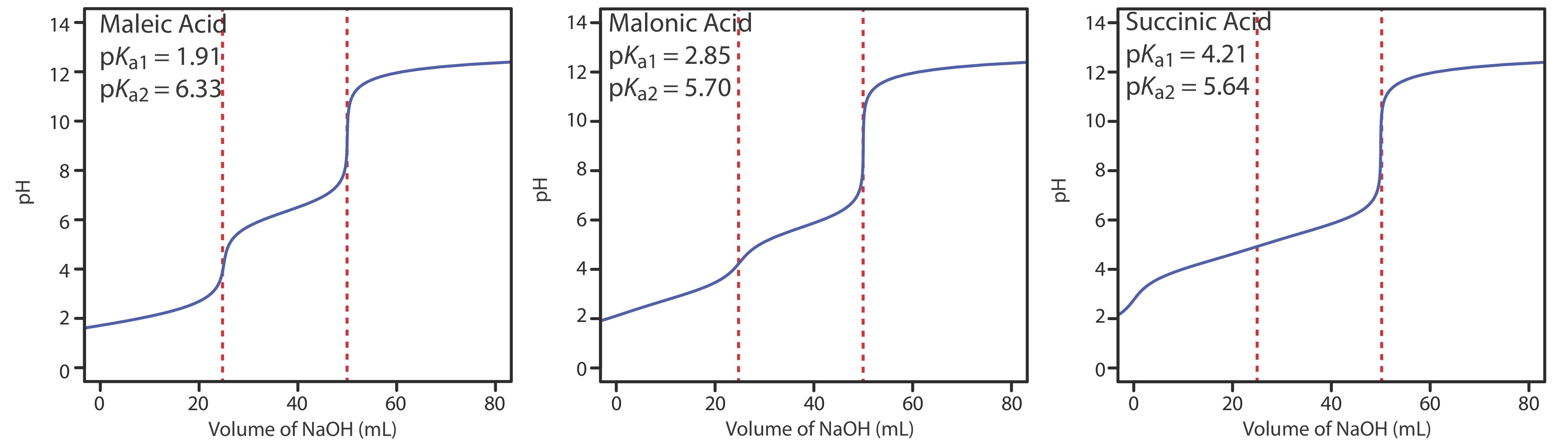
Те ж саме стосується сумішей слабких кислот або сумішей слабких підстав. Для виявлення окремих точок перегину при титруванні суміші слабких кислот їх значення р К а повинні відрізнятися як мінімум в 500 разів.
Пошук кінцевої точки за допомогою індикатора
Однією цікавою групою слабких кислот і слабких підстав є органічні барвники. Оскільки органічний барвник має принаймні один високо забарвлений вид кон'югатної кислоти - основи, його титрування призводить до зміни як його рН, так і кольору. Ми можемо використовувати цю зміну кольору для позначення кінцевої точки титрування за умови, що вона відбувається в точці еквівалентності титрування або поблизу неї.
Як приклад розглянемо показник, для якого кислотна форма, HiN, жовта, а базова форма, In —, червона. Колір розчину індикатора залежить від відносних концентрацій HiN і In —. Щоб зрозуміти взаємозв'язок між рН і кольором, ми використовуємо реакцію дисоціації кислоти індикатора.
\[\mathrm{HIn}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}(a q)+\operatorname{In}^{-}(a q) \nonumber\]
і постійне вираження її рівноваги.
Беручи негативний журнал кожної сторони рівняння\ ref {9.5} та перестановка для розв'язання pH залишає нам рівняння, яке пов'язує рН розчину з відносними концентраціями HiN та In —.
\[\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+\log \frac{[\mathrm{In}^-]}{[\mathrm{HIn}]} \label{9.6}\]
Якщо ми можемо виявити HiN і In — з однаковою легкістю, то перехід від жовтого до червоного (або від червоного до жовтого) досягає своєї середньої точки, яка є помаранчевою, коли концентрації HiN і In — рівні, або коли рН дорівнює показнику p K a. Якщо показник p K a і рН в точці еквівалентності ідентичні, то титрування до тих пір, поки індикатор не стане помаранчевим, є підходящою кінцевою точкою. На жаль, ми рідко знаємо точний рН в точці еквівалентності. Крім того, визначити, коли концентрації HiN і In — рівні, важко, якщо зміна кольору індикатора є незначною.
Ми можемо встановити діапазон рН, в якому середній аналітик спостерігає зміну кольору індикатора, зробивши два припущення: що колір індикатора жовтий, якщо концентрація HiN\(10 \times\) більша за концентрацію In - і що його колір червоний, якщо концентрація HiN дорівнює \(10 \times\)менший, ніж у In —. Підставляємо ці нерівності в рівняння\ ref {9.6}
\[\begin{array}{l}{\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+\log \frac{1}{10}=\mathrm{p} K_{\mathrm{a}}-1} \\ {\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+\log \frac{10}{1}=\mathrm{p} K_{\mathrm{a}}+1}\end{array} \nonumber\]
показує, що індикатор змінює колір у діапазоні рН, який поширюється на ± 1 одиницю по обидва боки його p K a. Як показано на малюнку Template:index, показник жовто-низький, коли рН менше p K a — 1, і червоний, коли рН більше p K a + 1. Для значень рН між p K a — 1 і p K a + 1 колір індикатора проходить через різні відтінки оранжевого. Властивості кількох загальних кислотно-базових показників наведено в таблиці Template:index.

| показник | кислотний колір | базовий колір | діапазон рН | р К а |
|---|---|---|---|---|
| крезол червоний | червоний | жовтий | 0,2—1,8 | — |
| тимол синій | червоний | жовтий | 1.2—2.8 | 1.7 |
| бромотимол синій | жовтий | синій | 3.0—4.6 | 4.1 |
| метиловий апельсин | червоний | жовтий | 3.4—4.4 | 3.7 |
| Конго червоний | синій | червоний | 3.0—5.0 | — |
| бромокрезол зелений | жовтий | синій | 3,8—5,4 | 4.7 |
| метиловий червоний | червоний | жовтий | 4.2—6.3 | 5.0 |
| бромокрезол фіолетовий | жовтий | фіолетовий | 5.2—6.8 | 6.1 |
| лакмус | червоний | синій | 5.0—8.0 | — |
| бромотимол синій | жовтий | синій | 6.0—7.6 | 7.1 |
| фенол червоний | жовтий | синій | 6.8—8.4 | 7.8 |
| крезол червоний | жовтий | червоний | 7.2—8.8 | 8.2 |
| тимол синій | жовтий | червоний | 8.0—9.6 | 8.9 |
| фенолфталеїн | безбарвна | червоний | 8.3—10.0 | 9.6 |
| алізарин жовтий R | жовтий | оранжево-червоний | 10.1—12.0 | — |
Ви можете задатися питанням, чому діапазон рН індикатора, наприклад, для фенолфталеїну, не рівномірно розподіляється навколо його p K значення. Пояснення просте. Figure Template:index представляє ідеалізоване уявлення, в якому наша чутливість до двох кольорів індикатора дорівнює. За деякими показниками забарвлюється тільки слабка кислота або слабка основа. За іншими показниками забарвлюється і слабка кислота, і слабка основа, але одну форму легше помітити. У будь-якому випадку діапазон рН індикатора перекошується в напрямку менш кольорової форми індикатора. Таким чином, діапазон pH фенолфталеїну перекошується у напрямку його безбарвної форми, зміщуючи діапазон рН до значень нижче, ніж запропоновані Figure Template:index.
Відносно широкий діапазон рН, над яким індикатор змінює колір, накладає додаткові обмеження на його здатність сигналізувати кінцеву точку титрування. Щоб мінімізувати детермінантну похибку титрування, весь діапазон рН індикатора повинен потрапляти в межах швидкої зміни рН поблизу точки еквівалентності. Наприклад, на малюнку Template:index ми бачимо, що фенолфталеїн є відповідним показником для титрування 50,0 мл 0,050 М оцтової кислоти з 0,10 М NaOH. Бромотимоловий синій, з іншого боку, є недоречним показником, оскільки його зміна кольору починається задовго до початкового різкого підвищення рН, і, як наслідок, охоплює відносно великий діапазон обсягів. Рання зміна кольору збільшує ймовірність отримання неточного результату, а діапазон можливих обсягів кінцевих точок збільшує ймовірність отримання неточних результатів.
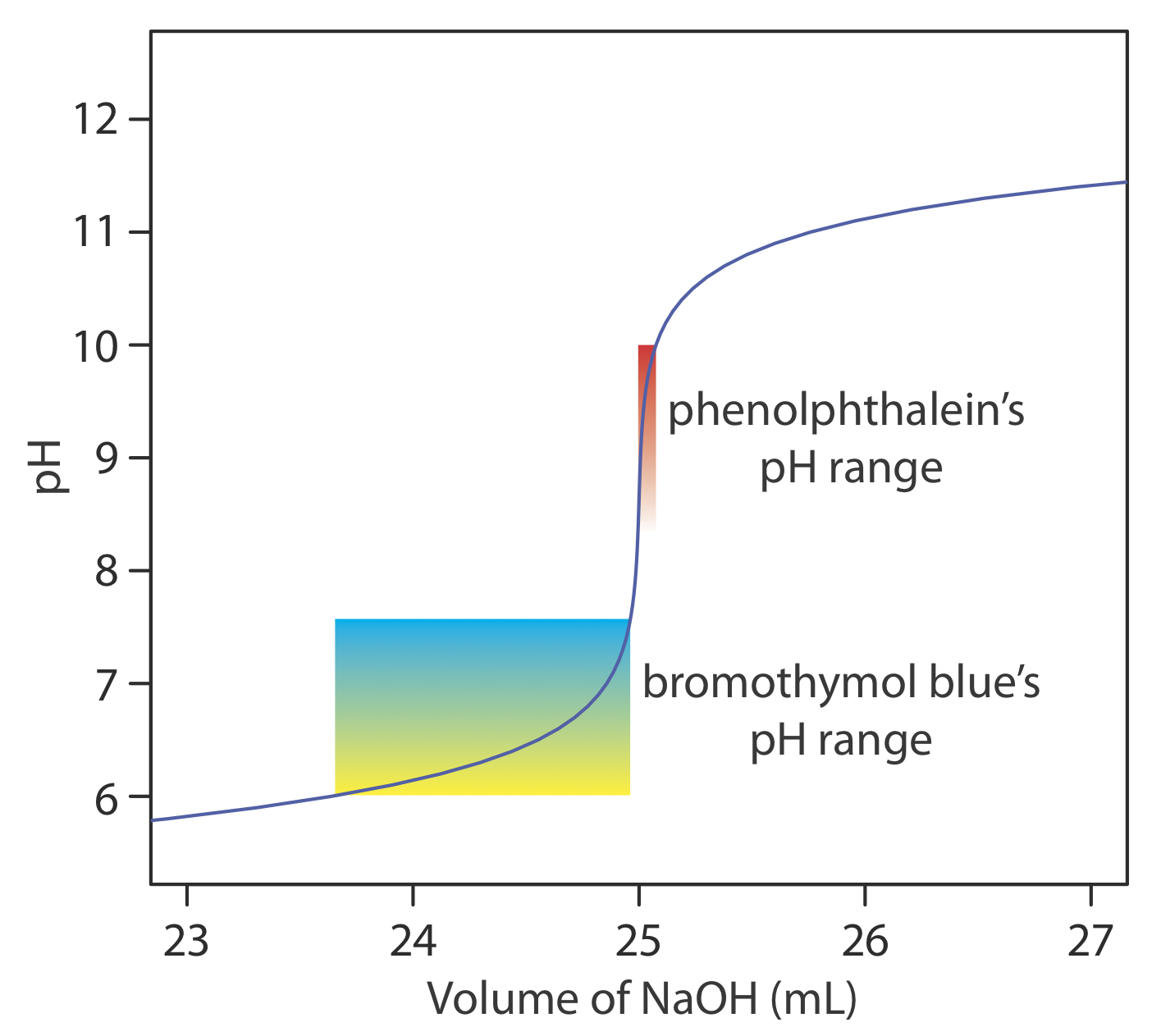
Запропонуйте відповідний показник для титрування 25,0 мл 0,125 М NH 3 з 0,0625 М NaOH. Ви створили криву титрування для цього титрування за допомогою вправи Template:index та вправи Template:index.
- Відповідь
-
РН у точці еквівалентності становить 5,31 (див. Вправа Template:Index), а гостра частина кривої титрування простягається від рН приблизно 7 до рН приблизно 4. З показників у таблиці Template:index метиловий червоний є найкращим вибором, оскільки його p K значення 5,0 є найближчим до рН точки еквівалентності і тому, що діапазон рН 4,2-6,3 для його зміни кольору не призведе до значної помилки титрування.
Пошук кінцевої точки шляхом моніторингу рН
Альтернативним підходом до визначення кінцевої точки титрування є моніторинг прогресу титрування за допомогою датчика, сигнал якого є функцією концентрації аналіта. Результатом є графік всієї кривої титрування, який ми можемо використовувати, щоб знайти кінцеву точку з мінімальною похибкою.
Електрод pH є очевидним датчиком для контролю кислотно-основного титрування, і результатом є потенціометрична крива титрування. Наприклад, на малюнку Template:index a показана невелика частина потенціометричної кривої титрування для титрування 50,0 мл 0,050 M CH 3 COOH з 0,10 M NaOH, яка фокусується на області, що містить точку еквівалентності. Найпростіший метод пошуку кінцевої точки - знайти точку перегину кривої титрування, яку показує стрілка. Це також найменш точний метод, особливо якщо крива титрування має невеликий нахил у точці еквівалентності.
Докладніше про електроди pH див. розділ 11.
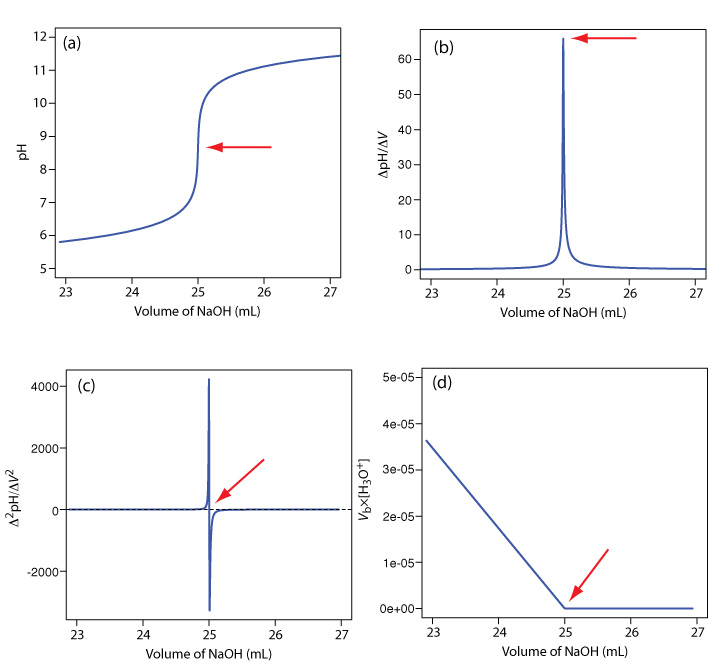
Рисунок Template:index. Криві титрування для титрування 50,0 мл 0,050 М CH 3 COOH з 0,10 М NaOH: (а) нормальна крива титрування; (б) перша похідна крива титрування; (c) друга похідна крива титрування; (d) графік Гран. Червоні стрілки показують розташування кінцевої точки кожного титрування.
Іншим методом розташування кінцевої точки є побудова першої похідної кривої титрування, яка дає її нахил в кожній точці вздовж осі x. Вивчіть Рисунок Template:index a і розгляньте, як змінюється нахил кривої титрування, коли ми наближаємось, досягаємо та передаємо точку еквівалентності. Оскільки нахил досягає свого максимального значення в точці перегину, перша похідна показує шип у точці еквівалентності (Рисунок {{Template.index (ID:9)} b). Друга похідна кривої титрування може бути більш корисною, ніж перша похідна, оскільки точка еквівалентності перетинає вісь об'єму. Рисунок {{Template.index (ID:9)}} c показує результуючу криву титрування.
Припустимо, у нас є наступні три точки на нашій кривій титрування:
| Обсяг (мл) | рН |
| 23.65 | 6.00 |
| 23.91 | 6.10 |
| 24.13 | 6.20 |
Математично ми можемо наблизити першу похідну як\(\Delta \text{pH} / \Delta V\), де\(\Delta \text{pH}\) зміна рН між послідовними додаваннями титранту. Використовуючи перші два пункти, перша похідна
\[\frac{\Delta \mathrm{pH}}{\Delta V}=\frac{6.10-6.00}{23.91-23.65}=0.385 \nonumber\]
який ми віднесемо до середнього з двох обсягів, або 23,78 мл. Для другого і третього пунктів перша похідна дорівнює 0,455, а середній обсяг - 24,02 мл.
| Обсяг (мл) | \(\Delta \text{pH}\) |
| 23.78 | 0,385 |
| 24.02 | 0,455 |
Ми можемо наблизити другу похідну як\(\Delta (\Delta \text{pH} / \Delta V) / \Delta V\), або\(\Delta^2 \text{pH} / \Delta V^2\). Використовуючи дві точки з нашого обчислення першої похідної, друга похідна
\[\frac{\Delta^{2} \mathrm{p} \mathrm{H}}{\Delta V^{2}}=\frac{0.455-0.385}{24.02-23.78}=0.292 \nonumber\]
який ми віднесемо до середнього з двох обсягів, або 23,90 мл. Відзначимо, що обчислення першої похідної відбувається за рахунок втрати однієї частини інформації (три точки стають двома точками), а розрахунок другої похідної відбувається за рахунок втрати двох фрагментів інформації.
Похідні методи особливо корисні при титруванні зразка, який містить більше одного аналіту. Якщо ми покладаємося на показники, щоб знайти кінцеві точки, то ми зазвичай повинні виконати окремі титрування для кожного аналіту, щоб ми могли побачити зміну кольору для кожної кінцевої точки. Однак якщо ми запишемо криву титрування, то достатньо одного титрування. Точність, з якою ми можемо знайти кінцеву точку, також робить похідні методи привабливими для аналіту, який має погано визначену нормальну криву титрування.
Похідні методи добре працюють тільки в тому випадку, якщо ми фіксуємо достатню кількість даних під час швидкого збільшення рН поблизу точки еквівалентності. Зазвичай це не є проблемою, якщо ми використовуємо автоматичний титратор, такий як той, який бачив раніше на малюнку 9.1.5. Оскільки рН змінюється так швидко поблизу точки еквівалентності - зміна декількох одиниць рН протягом декількох крапель титранту не є незвичайною - ручне титрування не дає достатньої кількості даних для корисної похідної кривої титрування. Ручне титрування містить велику кількість даних під час більш м'яко зростаючих частин кривої титрування до і після точки еквівалентності. Ці дані також містять інформацію про точку еквівалентності кривої титрування.
Розглянемо ще раз титрування оцтової кислоти, СН 3 СООН, з NaOH. У будь-який момент під час титрування оцтова кислота знаходиться в рівновазі з Н 3 О + і СН 3 СОО —
\[\mathrm{CH}_{3} \mathrm{COOH}(a q)+\mathrm{H}_{2} \mathrm{O}(l )\rightleftharpoons\mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{CH}_{3} \mathrm{COO}^{-}(a q) \nonumber\]
для яких постійна рівноваги
\[K_{a}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]} \nonumber\]
До точки еквівалентності концентрації CH 3 COOH і CH 3 COO — складають
\[[\text{CH}_3\text{COOH}] = \frac {(\text{mol CH}_3\text{COOH})_\text{initial} - (\text{mol NaOH})_\text{added}} {\text{total volume}} = \frac {M_a V_a - M_b V_b} {V_a + V_b} \nonumber\]
\[[\text{CH}_3\text{COO}^-] = \frac {(\text{mol NaOH})_\text{added}} {\text{total volume}} = \frac {M_b V_b} {V_a + V_b} \nonumber\]
Підставляючи ці рівняння в вираз K а і переставляючи, ми залишаємо
\[K_{\mathrm{a}}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left(M_{b} V_{b}\right) /\left(V_{a}+V_{b}\right)}{\left\{M_{a} V_{a}-M_{b} V_{b}\right\} /\left(V_{a}+V_{b}\right)} \nonumber\]
\[K_{a} M_{a} V_{a}-K_{a} M_{b} V_{b}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left(M_{b} V_{b}\right) \nonumber\]
\[\frac{K_{a} M_{a} V_{a}}{M_{b}}-K_{a} V_{b}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] V_{b} \nonumber\]
Нарешті, визнаючи, що об'єм точки еквівалентності
\[V_{eq}=\frac{M_{a} V_{a}}{M_{b}} \nonumber\]
залишає нам наступне рівняння.
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] \times V_{b}=K_{\mathrm{a}} V_{eq}-K_{\mathrm{a}} V_{b} \nonumber\]
Для об'ємів титранту перед точкою еквівалентності ділянка\(V_b \times [\text{H}_3\text{O}^+]\) проти V b є прямою лінією з x -перехопленням V eq та нахилом — K a. Рисунок Template:index d показує типовий результат. Цей метод аналізу даних, який перетворює частину кривої титрування в пряму, є графіком Гран.
Значення K a, визначені цим методом, можуть мати істотну похибку, якщо ефект активності ігнорується. Див. Розділ 6.9 для обговорення діяльності.
Пошук кінцевої точки шляхом моніторингу температури
Реакція між кислотою і основою екзотермічна. Тепло, що утворюється в результаті реакції, поглинається титрандом, що підвищує його температуру. Моніторинг температури титранду при додаванні титранту надає нам інший метод запису кривої титрування та визначення кінцевої точки титрування (Рисунок Template:index).
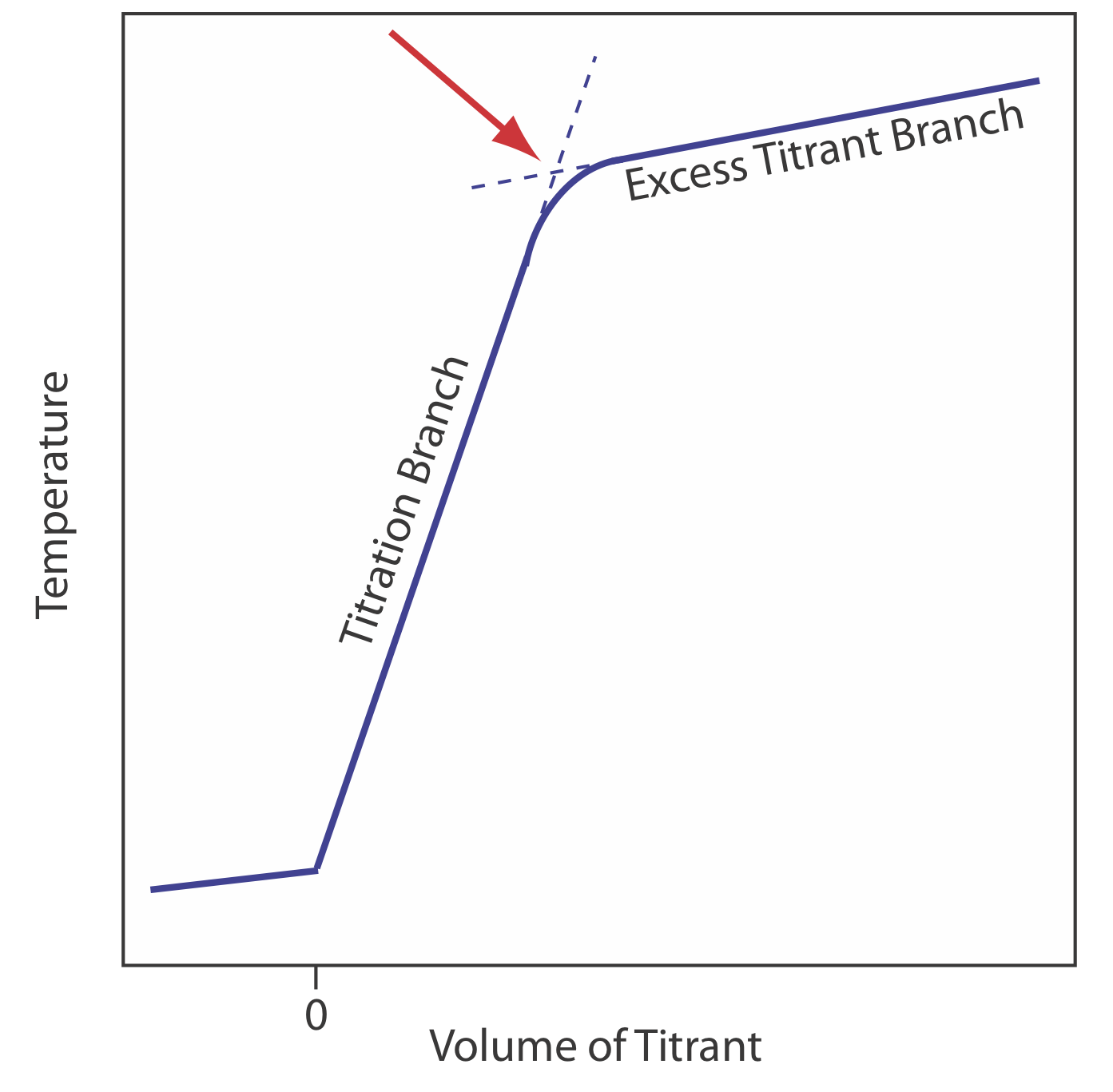
Перш ніж додати титрант, будь-яка зміна температури титранду є результатом потепління або охолодження, оскільки вона врівноважує навколишнє середовище. Додавання титранту ініціює реакцію екзотермічної кислота-основа і підвищує температуру титранду. Ця частина термометричної кривої титрування називається гілкою титрування. Температура продовжує підвищуватися з кожним додаванням титранту, поки ми не досягнемо точки еквівалентності. Після точки еквівалентності будь-яка зміна температури обумовлена ентальпією розведення титранта та різницею між температурами титранту та титранду. В ідеалі точка еквівалентності є чітким перетином гілки титрування та надлишкової гілки титранту. Однак, як показано на малюнку Template:index}, термометрична крива титрування зазвичай показує кривизну поблизу точки еквівалентності через неповну реакцію нейтралізації або надмірне розведення титранду та титранту під час титрування. Остання проблема мінімізується за допомогою титранту, який в 10-100 разів більш концентрований, ніж аналіт, хоча це призводить до дуже малого обсягу кінцевої точки і більшої відносної похибки. При необхідності кінцева точка знаходить шляхом екстраполяції.
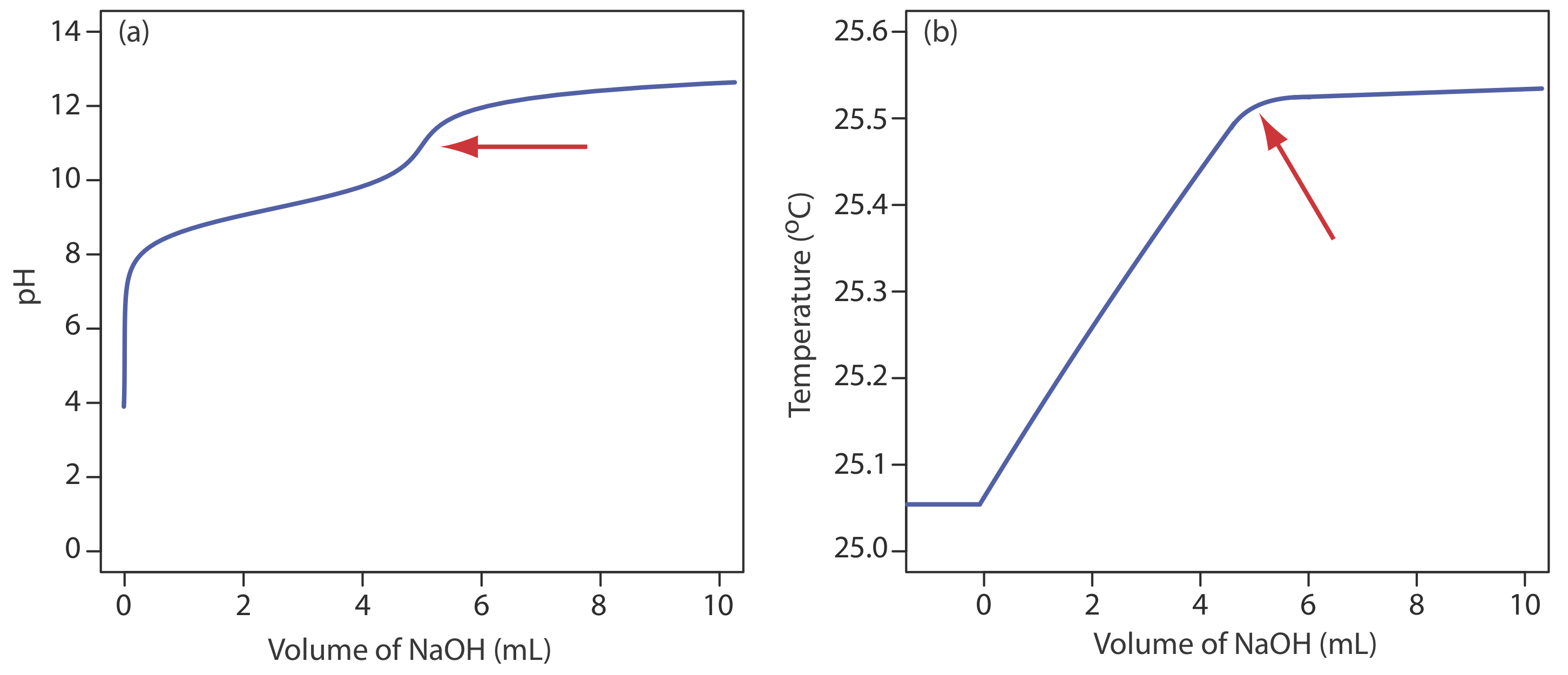
Хоча це не поширений метод моніторингу кислотно-основного титрування, термометричне титрування має одну явну перевагу перед прямим або непрямим моніторингом рН. Як обговорювалося раніше, використання індикатора або моніторингу рН обмежується величиною відповідних констант рівноваги. Наприклад, титрування борної кислоти, H 3 BO 3, з NaOH не забезпечує гострої кінцевої точки при моніторингу рН, оскільки K a борної кислоти занадто малий (рис. Template:index a).\(5.8 \times 10^{-10}\) Оскільки ентальпія нейтралізації борної кислоти досить велика, —42,7 кДж/моль, її термометрична крива титрування забезпечує корисну кінцеву точку (Рисунок Template:index b).
Титрування в неводних розчинниках
Поки ми припускали, що титрант і титран є водними розчинами. Хоча вода є найпоширенішим розчинником для кислотно-базової титриметрії, перехід на неводний розчинник може покращити доцільність титрування.
Для амфотерного розчинника SH константа автопротолізу K s відноситься концентрація його протонованої форми\(\text{SH}_2^+\), до його депротонованої форми, S —
\[\begin{aligned} 2 \mathrm{SH} &\rightleftharpoons\mathrm{SH}_{2}^{+}+\mathrm{S}^{-} \\ K_{\mathrm{s}} &=\left[\mathrm{SH}_{2}^{+}\right][\mathrm{S}^-] \end{aligned} \nonumber\]
і рН розчинника і pH є
\[\begin{array}{l}{\mathrm{pH}=-\log \left[\mathrm{SH}_{2}^{+}\right]} \\ {\mathrm{pOH}=-\log \left[\mathrm{S}^{-}\right]}\end{array} \nonumber\]
Ви повинні визнати, що K w - це лише специфічна форма K s, коли розчинником є вода.
Найважливішим обмеженням, накладене K s, є зміна рН під час титрування. Щоб зрозуміти, чому це правда, розглянемо титрування 50,0 мл\(1.0 \times 10^{-4}\) M HCl з використанням\(1.0 \times 10^{-4}\) M NaOH в якості титранту. Перед точкою еквівалентності рН визначають по невиведеній сильній кислоті. Наприклад, коли обсяг NaOH становить 90% від V екв, концентрація H 3 O + дорівнює
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\frac{M_{a} V_{a}-M_{b} V_{b}}{V_{a}+V_{b}} = \frac{\left(1.0 \times 10^{-4} \ \mathrm{M}\right)(50.0 \ \mathrm{mL})-\left(1.0 \times 10^{-4} \ \mathrm{M}\right)(45.0 \ \mathrm{mL})}{50.0 \ \mathrm{mL}+45.0 \ \mathrm{mL}} = 5.3 \times 10^{-6} \ \mathrm{M} \nonumber\]
а рН - 5,3. Коли об'єм NaOH становить 110% від V екв, концентрація OH — становить
\[\left[\mathrm{OH}^{-}\right]=\frac{M_{b} V_{b}-M_{a} V_{a}}{V_{a}+V_{b}} = \frac{\left(1.0 \times 10^{-4} \ \mathrm{M}\right)(55.0 \ \mathrm{mL})-\left(1.0 \times 10^{-4} \ \mathrm{M}\right)(50.0 \ \mathrm{mL})}{55.0 \ \mathrm{mL}+50.0 \ \mathrm{mL}} = 4.8 \times 10^{-6} \ \mathrm{M} \nonumber\]
а PoH становить 5,3. РН титран дорівнює
\[\mathrm{pH}=\mathrm{p} K_{w}-\mathrm{pOH}=14.0-5.3=8.7 \nonumber\]
і зміна рН титранду, оскільки титрування йде від 90% до 110% V екв
\[\Delta \mathrm{pH}=8.7-5.3=3.4 \nonumber\]
Якщо ми проводимо таке ж титрування в неводному амфіпротному розчиннику, який має K s\(1.0 \times 10^{-20}\), pH після додавання 45,0 мл NaOH все ще становить 5,3. Однак рН після додавання 55,0 мл NaOH становить
\[\mathrm{pH}=\mathrm{p} K_{s}-\mathrm{pOH}=20.0-5.3=14.7 \nonumber\]
В цьому випадку зміна рН
\[\Delta \mathrm{pH}=14.7-5.3=9.4 \nonumber\]
значно більше, ніж отримане при титруванні у воді. Рисунок Template:index показує криві титрування як у водному, так і у неводному розчинниках.
Іншим параметром, який впливає на доцільність титрування кислотою та основою, є константа дисоціації титранду. Тут теж важливу роль відіграє розчинник. Сила кислоти або основи - відносна міра того, наскільки легко переносити протон з кислоти в розчинник або з розчинника на основу. Наприклад, HF, з K a of\(6.8 \times 10^{-4}\), є кращим донором протонів, ніж СН 3 СООН, для якого К а є\(1.75 \times 10^{-5}\).
Найсильнішою кислотою, яка може існувати у воді, є іон гідронію, H 3 O +. HCl та HNO 3 є сильними кислотами, оскільки вони є кращими донорами протонів, ніж H 3 O +, і по суті передають всі свої протони H 2 O, вирівнюючи їх кислотну силу до сили H 3 O +. У різних розчинниках HCl і HNO 3 можуть вести себе не так, як сильні кислоти.
Якщо помістити оцтову кислоту у воду, реакція дисоціації
\[\mathrm{CH}_{3} \mathrm{COOH}(a q)+\mathrm{H}_{2} \mathrm{O}( l)\rightleftharpoons\mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{CH}_{3} \mathrm{COO}^{-}(a q) \nonumber\]
не протікає в значній мірі, оскільки CH 3 COO — є більш міцною основою, ніж H 2 O і H 3 O + є більш сильною кислотою, ніж CH 3 COOH. Якщо помістити оцтову кислоту в розчинник, який є більш міцною основою, ніж вода, наприклад, аміак, то реакція
\[\mathrm{CH}_{3} \mathrm{COOH}+\mathrm{NH}_{3}\rightleftharpoons\mathrm{NH}_{4}^{+}+\mathrm{CH}_{3} \mathrm{COO}^{-} \nonumber\]
протікає в більшій мірі. Насправді і HCl, і CH 3 COOH є сильними кислотами в аміаку.
За інших рівних умов міцність слабкої кислоти збільшується, якщо ми помістимо її в розчинник, який є більш основним, ніж вода, а міцність слабкої основи збільшується, якщо помістити її в розчинник, який є більш кислим, ніж вода. У деяких випадках, однак, спостерігається зворотний ефект. Наприклад, р К б для NH 3 становить 4,75 у воді і це 6,40 в більш кислої льодовикової оцтової кислоти. Всупереч нашим очікуванням, NH 3 є слабшою основою в більш кислому розчиннику. Повний опис впливу розчинника на р К а слабкої кислоти або p K b слабкої основи виходить за рамки цього тексту. Однак ви повинні знати, що титрування, яке неможливо у воді, може бути здійсненним у іншому розчиннику.
Представницький метод 9.2.1: Визначення білка в хлібі
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий кислотно-базовий титриметричний метод. Хоча кожен метод унікальний, наступний опис визначення білка в хлібі дає повчальний приклад типової процедури. Опис тут базується на методі 13.86, опублікованому в Офіційні методи аналізу, 8-е видання, Асоціація офіційних сільськогосподарських хіміків: Вашингтон, округ Колумбія, 1955.
Опис методів
Цей метод заснований на визначенні %w/w азоту методом Кьєльдаля. Білок в зразку хліба окислюється до\(\text{NH}_4^+\) використання гарячого концентрованого Н 2 SO 4. Після внесення розчину лужного, який перетворюється\(\text{NH}_4^+\) в NH 3, аміак переганяється в колбу, яка містить відому кількість HCl. Кількість не прореагував HCl визначається зворотним титруванням за допомогою стандартного сильного базового титранту. Оскільки різні білки злаків містять однакову кількість азоту - в середньому на кожен грам азоту припадає 5,7 г білка - ми помножимо експериментально визначене %w/w N на коефіцієнт 5,7, дає %w/w білок у зразку.
Порядок дій
Перенесіть 2,0-г зразка хліба, який раніше був висушений на повітрі і подрібнений в порошок, у відповідну колбу для травлення разом з 0,7 г каталізатора HgO, 10 г K 2 SO 4 і 25 мл концентрованого H 2 SO 4. Доведіть розчин до кипіння. Продовжуйте кип'ятити, поки розчин не стане прозорим, а потім кип'ятіть принаймні додаткові 30 хвилин. Після охолодження розчину нижче кімнатної температури видаліть каталізатор Hg 2 +, додавши 200 мл H 2 O і 25 мл 4% w/v K 2 S. Додати кілька гранул Zn, щоб служити киплячими каменями і 25 г NaOH. Швидко підключіть колбу до дистиляційного апарату і переганяйте NH 3 в колекторну колбу, яка містить відому кількість стандартизованого HCl. Наконечник конденсатора необхідно розташувати нижче поверхні сильної кислоти. Після завершення дистиляції титрувати надлишок сильної кислоти стандартним розчином NaOH, використовуючи метиловий червоний як індикатор (рис. Template:index).

Питання
1. Окислення білка перетворює весь його азот в\(\text{NH}_4^+\). Чому кількість азоту не визначається шляхом безпосереднього титрування\(\text{NH}_4^+\) з міцною основою?
Є дві причини того, що безпосередньо не титрують іон амонію. По-перше, оскільки\(\text{NH}_4^+\) є дуже слабкою кислотою (її K a is\(5.6 \times 10^{-10}\)), її титрування з NaOH має погано визначену кінцеву точку. По-друге, навіть якщо ми можемо визначити кінцеву точку з прийнятною точністю та точністю, розчин також містить значну концентрацію не прореагував H 2 SO 4. Наявність двох кислот, які сильно відрізняються по концентрації, ускладнює аналіз. Якщо концентрація титранта аналогічна концентрації H 2 SO 4, то об'єм точки еквівалентності для титрування занадто малий, щоб надійно вимірювати.\(\text{NH}_4^+\) З іншого боку, якщо концентрація титранту аналогічна концентрації, обсяг\(\text{NH}_4^+\), необхідний для нейтралізації H 2 SO 4, необгрунтовано великий.
2. Аміак є летючим з'єднанням, про що свідчить сильний запах навіть розведених розчинів. Ця волатильність є потенційним джерелом детермінантної помилки. Це визначальна помилка негативна чи позитивна?
Будь-яка втрата NH 3 - це втрата азоту і, отже, втрата білка. Результатом є негативна детермінантна помилка.
3. Визначте кроки в цій процедурі, які мінімізують детермінантну похибку від можливої втрати NH 3.
Три конкретні кроки мінімізують втрати аміаку: (1) розчин охолоджується нижче кімнатної температури, перш ніж ми додаємо NaOH; (2) після додавання NaOH, травна колба швидко з'єднується з дистиляційним апаратом; і (3) ми розміщуємо наконечник конденсатора нижче поверхні HCl, щоб переконатися, що NH 3 реагує з HCl, перш ніж він втрачається через випаровування.
4. Як K 2 S видаляє Hg 2 +, і чому важливо її видалення?
Додавання сульфіду осаджує Hg 2 + у вигляді Hg. Це важливо, оскільки NH 3 утворює стабільні комплекси з багатьма іонами металів, включаючи Hg 2 +. Будь-який NH 3, який реагує з Hg 2 +, не збирається під час дистиляції, забезпечуючи ще одне джерело детермінантної помилки.
Кількісні програми
Хоча багато кількісних застосувань кислотно-основи титриметрії були замінені іншими аналітичними методами, кілька важливих застосувань продовжують знаходити застосування. У цьому розділі ми розглядаємо загальне застосування кислотно-основи титриметрії для аналізу неорганічних та органічних сполук, з акцентом на застосування в екологічному та клінічному аналізі. Однак спочатку ми обговорюємо вибір і стандартизацію кислих і основних титрантів.
Вибір та стандартизація титранту
Найбільш поширеними сильними кислотними титрантами є HCl, HClO 4 та H 2 SO 4. Розчини цих титрантів зазвичай готують шляхом розведення наявного у продажу концентрованого розчину. Оскільки концентрація концентрованої кислоти відома лише приблизно, концентрація титранту визначається шляхом стандартизації проти однієї з первинних стандартних слабких основ, перелічених у таблиці Template:index.
Номінальні концентрації концентрованих вихідних розчинів складають 12,1 М HCl, 11,7 M HClO 4 і 18,0 M H 2 SO 4. Фактичні концентрації цих кислот наведені як %w/v і трохи варіюються від партії до партії.
| тип титранту | первинний стандарт | реакція титрування | коментар |
|---|---|---|---|
| сильна кислота | Na 2 СО 3 | \(\mathrm{Na}_{2} \mathrm{CO}_{3}+2 \mathrm{H}_{3} \mathrm{O}^{+} \rightarrow \mathrm{H}_{2} \mathrm{CO}_{3}+2 \mathrm{Na}^{+}+2 \mathrm{H}_{2} \mathrm{O}\) | a |
| сильна кислота | (ХОЧ 2) 3CNH 2 | \(\left(\mathrm{HOCH}_{2}\right)_{3} \mathrm{CNH}_{2}+\mathrm{H}_{3} \mathrm{O}^{+} \longrightarrow\left(\mathrm{HOCH}_{2}\right)_{3} \mathrm{CNH}_{3}^{+}+\mathrm{H}_{2} \mathrm{O}\) | б |
| сильна кислота | На2Б 4 О 7 | \(\mathrm{Na}_{2} \mathrm{B}_{4} \mathrm{O}_{7}+2 \mathrm{H}_{3} \mathrm{O}^{+}+3 \mathrm{H}_{2} \mathrm{O} \rightarrow 2 \mathrm{Na}^{+}+4 \mathrm{H}_{3} \mathrm{BO}_{3}\) | |
| міцна основа | КХК 8 Ч 4 О 4 | \(\mathrm{KHC}_{8} \mathrm{H}_{4} \mathrm{O}_{4}+\mathrm{OH}^{-} \rightarrow \mathrm{K}^{+}+\mathrm{C}_{8} \mathrm{H}_{4} \mathrm{O}_{4}^{-}+\mathrm{H}_{2} \mathrm{O}\) | c |
| міцна основа | C 6 Ч 5 КУН | \(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{COOH}+\mathrm{OH}^{-} \rightarrow \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{COO}^{-}+\mathrm{H}_{2} \mathrm{O}\) | d |
| міцна основа | КХ (ІО 32) | \(\mathrm{KH}\left(\mathrm{IO}_{3}\right)_{2}+\mathrm{OH}^{-} \rightarrow \mathrm{K}^{+}+2 \mathrm{IO}_{3}^{-}+\mathrm{H}_{2} \mathrm{O}\) | |
|
(а) Кінцева точка для цього титрування покращується титруванням до другої точки еквівалентності, кип'ятінням розчину для вигнання CO2 та відходом до другої точки еквівалентності. Реакція в даному випадку така \[\mathrm{Na}_{2} \mathrm{CO}_{3}+2 \mathrm{H}_{3} \mathrm{O}^{+} \rightarrow \mathrm{CO}_{2}+2 \mathrm{Na}^{+}+3 \mathrm{H}_{2} \mathrm{O} \nonumber\] (б) T ris - (гідроксиметил) амінометан часто йде за коротшою назвою TRIS або THAM. (c) Фталат водню калію часто йде за коротшою назвою КХП. (d) Оскільки він не дуже розчинний у воді, перед розведенням водою розчиніть бензойну кислоту в невеликій кількості етанолу. |
|||
Найпоширенішим сильним базовим титрантом є NaOH, який доступний як у вигляді нечистої твердої речовини, так і як приблизно 50% w/v розчин. Розчини NaOH стандартизовані проти будь-якого з первинних стандартів слабкої кислоти, перерахованих в табл\(\PageIndex[4|\).
Використання NaOH як титранту ускладнюється потенційним забрудненням від наступної реакції між розчиненим CO 2 та OH -.
Будь-який розчин, що контактує з атмосферою, містить невелику кількість СО 2 (aq) з рівноваги
\[\mathrm{CO}_{2}(g)\rightleftharpoons\mathrm{CO}_{2}(a q) \nonumber\]
Під час титрування NaOH реагує як з титрандом, так і з СО 2, що збільшує обсяг NaOH, необхідний для досягнення кінцевої точки титрування. Це не проблема, якщо кінцева точка рН менше 6. Нижче цього рН\(\text{CO}_3^{2-}\) від реакції\ ref {9.7} реагує з H 3 O + з утворенням вугільної кислоти.
Поєднання реакції\ ref {9.7} і реакції\ ref {9.8} дає загальну реакцію, яка не включає OH —.
\[\mathrm{CO}_{2}(a q)+\mathrm{H}_{2} \mathrm{O}(l ) \longrightarrow \mathrm{H}_{2} \mathrm{CO}_{3}(a q) \nonumber\]
За цих умов присутність СО 2 не впливає на кількість OH — використовується при титруванні і не є джерелом детермінантної похибки.
Однак якщо кінцева точка рН становить від 6 до 10, для нейтралізації\(\text{CO}_3^{2-}\) потрібен один протон
\[\mathrm{CO}_{3}^{2-}(a q)+\mathrm{H}_{3} \mathrm{O}^{+}(a q) \rightarrow \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{HCO}_{3}^{-}(a q) \nonumber\]
і чиста реакція між CO 2 і OH - це
\[\mathrm{CO}_{2}(a q)+\mathrm{OH}^{-}(a q) \rightarrow \mathrm{HCO}_{3}^{-}(a q) \nonumber\]
За цих умов деяка кількість OH — витрачається при нейтралізації СО 2, що призводить до детермінантної похибки. Ми можемо уникнути визначеної помилки, якщо використовувати однакову кінцеву точку рН як для стандартизації NaOH, так і для аналізу нашого аналіту, хоча це не завжди практично.
Твердий NaOH завжди забруднюється карбонатом через його контакт з атмосферою, і ми не можемо використовувати його для приготування безкарбонатного розчину NaOH. Розчини NaOH без карбонатів готують з 50% в/в NaOH, оскільки Na 2 CO 3 не розчиняється в концентрованому NaOH. Коли CO 2 абсорбується, Na 2 CO 3 випадає в осад і осідає на дно ємності, що забезпечує доступ до безкарбонатного NaOH. При попередньому розпарюванні розчину NaOH обов'язково використовуйте воду, вільну від розчиненого СО 2. Короткочасне кип'ятіння води виганяє СО 2; після того як вона охолоне, воду використовують для приготування безкарбонатних розчинів NaOH. Розчин NaOH без карбонату є відносно стабільним, якщо обмежити його контакт з атмосферою. Стандартні розчини гідроксиду натрію не зберігаються в скляних пляшках, оскільки NaOH реагує зі склом з утворенням силікату; натомість зберігайте такі розчини в поліетиленових пляшках.
неорганічний аналіз
Кислотно-основна титріметрія є стандартним методом кількісного аналізу багатьох неорганічних кислот і підстав. Стандартний розчин NaOH використовується для визначення концентрації неорганічних кислот, таких як H 3 PO 4 або H 3 AsO 4, а неорганічні основи, такі як Na 2 CO 3, аналізуються за допомогою стандартного розчину HCl.
Якщо неорганічна кислота або основа, яка є занадто слабкою, щоб їх можна було проаналізувати титруванням на водній кислоті та основі, можливо, можна завершити аналіз, скоригувавши розчинник або непрямим аналізом. Наприклад, при аналізі борної кислоти H 3 BO 3, шляхом титрування з NaOH точність обмежується малою константою дисоціації борної кислоти\(5.8 \times 10^{-10}\). Значення K борної кислоти збільшується до\(1.5 \times 10^{-4}\) в присутності манітолу, оскільки вона утворює стабільний комплекс з іоном бората, в результаті чого є більш гостра кінцева точка і більш точне титрування. Аналогічно, аналіз солей амонію обмежується константою дисоціації малої кислоти іона амонію\(5.7 \times 10^{-10}\). Ми можемо визначити\(\text{NH}_4^+\) побічно, використовуючи міцну основу для перетворення її в NH 3, яка видаляється дистиляцією та титрується HCl. Оскільки NH 3 є сильнішою слабкою основою, ніж\(\text{NH}_4^+\) слабка кислота (її K b є\(1.58 \times 10^{-5}\)), титрування має більш гостру кінцеву точку.
Ми можемо проаналізувати нейтральний неорганічний аналіт, якщо ми можемо спочатку перетворити його на кислоту або основу. Наприклад, ми можемо визначити концентрацію,\(\text{NO}_3^-\) зменшивши її до NH 3 в сильно лужному розчині за допомогою сплаву Деварди, суміші 50% w/w Cu, 45% w/w Al і 5% w/w Zn.
\[3 \mathrm{NO}_{3}^{-}(a q)+8 \mathrm{Al}(s)+5 \mathrm{OH}^{-}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l) \rightarrow 8 \mathrm{AlO}_{2}^{-}(a q)+3 \mathrm{NH}_{3}(a q) \nonumber\]
NH 3 видаляють дистиляцією і титрують HCl. Крім того, ми можемо титрувати\(\text{NO}_3^-\) як слабку основу, помістивши її в кислий неводний розчинник, такий як безводна оцтова кислота, і використовуючи HClO 4 як титрант.
Кислотно-базова титриметрія продовжує перераховуватися як стандартний метод визначення лужності, кислотності та вільного CO 2 у водах та стічних водах. Лужність - це міра здатності зразка нейтралізувати кислоти. Найважливішими джерелами лужності є OH -\(\text{HCO}_3^-\), і\(\text{CO}_3^{2-}\), хоча інші слабкі основи, такі як фосфат, можуть сприяти загальній лужності. Загальна лужність визначається титруванням до фіксованої кінцевої точки рН 4,5 (або до зеленої кінцевої точки бромокрезолу) за допомогою стандартного розчину HCl або H 2 SO 4. Результати повідомляються у вигляді мг СаСО 3 /л.
Хоча різноманітні міцні основи та слабкі основи можуть сприяти лужності зразка, єдине титрування не може розрізнити можливі джерела. Повідомлення про загальну лужність так, ніби СаСО 3 є єдиним джерелом, дає засіб для порівняння кислотно-нейтралізуючих потужностей різних зразків.
Коли джерела лужності обмежені OH -, і\(\text{HCO}_3^-\)\(\text{CO}_3^{2-}\), окремі титрування до рН 4,5 (або бромокрезольної зеленої кінцевої точки) і рН 8,3 (або кінцева точка фенолфталеїну) дозволяють визначити, які види присутні і їх відповідні концентрації. Криві титрування для OH —\(\text{HCO}_3^-\), і\(\text{CO}_3^{2-}\) показані на малюнку Template:index. Для розчину, що містить OH — лише лужність, об'єм сильної кислоти, необхідної для досягнення кожної з двох кінцевих точок, ідентичний (рис. Template:index a). Коли єдиним джерелом лужності є\(\text{CO}_3^{2-}\), обсяг сильної кислоти, необхідної для досягнення кінцевої точки при рН 4,5, рівно вдвічі більше, ніж потрібно для досягнення кінцевої точки при рН 8,3 (Рисунок Template:index b). Якщо розчин містить лише\(\text{HCO}_3^-\) лужність, об'єм сильної кислоти, необхідної для досягнення кінцевої точки при рН 8,3, дорівнює нулю, але для кінцевої точки рН 4.5 більше нуля (рис. Template:index c).
Суміш OH — і\(\text{CO}_3^{2-}\) або суміш\(\text{HCO}_3^-\) і\(\text{CO}_3^{2-}\) також можлива. Розглянемо, наприклад, суміш ОН — і\(\text{CO}_3^{2-}\). Обсяг сильної кислоти для титрування OH - однаковий, чи ми титруємо до рН 8,3 або рН 4,5. Титрування\(\text{CO}_3^{2-}\) до рН 4,5, однак, вимагає вдвічі більше сильної кислоти, ніж титрування до рН 8,3. Отже, коли ми титруємо суміш цих двох іонів, обсяг сильної кислоти, необхідної для досягнення рН 4,5, менше ніж удвічі більше, ніж необхідний для досягнення рН 8,3. Для суміші\(\text{HCO}_3^-\) і\(\text{CO}_3^{2-}\) обсягу сильної кислоти необхідно досягти рН 4,5 більш ніж в два рази більше, ніж потрібно для досягнення рН 8,3. Таблиця Template:index узагальнює взаємозв'язок між джерелами лужності та обсягами титранту, необхідним для досягнення двох кінцевих точок.
Суміш ОН — і\(\text{HCO}_3^-\) нестійка щодо утворення\(\text{CO}_3^{2-}\). Проблема 15 в кінці глави проблеми просить вас пояснити, чому це правда.
| джерело лужності | зв'язок між томами кінцевої точки |
|---|---|
| ОХ — | \(V_{\mathrm{pH} \ 4.5}=V_{\mathrm{pH} \ 8.3}\) |
| \(\text{CO}_3^{2-}\) | \(V_{\mathrm{pH} \ 4.5}=2 \times V_{\mathrm{pH} \ 8.3}\) |
| \(\text{HCO}_3^-\) | \(V_{\mathrm{pH} \ 4.5}>0 ; V_{\mathrm{pH} \ 8.3}=0\) |
| OH — і\(\text{CO}_3^{2-}\) | \(V_{\mathrm{pH} \ 4.5}<2 \times V_{\mathrm{pH} \ 8.3}\) |
| \(\text{CO}_3^{2-}\)і\(\text{HCO}_3^-\) | \(V_{\mathrm{pH} \ 4.5}>2 \times V_{\mathrm{pH} \ 8.3}\) |
Кислотність є мірою здатності зразка води нейтралізувати основу і поділяється на сильну кислотну та слабку кислотну кислотність. Сильна кислотна кислотність неорганічних кислот, таких як HCl, HNO 3 та H 2 SO 4, поширена в промислових стоках та в дренажі кислотних шахт. У слабкій кислотній кислотності зазвичай переважає утворення Н 2 СО 3 з розчиненого СО 2, але також включає внески з гідролізуючих іонів металів, таких як Fe 3 +, Al 3+ і Mn 2 +. Крім того, слабка кислотність може включати в себе внесок органічних кислот.
Кислотність визначається титруванням стандартним розчином NaOH до фіксованого рН 3,7 (або кінцевої точки бромотимолового синього кольору) і до фіксованого рН 8,3 (або кінцевої точки фенолфталеїну). Титрування до рН 3,7 забезпечує показник сильної кислотності кислоти, а титрування до рН 8,3 забезпечує міру загальної кислотності. Слабка кислотність кислоти - це різниця між загальною кислотністю і сильною кислотною кислотністю. Результати виражаються у вигляді кількості СаСО 3, яке може бути нейтралізовано кислотністю зразка. Альтернативним підходом для визначення сильної кислотної та слабкої кислотної кислотності є отримання потенціометричної кривої титрування та використання графіка Гран для визначення двох точок еквівалентності. Такий підхід був використаний, наприклад, для визначення форм кислотності в атмосферних аерозолів [Ferek, RJ; Lazrus, A.L.; Haagenson, P. L.; Winchester, J.W. Environ. Науковий. Технол. 1983, 17, 315—324].
Як і у випадку з лужністю, кислотність повідомляється як мг СаСО 3 /л.
Вода, що контактує або з атмосферою, або з карбонатоносними відкладеннями містить вільний СО 2 в рівновазі з СО 2 (г) і з водним Н 2 СО 3,\(\text{HCO}_3^-\) і\(\text{CO}_3^{2-}\). Концентрацію вільного СО 2 визначають шляхом титрування стандартним розчином NaOH до кінцевої точки фенолфталеїну, або до рН 8,3, при цьому результати повідомляють як мг СО 2 /л. Цей аналіз по суті такий же, як і для визначення загальної кислотності і використовується тільки для проби води, які не містять сильної кислотної кислотності.
Вільний СО 2 - це те ж саме, що і CO 2 (aq).
Органічний аналіз
Кислотно-основна титриметрія продовжує відігравати невелику, але важливу роль для аналізу органічних сполук у фармацевтичній, біохімічній, сільському господарстві, та екологічних лабораторіях. Мабуть, найбільш широко використовуваним титруванням кислотно-основи є аналіз Кьєльдаля на органічний азот. Приклади аналітів, визначених аналізом Кьєльдаля, включають кофеїн та сахарин у фармацевтичних продуктах, білки в харчових продуктах та аналіз азоту в добривах, шламах та відкладах. Будь-який азот, присутній у стані окислення —3, кількісно окислюється до\(\text{NH}_4^+\). Оскільки деякі ароматичні гетероциклічні сполуки, такі як піридин, важко окислюються, для забезпечення кількісного окислення використовується каталізатор. Азот в інших станах окислення, таких як нітро- і азозот, окислюється до N 2, що призводить до негативної детермінантної помилки. Включаючи відновник, такий як саліцилова кислота, перетворює цей азот у ступінь окислення —3, усуваючи це джерело помилки. У таблиці Template:index наведено додаткові приклади, коли елемент кількісно перетворюється на титрувану кислоту або основу.
| елемент | конвертувати в... | реакція, що виробляє титрувані види | деталі титрування |
|---|---|---|---|
| П | NH 3 (г) | NH3 (aq) + HCl (aq)\(\rightarrow\)\(\text{NH}_4^+\) (aq) + Кл — (aq) | додати HCl в надлишку і назад титрувати з NaOH |
| S | SO 2 (г) | СО 3 (г) + Н 2 О 2 (ак)\(\rightarrow\) Н 2 СО 4 (ак) | титрування H 2 SO 4 з NaOH |
| C | СО 2 (г) | СО 2 (г) + Ба (ОН) 2 (ак)\(\rightarrow\) BaCo 3 (с) + Н 2 О (л) | додати надлишок Ba (OH) 2 і назад титрувати з HCl |
| Cl | HCl (г) | — | титрувати HCl з NaOH |
| F | SiF (4 г) | 3SiF 4 (ак) + 2Н 2 О (л)\(\rightarrow\) 2 Н 3 SiF 6 (ак) + SiO2 (s) | титрування Н 2 SiF 6 з NaOH |
| вид, який титрується, показаний жирним шрифтом | |||
Кілька органічних функціональних груп - слабкі кислоти або слабкі підстави. Карбонові (—COOH), сульфонові (—SO 3 H) та фенольні (—C 6 H 5 OH) функціональні групи - це слабкі кислоти, які успішно титруються у водних або неводних розчинниках. Гідроксид натрію є титрантом вибору для водних розчинів. Неводні титрування часто проводять в основному розчиннику, такому як етилендіамін, використовуючи в якості титранта гідроксид тетрабутиламмонію (C 4 H 9) 4 NOH. Аліфатичні та ароматичні аміни - слабкі основи, які титруються за допомогою HCl у водних розчині, або HClO 4 в льодовикової оцтової кислоти. Інші функціональні групи аналізуються побічно після реакції, яка виробляє або споживає кислоту або основу. Типові приклади наведені в таблиці Template:index.
| функціональна група | реакція, що виробляє титрувані види | деталі титрування |
|---|---|---|
| складний ефір | РКООР' (aq) + ОН — (aq)\(\rightarrow\) RCOO — (aq) + ГОР' (aq) | титрувати ОН — з HCl |
| карбоніл | R 2 СО (ак) + NH4OH • НГЛ (\(\rightarrow\)акр) 2 СОН (ак) + НСЛ (ак) + Н2О (л) | титрувати HCl з NaOH |
| алкоголь |
[1]: (СН 3 СО) 2 О +РОН\(\rightarrow\) СН 3 КОЛІР + СН 3 СООН [2]: (СН 3 СО) 2) + Н 2 О\(\rightarrow\) 2 СН 3 СООН |
титрувати СН 3 СООН з NaOH; порожнє титрування оцтового ангідриду, (СН 3 СО) 2 О, коригує на внесок реакції [2] |
|
вид, який титрується, показаний жирним шрифтом для спиртів реакцію [1] проводять в піридині для запобігання гідролізу оцтового ангідриду водою. Після завершення реакції [1] додають воду, щоб приховати будь-який не прореагував оцтовий ангідрид з оцтовою кислотою (реакція [2]) |
||
Багато фармацевтичних сполук - це слабкі кислоти або слабкі основи, які аналізуються водним або неводним титруванням кислотно-основи; приклади включають саліцилову кислоту, фенобарбітал, кофеїн та сульфаніламід. Амінокислоти та білки аналізуються в льодовиковій оцтовій кислоті, використовуючи HClO 4 як титрант. Наприклад, процедура визначення кількості живильно доступного білка використовує кислотно-основне титрування залишків лізину [(a) Molna'r-Perl, I.; Pintee-szakács, M. Anal. Чим. Акта 1987, 202, 159—166; (б) Барбоза, Дж.; Бош, Е.; Кортіна, Дж. Л.; Роуз, М. анал. Чим. Акт 1992, 256, 177—181].
Кількісні розрахунки
Кількісний зв'язок між титрандом і титрантом визначається стехіометрією реакції титрування. Якщо титранд поліпротичний, то ми повинні знати, до якої точки еквівалентності ми титруємо. Наступний приклад ілюструє, як ми можемо використовувати діаграму сходів для визначення стехіометрії реакції титрування.
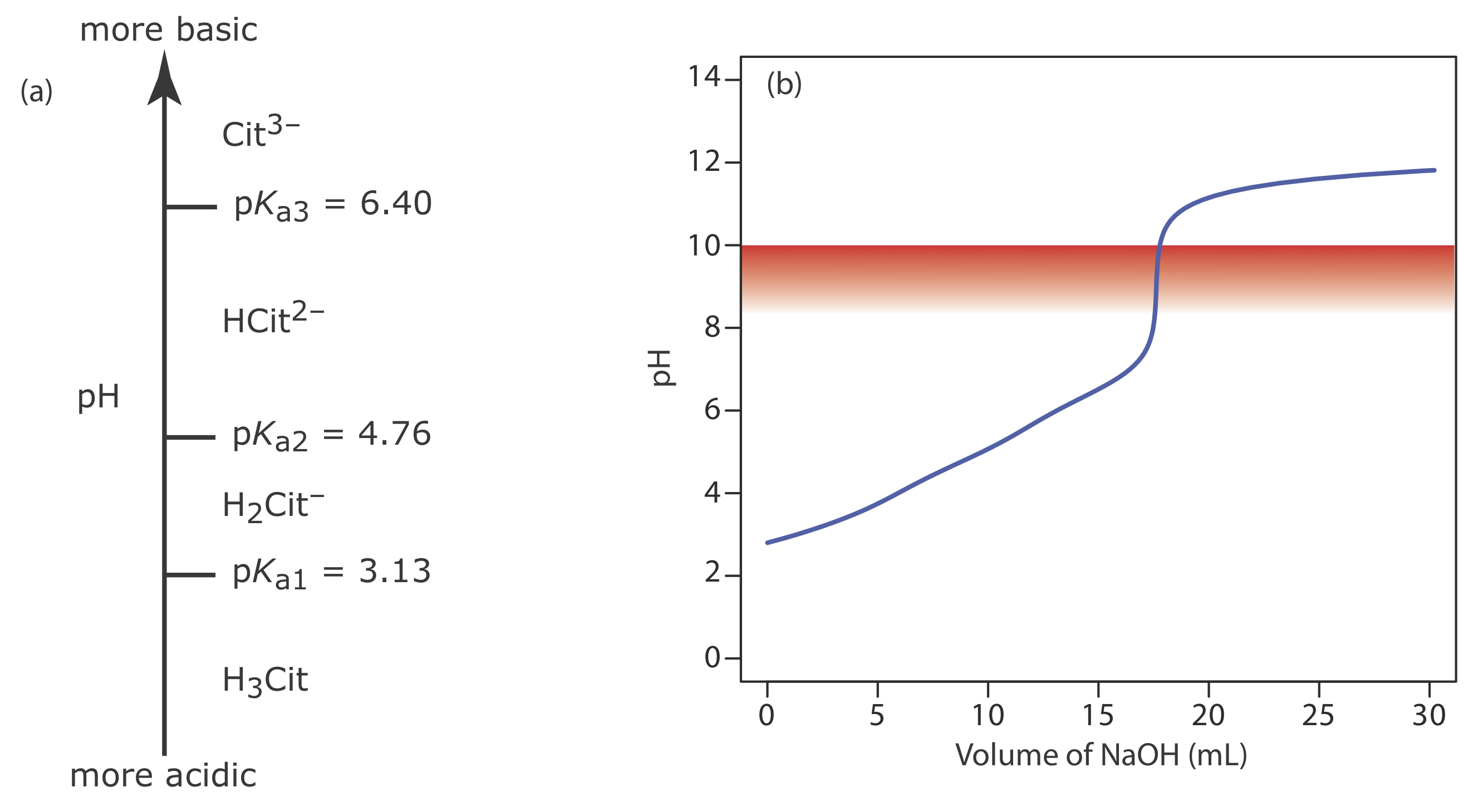
Зразок цитрусового напою об'ємом 50,00 мл вимагає 17,62 мл 0,04166 М NaOH, щоб досягти кінцевої точки фенолфталеїну. Кислотність проби виражають у вигляді грамів лимонної кислоти, C 6 H 8 O 7, на 100 мл.
Рішення
Оскільки лимонна кислота є трипротовою слабкою кислотою, ми спочатку повинні визначити, чи відповідає кінцева точка фенолфталеїну першій, другій або третій точці еквівалентності. Діаграма сходів лимонної кислоти показана на малюнку Template:index a На підставі цієї діаграми сходів перша точка еквівалентності знаходиться між рН 3,13 і рН 4,76, друга точка еквівалентності знаходиться між рН 4,76 і рН 6,40, а третя точка еквівалентності більше рН 6,40. Оскільки рН кінцевої точки фенолфталеїну становить 8,3—10,0 (див. Таблицю Template:index), титрування повинно перейти до третьої точки еквівалентності, а реакція титрування
\[ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7}(a q)+3 \mathrm{OH}^{-}(a q) \longrightarrow \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{O}_{7}^{3-}(a q)+3 \mathrm{H}_{2} \mathrm{O}(l) \nonumber\]
Щоб досягти точки еквівалентності, кожен моль лимонної кислоти споживає три молі NaOH; таким чином
\[(0.04166 \ \mathrm{M} \ \mathrm{NaOH})(0.01762 \ \mathrm{L} \ \mathrm{NaOH})=7.3405 \times 10^{-4} \ \mathrm{mol} \ \mathrm{NaOH} \nonumber\]
\[7.3405 \times 10^{-4} \ \mathrm{mol} \ \mathrm{NaOH} \times \frac{1 \ \mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7}}{3 \ \mathrm{mol} \ \mathrm{NaOH}}= 2.4468 \times 10^{-4} \ \mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7} \nonumber\]
\[2.4468 \times 10^{-4} \ \mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7} \times \frac{192.1 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7}}{\mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7}}=0.04700 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{8} \mathrm{O}_{7} \nonumber\]
Оскільки це кількість лимонної кислоти в зразку 50,00 мл, концентрація лимонної кислоти в цитрусовому напої становить 0,09400 г/100 мл. Повна крива титрування показана на малюнку Template:index b.
Нещодавно ваша компанія отримала партію саліцилової кислоти C 7 H 6 O 3 для використання у виробництві ацетилсаліцилової кислоти (аспірину). Прийняти відвантаження можна тільки в тому випадку, якщо саліцилова кислота більш ніж 99% чистої. Щоб оцінити чистоту відвантаження, ви розчиняєте зразок 0,4208 г у воді та титруєте до кінцевої точки фенолфталеїну, використовуючи 21,92 мл 0,1354 М NaOH. Повідомте про чистоту відвантаження як% w/w C 7 H 6 O 3. Саліцилова кислота - дипротовая слабка кислота зі значеннями р К а 2,97 і 13,74.
- Відповідь
-
Оскільки саліцилова кислота є дипротовою слабкою кислотою, ми повинні спочатку визначити, до якої точки еквівалентності вона титрується. Використовуючи значення p K a саліцилової кислоти як орієнтир, рН у першій точці еквівалентності становить від 2,97 до 13,74, а другі точки еквівалентності - при рН більше 13,74. З таблиці Template:index кінцева точка фенолфталеїну знаходиться в діапазоні рН 8,3—10,0. Отже, титрування - це перша точка еквівалентності, для якої родимки NaOH дорівнюють молям саліцилової кислоти; таким чином
\[(0.1354 \ \mathrm{M})(0.02192 \ \mathrm{L})=2.968 \times 10^{-3} \ \mathrm{mol} \ \mathrm{NaOH} \nonumber\]
\[2.968 \times 10^{-3} \ \mathrm{mol} \ \mathrm{NaOH} \times \frac{1 \ \mathrm{mol} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3}}{\mathrm{mol} \ \mathrm{NaOH}} \times \frac{138.12 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3}}{\mathrm{mol} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3}}=0.4099 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3} \nonumber\]
\[\frac{0.4099 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3}}{0.4208 \ \mathrm{g} \text { sample }} \times 100=97.41 \ \% \mathrm{w} / \mathrm{w} \ \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{3} \nonumber\]
Оскільки чистота зразка менше 99%, ми відхиляємо відвантаження.
При непрямому аналізі аналіт бере участь в одній або декількох попередніх реакціях, одна з яких виробляє або споживає кислоту або основу. Незважаючи на додаткову складність, розрахунки нехитрі.
Чистота фармацевтичного препарату сульфаніламіду, C 6 H 4 N 2 O 2 S, визначають шляхом окислення сірки до SO 2 і барботирования її через H 2 O 2 з отриманням Н 2 SO 4. Кислоту титрують до кінцевої точки бромотимолового синього кольору за допомогою стандартного розчину NaOH. Розрахувати чистоту препарату враховуючи, що на 0,5136-г проби потрібно 48,13 мл 0,1251 М NaOH.
Рішення
Кінцева точка бромотимолового синього кольору має діапазон рН 6,0-7,6. Сірчана кислота - це діпротова кислота, з p K a2 1,99 (перше значення K дуже велике і реакція дисоціації кислоти йде до завершення, саме тому H 2 SO4 є сильною кислотою). Отже, титрування переходить до другої точки еквівалентності, і реакція титрування є
\[\mathrm{H}_{2} \mathrm{SO}_{4}(a q)+2 \mathrm{OH}^{-}(a q) \longrightarrow 2 \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{SO}_{4}^{2-}(a q) \nonumber\]
Використовуючи результати титрування, є
\[(0.1251 \ \mathrm{M} \ \mathrm{NaOH})(0.04813 \ \mathrm{L} \ \mathrm{NaOH})=6.021 \times 10^{-3} \ \mathrm{mol} \ \mathrm{NaOH} \nonumber\]
\[6.012 \times 10^{-3} \text{ mol NaOH} \times \frac{1 \text{ mol} \mathrm{H}_{2} \mathrm{SO}_{4}} {2 \text{ mol NaOH}} = 3.010 \times 10^{-3} \text{ mol} \mathrm{H}_{2} \mathrm{SO}_{4} \nonumber\]
\[3.010 \times 10^{-3} \ \mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{4} \times \frac{1 \ \mathrm{mol} \text{ S}}{\mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{4}} \times \ \frac{1 \ \mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S}}{\mathrm{mol} \text{ S}} \times \frac{168.17 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S}}{\mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S}}= 0.5062 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S} \nonumber\]
виробляється при барботированіе СО 2 через Н 2 О 2. Оскільки вся сірка в H 2 SO 4 надходить з сульфаніламіду, ми можемо використовувати збереження маси для визначення кількості сульфаніламіду в зразку.
\[\frac{0.5062 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S}}{0.5136 \ \mathrm{g} \text { sample }} \times 100=98.56 \ \% \mathrm{w} / \mathrm{w} \ \mathrm{C}_{6} \mathrm{H}_{4} \mathrm{N}_{2} \mathrm{O}_{2} \mathrm{S} \nonumber\]
Концентрацію NO 2 в повітрі визначають шляхом пропускання зразка через розчин Н 2 О 2, який окислює NO 2 до HNO 3, і титрування HNO 3 з NaOH. Яка концентрація NO 2, в мг/л, якщо 5,0 л зразка повітря вимагає 9,14 мл 0,01012 М NaOH, щоб досягти кінцевої точки метильного червоного
- Відповідь
-
Родимки ГНО 3, одержувані шляхом витягування зразка через Н 2 О 2, є
\[(0.01012 \ \mathrm{M})(0.00914 \ \mathrm{L}) \times \frac{1 \ \mathrm{mol} \ \mathrm{HNO}_{3}}{\mathrm{mol} \ \mathrm{NaOH}}=9.25 \times 10^{-5} \ \mathrm{mol} \ \mathrm{HNO}_{3} \nonumber\]
Збереження маси на азоті вимагає, щоб кожен моль NO 2 виробляв один моль HNO 3; таким чином, маса NO 2 в зразку становить
\[9.25 \times 10^{-5} \ \mathrm{mol} \ \mathrm{HNO}_{3} \times \frac{1 \ \mathrm{mol} \ \mathrm{NO}_{2}}{\mathrm{mol} \ \mathrm{HNO}_{3}} \times \frac{46.01 \ \mathrm{g} \ \mathrm{NO}_{2}}{\mathrm{mol} \ \mathrm{NO}_{2}}=4.26 \times 10^{-3} \ \mathrm{g} \ \mathrm{NO}_{2} \nonumber\]
і концентрація NO 2 дорівнює
\[\frac{4.26 \times 10^{-3} \ \mathrm{g} \ \mathrm{NO}_{2}}{5 \ \mathrm{L} \text { air }} \times \frac{1000 \ \mathrm{mg}}{\mathrm{g}}=0.852 \ \mathrm{mg} \ \mathrm{NO}_{2} \ \mathrm{L} \text { air } \nonumber\]
Для зворотного титрування ми повинні розглянути дві кислотно-лужні реакції. Знову ж таки, розрахунки нехитрі.
Кількість білка в пробі сиру визначається за допомогою аналізу Кьельдаля на азот. Після перетравлення зразка сиру 0,9814 г, азот окислюється до\(\text{NH}_4^+\), перетворюється в NH 3 з NaOH, а NH 3 переганяється в колекційну колбу, яка містить 50,00 мл 0,1047 М HCl. Надлишок HCl назад титрується 0.1183 M NaOH, що вимагає 22,84 мл для досягнення кінцевої точки бромотимолового синього кольору. Повідомте про %w/w білка в сирі, припускаючи, що в більшості молочних продуктів є 6,38 грам білка на кожен грам азоту.
Рішення
HCl в колекторній колбі реагує з двома основами
\[\mathrm{HCl}(a q)+\mathrm{NH}_{3}(a q) \rightarrow \mathrm{NH}_{4}^{+}(a q)+\mathrm{Cl}^{-}(a q) \nonumber\]
\[\mathrm{HCl}(a q)+\mathrm{OH}^{-}(a q) \rightarrow \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{Cl}^{-}(a q) \nonumber\]
Колекційна колба спочатку містить
\[(0.1047 \ \mathrm{M \ HCl})(0.05000 \ \mathrm{L \ HCl})=5.235 \times 10^{-3} \mathrm{mol} \ \mathrm{HCl} \nonumber\]
з яких
\[(0.1183 \ \mathrm{M} \ \mathrm{NaOH})(0.02284 \ \mathrm{L} \ \mathrm{NaOH}) \times \frac{1 \ \mathrm{mol} \ \mathrm{HCl}}{\mathrm{mol} \ \mathrm{NaOH}}=2.702 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \nonumber\]
реагувати з NaOH. Різниця між загальними родимками HCl та родимками HCl, які реагують з NaOH, - це родимки HCl, які реагують з NH 3.
\[5.235 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl}-2.702 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} =2.533 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \nonumber\]
Оскільки весь азот в NH 3 надходить із зразка сиру, ми використовуємо збереження маси для визначення грамів азоту в зразку.
\[2.533 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \times \frac{1 \ \mathrm{mol} \ \mathrm{NH}_{3}}{\mathrm{mol} \ \mathrm{HCl}} \times \frac{14.01 \ \mathrm{g} \ \mathrm{N}}{\mathrm{mol} \ \mathrm{NH}_{3}}=0.03549 \ \mathrm{g} \ \mathrm{N} \nonumber\]
Маса білка, отже, становить
\[0.03549 \ \mathrm{g} \ \mathrm{N} \times \frac{6.38 \ \mathrm{g} \text { protein }}{\mathrm{g} \ \mathrm{N}}=0.2264 \ \mathrm{g} \text { protein } \nonumber\]
і% w/w білка
\[\frac{0.2264 \ \mathrm{g} \text { protein }}{0.9814 \ \mathrm{g} \text { sample }} \times 100=23.1 \ \% \mathrm{w} / \mathrm{w} \text { protein } \nonumber\]
Вапняк складається переважно з СаСО 3, зі слідами оксидів заліза та інших оксидів металів. Для визначення чистоти вапняку 0,5413-г проби розчиняють, використовуючи 10,00 мл 1,396 М HCl. Після нагрівання для вигнання СО 2 надлишок HCl титрували до кінцевої точки фенолфталеїну, вимагаючи 39,96 мл 0,1004 М NaOH. Повідомити про чистоту зразка як %w/w CaCo 3.
- Відповідь
-
Загальні родимки HCl, що використовуються в цьому аналізі, становить
\[(1.396 \ \mathrm{M})(0.01000 \ \mathrm{L})=1.396 \times 10^{-2} \ \mathrm{mol} \ \mathrm{HCl} \nonumber\]
Із загальної кількості родимок HCl
\[(0.1004 \ \mathrm{M} \ \mathrm{NaOH})(0.03996 \ \mathrm{L}) \times \frac{1 \ \mathrm{mol} \ \mathrm{HCl}}{\mathrm{mol} \ \mathrm{NaOH}} =4.012 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \nonumber\]
споживаються при зворотному титруванні з NaOH, що означає, що
\[ 1.396 \times 10^{-2} \ \mathrm{mol} \ \mathrm{HCl}-4.012 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \\ =9.95 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \nonumber\]
реагувати з CaCo 3. Оскільки\(\text{CO}_3^{2-}\) є двоосновним, кожен моль CaCo 3 споживає дві молі HCl; таким чином
\[9.95 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HCl} \times \frac{1 \ \mathrm{mol} \ \mathrm{CaCO}_{3}}{2 \ \mathrm{mol} \ \mathrm{HCl}} \times \\ \frac{100.09 \ \mathrm{g} \ \mathrm{CaCO}_{3}}{\mathrm{mol} \ \mathrm{CaCO}_{3}}=0.498 \ \mathrm{g} \ \mathrm{CaCO}_{3} \nonumber\]
\[\frac{0.498 \ \mathrm{g} \ \mathrm{CaCO}_{3}}{0.5143 \ \mathrm{g} \text { sample }} \times 100=96.8 \ \% \mathrm{w} / \mathrm{w} \ \mathrm{CaCO}_{3} \nonumber\]
Раніше ми зазначали, що ми можемо використовувати кислотно-лужне титрування для аналізу суміші кислот або підстав шляхом титрування до більш ніж однієї точки еквівалентності. Концентрація кожного аналіта визначається шляхом обліку його внеску в кожну точку еквівалентності.
Лужність природних вод зазвичай контролюється OH -, і\(\text{HCO}_3^-\)\(\text{CO}_3^{2-}\), присутній сингулярно або в поєднанні. Для титрування зразка 100.0-мл до рН 8,3 потрібно 18.67 мл 0,02812 M HCl. Друга 100,0-мл аліквота вимагає 48,12 мл того ж титранту, щоб досягти рН 4,5. Визначте джерела лужності і їх концентрації в міліграмах на літр.
Рішення
Оскільки обсяг титранту для досягнення рН 4,5 більш ніж удвічі більше, ніж необхідний для досягнення рН 8,3, ми знаємо з таблиці Template:index, що лужність зразка контролюється\(\text{CO}_3^{2-}\) і\(\text{HCO}_3^-\). Титрування до рН 8,3 нейтралізує\(\text{CO}_3^{2-}\) до\(\text{HCO}_3^-\)
\[\mathrm{CO}_{3}^{2-}(a q)+\mathrm{HCl}(a q) \rightarrow \mathrm{HCO}_{3}^{-}(a q)+\mathrm{Cl}^{-}(a q) \nonumber\]
але немає реакції між титрантом і\(\text{HCO}_3^-\) (див. Рисунок Template:index). Отже, концентрація\(\text{CO}_3^{2-}\) в зразку становить
\[{(0.02812 \ \mathrm{M \ HCl})(0.01867 \ \mathrm{L \ HCl}) \times} {\frac{1 \ \mathrm{mol} \ \mathrm{CO}_3^{2-}}{\mathrm{mol} \ \mathrm{HCl}}=5.250 \times 10^{-4} \ \mathrm{mol} \ \mathrm{CO}_{3}^{2-}} \nonumber\]
\[\frac{5.250 \times 10^{-4} \ \mathrm{mol} \ \mathrm{CO}_{3}^{2-}}{0.1000 \ \mathrm{L}} \times \frac{60.01 \ \mathrm{g} \ \mathrm{CO}_{3}^{2-}}{\mathrm{mol} \ \mathrm{CO}_{3}^{2-}} \times \frac{1000 \ \mathrm{mg}}{\mathrm{g}}=315.1 \ \mathrm{mg} / \mathrm{L} \nonumber\]
Титрування до рН 4,5 нейтралізує\(\text{CO}_3^{2-}\) до H 2 CO 3 і нейтралізує\(\text{HCO}_3^-\) до H 2 CO 3 (див. Рисунок Template:index).
\[\begin{array}{l}{\mathrm{CO}_{3}^{2-}(a q)+2 \mathrm{HCl}(a q) \rightarrow \mathrm{H}_{2} \mathrm{CO}_{3}(a q)+2 \mathrm{Cl}^{-}(a q)} \\ {\mathrm{HCO}_{3}^{-}(a q)+\mathrm{HCl}(a q) \rightarrow \mathrm{H}_{2} \mathrm{CO}_{3}(a q)+\mathrm{Cl}^{-}(a q)}\end{array} \nonumber\]
Оскільки ми знаємо, скільки родимок у зразку, ми можемо обчислити обсяг HCl, який він споживає.\(\text{CO}_3^{2-}\)
\[{5.250 \times 10^{-4} \ \mathrm{mol} \ \mathrm{CO}_{3}^{2-} \times \frac{2 \ \mathrm{mol} \ \mathrm{HCl}}{\mathrm{mol} \ \mathrm{CO}_{3}^{2-}} \times} {\frac{1 \ \mathrm{L} \ \mathrm{HCl}}{0.02812 \ \mathrm{mol} \ \mathrm{HCl}} \times \frac{1000 \ \mathrm{mL}}{\mathrm{L}}=37.34 \ \mathrm{mL} \ \mathrm{HCl}} \nonumber\]
Це залишає 48,12 мл—37,34 мл, або 10,78 мл HCl реагувати з\(\text{HCO}_3^-\). Сума\(\text{HCO}_3^-\) в вибірці дорівнює
\[{(0.02812 \ \mathrm{M \ HCl})(0.01078 \ \mathrm{L} \ \mathrm{HCl}) \times} {\frac{1 \ \mathrm{mol} \ \mathrm{H} \mathrm{CO}_{3}^{-}}{\mathrm{mol} \ \mathrm{HCl}}=3.031 \times 10^{-4} \ \mathrm{mol} \ \mathrm{HCO}_{3}^{-}} \nonumber\]
Зразок містить 315,1\(\text{CO}_3^{2-}\) мг/л і 185,0\(\text{HCO}_3^-\) мг/л
Зразки, що містять суміш монопротичних слабких кислот 2-метиланілінінію хлориду (C 7 H 10 nCl, p K a = 4,447) та 3-нітрофенолу (C 6 H 5 NO 3, p K a = 8,39), можуть бути проаналізовані шляхом титрування з NaOH. Для зразка 2,006-г потрібно 19.65 мл 0,200 М NaOH, щоб досягти кінцевої точки фіолетового бромокрезолу та 48,41 мл 0,200 М NaOH, щоб досягти кінцевої точки фенолфталеїну. Повідомте про %w/w кожної сполуки у зразку.
- Відповідь
-
З двох аналітів 2-метиланілін є сильнішою кислотою і першим реагує з титрантом. Таким чином, титрування до кінцевої точки бромокрезолу фіолетового кольору дає інформацію про кількість 2-метиланілінію в зразку.
\[(0.200\ \mathrm{M} \ \mathrm{NaOH} )(0.01965 \ \mathrm{L}) \times \frac{1 \ \mathrm{mol} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl}}{\mathrm{mol} \ \mathrm{NaOH}} \times \frac{143.61 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl}}{\mathrm{mol} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl}}=0.564 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl} \nonumber\]
\[\frac{0.564 \ \mathrm{g} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl}}{2.006 \ \mathrm{g} \text { sample }} \times 100=28.1 \ \% \mathrm{w} / \mathrm{w} \ \mathrm{C}_{7} \mathrm{H}_{10} \mathrm{NCl} \nonumber\]
Титруючи від кінцевої точки бромокрезолу фіолетового до кінцевої точки фенолфталеїну, загалом 48,41 мл - 19,65 мл = 28,76 мл, дає кількість NaOH, який реагує з 3-нітрофенолом. Кількість 3-нітрофенолу в зразку, отже, становить
\[(0.200 \ \mathrm{M} \ \mathrm{NaOH}) (0.02876 \ \mathrm{L}) \times \frac{1 \ \mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3}}{\mathrm{mol} \ \mathrm{NaOH}} \times \frac{139.11 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3}}{\mathrm{mol} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3}}=0.800 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3} \nonumber\]
\[\frac{0.800 \ \mathrm{g} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3}}{2.006 \ \mathrm{g} \text { sample }} \times 100=39.8 \ \% \mathrm{w} / \mathrm{w} \ \mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NO}_{3} \nonumber\]
Якісні програми
Приклад 9.5 показує, як ми можемо використовувати кислотно-лужне титрування для визначення форм лужності у водах та їх концентрацій. Ми можемо поширити цей підхід і на інші системи. Наприклад, якщо ми титруємо зразок до кінцевої точки метилового апельсина та кінцевої точки фенолфталеїну, використовуючи або сильну кислоту, або сильну основу, ми можемо визначити, які з наступних видів присутні та їх концентрації: H 3 PO 4\(\text{H}_2\text{PO}_4^-\),\(\text{HPO}_4^{2-}\),,\(\text{PO}_4^{3-}\), HCl та NaOH. Як зазначено в таблиці Template:index, кожен вид або суміш видів має унікальну залежність між обсягами титранту, необхідним для досягнення цих двох кінцевих точок. Відзначимо, що суміші, що містять три і більше цих видів, не представляються можливими.
Скористайтеся сходовою схемою, щоб переконати себе в тому, що суміші, що містять три і більше цих видів, нестійкі.
| склад розчину | зв'язок між томами кінцевої точки з сильним базовим титрантом | взаємозв'язок між обсягами кінцевої точки з сильним кислотним титрантом |
|---|---|---|
| Н 3 ПОЗ 4 | \(V_\text{PH} = 2 \times V_\text{MO}\) | — |
| \(\text{H}_2\text{PO}_4^-\) | \(V_\text{PH} > 0; V_\text{MO} = 0\) | — |
| \(\text{HPO}_4^{2-}\) | — | \(V_\text{MO} > 0; V_\text{PH} = 0\) |
| \(\text{PO}_4^{3-}\) | — | \(V_\text{MO} =2 \times V_\text{PH}\) |
| HCl | \(V_\text{PH} = V_\text{MO}\) | — |
| NaOH | — | \(V_\text{MO} = V_\text{PH}\) |
| НСл і Н 3 РО 4 | \(V_\text{PH} < 2 \times V_\text{MO}\) | — |
| Н 3 РО 4 а\(\text{H}_2\text{PO}_4^-\) | \(V_\text{PH} > 2 \times V_\text{MO}\) | — |
| \(\text{H}_2\text{PO}_4^-\)і\(\text{HPO}_4^{2-}\) | \(V_\text{PH} > 0; V_\text{MO} = 0\) | \(V_\text{MO} > 0; V_\text{PH} = 0\) |
| \(\text{HPO}_4^{2-}\)і\(\text{PO}_4^{3-}\) | — | \(V_\text{MO} > 2 \times V_\text{PH}\) |
| \(\text{PO}_4^{3-}\)і NaOH | — | \(V_\text{MO} < 2 \times V_\text{PH}\) |
|
V PH і V MO - це, відповідно, об'єм титранту в кінцевих точках фенолфталеїну та метилового оранжевого коли інформація не надається, гучність в кожній кінцевій точці дорівнює нулю |
||
Характеристика додатків
Окрім кількісного аналізу та якісного аналізу, ми також можемо використовувати кислотно-лужне титрування для характеристики хімічних та фізичних властивостей речовини. Двома корисними додатками для характеризації є визначення еквівалентної ваги сполуки та визначення постійної дисоціації кислоти або постійної її базової дисоціації.
Еквівалентні ваги
Припустимо, ми титруємо зразок нечистої слабкої кислоти до чітко визначеної кінцевої точки, використовуючи монопротну сильну основу як титрант. Якщо припустити, що титрування передбачає перенесення n протонів, то родимки титранта, необхідні для досягнення кінцевої точки, складають
\[\text { moles titrant }=\frac{n \text { moles titrant }}{\text { moles analyte }} \times \text { moles analyte } \nonumber\]
Якщо ми знаємо ідентичність аналіта, ми можемо використовувати це рівняння для визначення кількості аналіту у вибірці
\[\text { grams analyte }=\text { moles titrant } \times \frac{1 \text { mole analyte }}{n \text { moles analyte }} \times F W \text { analyte } \nonumber\]
де FW - вага формули аналіта.
Але що робити, якщо ми не знаємо ідентифікації аналіта? Якщо ми титруємо чистий зразок аналіту, ми можемо отримати деяку корисну інформацію, яка може допомогти нам встановити його ідентичність. Оскільки ми не знаємо кількість протонів, які титруються, ми даємо n = 1 і замінюємо вагу формули аналіту на його еквівалентну вагу (EW)
\[\text { grams analyte }=\text { moles titrant } \times \frac{1 \text { equivalent analyte }}{1 \text { mole analyte }}=E W \text { analyte } \nonumber\]
де
\[F W=n \times E W \nonumber\]
0,2521-г зразка невідомої слабкої кислоти титрують 0,1005 М NaOH, що вимагає 42,68 мл для досягнення кінцевої точки фенолфталеїну. Визначте еквівалентну вагу з'єднання. Яке з перерахованих нижче сполук, швидше за все, є невідомою слабкою кислотою?
| кислота | формула | вага формули (г/моль) | тип |
|---|---|---|---|
| аскорбінова кислота | С 8 Ч 8 З 6 | 176.1 | монопротичний |
| малонова кислота | З 3 Ч 4 З 4 | 104.1 | діпротичний |
| бурштинова кислота | С 4 Н 6 О4 | 118.1 | діпротичний |
| лимонна кислота | С 6 Ч 8 З 7 | 192.1 | трипротичний |
Рішення
Кроти NaOH, необхідні для досягнення кінцевої точки
\[(0.1005 \ \mathrm{M} \ \mathrm{NaOH})(0.04268 \ \mathrm{L} \ \mathrm{NaOH})=4.289 \times 10^{-3} \ \mathrm{mol} \ \mathrm{NaOH} \nonumber\]
Еквіваленти слабкої кислоти такі ж, як і молі NaOH, що використовуються при титруванні; таким чином, еквівалентна вага аналіту дорівнює
\[E W=\frac{0.2521 \ \mathrm{g}}{4.289 \times 10^{-3} \text { equivalents }}=58.78 \ \mathrm{g} / \mathrm{equivalent} \nonumber\]
Можливі формульні ваги для слабкої кислоти - 58,78 г/моль (n = 1), 117,6 г/моль (n = 2) і 176,3 г/моль (n = 3). Якщо аналіт є монопротной слабкою кислотою, то його формульна маса становить 58,78 г/моль, виключаючи аскорбінову кислоту як можливість. Якщо це дипротова слабка кислота, то формульна вага аналіта становить або 58,78 г/моль, або 117,6 г/моль, залежно від того, титрувалася слабка кислота до першої або другої точки еквівалентності. Бурштинова кислота, при формульній масі 118,1 г/моль - це можливість, але малонова кислота - ні. Якщо аналіт являє собою трипротовую слабку кислоту, то його формульна маса становить 58,78 г/моль, 117,6 г/моль, або 176,3 г/моль. Жодне з цих значень не наближається до формули маси для лимонної кислоти, виключаючи її як можливість. Тільки бурштинова кислота забезпечує можливий збіг.
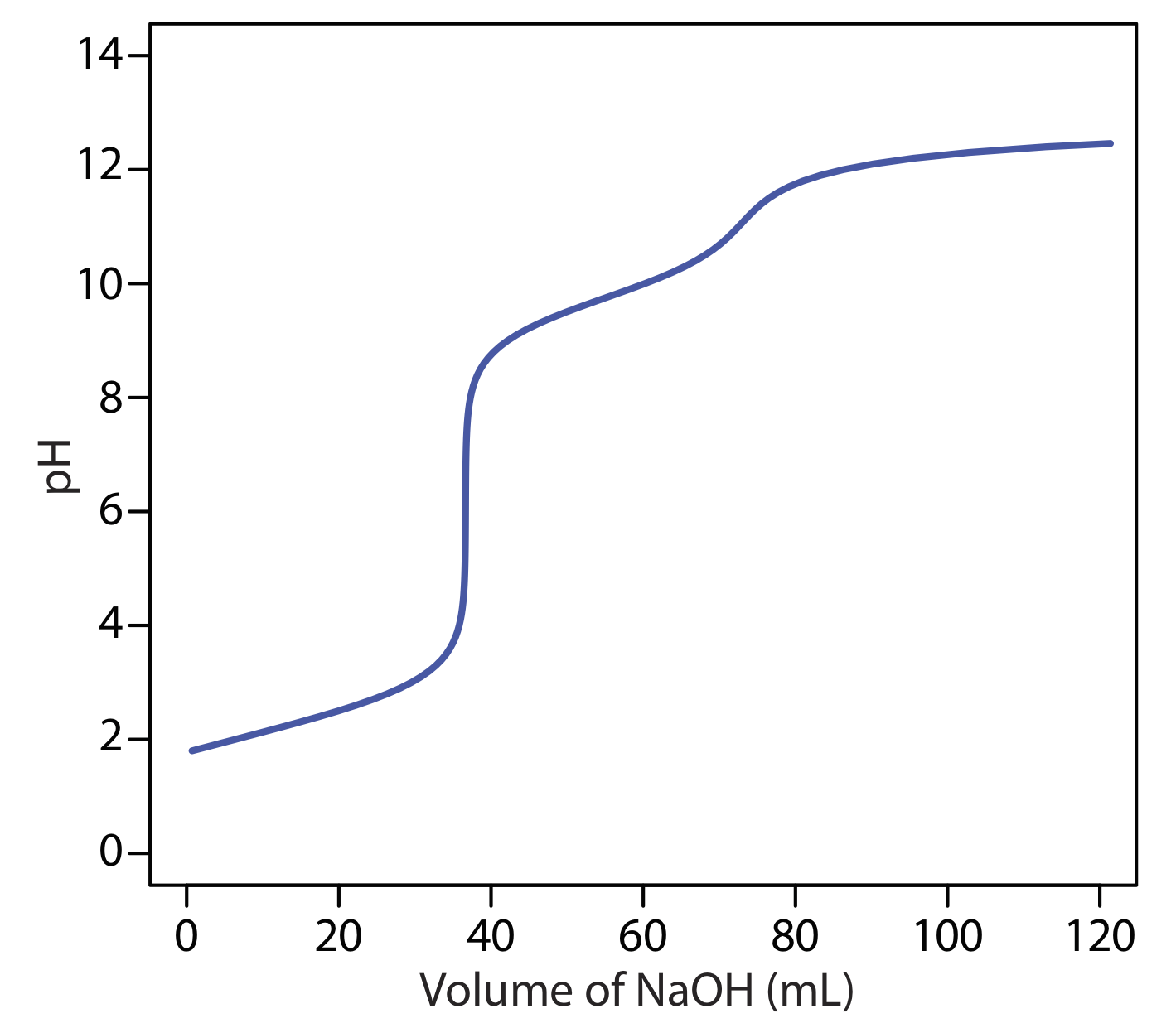
Рисунок Template:index показує потенціометричну криву титрування для титрування 0,500-г зразка невідомої слабкої кислоти. Титрант - 0,1032 М NaOH. Яка еквівалентна вага слабкої кислоти?
- Відповідь
-
Перша з двох видимих кінцевих точок становить приблизно 37 мл NaOH. Таким чином, еквівалентна вага аналіта
\[(0.1032 \ \mathrm{M} \ \mathrm{NaOH})(0.037 \ \mathrm{L}) \times \frac{1 \text { equivalent }}{\mathrm{mol} \ \mathrm{NaOH}}=3.8 \times 10^{-3} \text { equivalents } \nonumber\]
\[E W=\frac{0.5000 \ \mathrm{g}}{3.8 \times 10^{-3} \text { equivalents }}=1.3 \times 10^{2} \ \mathrm{g} / \mathrm{equivalent} \nonumber\]
Константи рівноваги
Іншим застосуванням кислотно-лужної титриметрії є визначення константи дисоціації слабкої кислоти або слабкої основи. Розглянемо, наприклад, розчин оцтової кислоти, СН 3 СООН, для якого константа дисоціації дорівнює
\[K_{\mathrm{a}}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{COO}^{-}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]} \nonumber\]
Коли концентрації СН 3 СООН і СН 3 СОО — рівні, вираз К а зменшується до K a = [H 3 O +], або pH = p K a. Якщо титрувати розчин оцтової кислоти з NaOH, рН дорівнює p K a, коли обсяг NaOH становить приблизно 1⁄2 В екв. Як показано на малюнку Template:index, потенціометрична крива титрування дає обґрунтовану оцінку рівня p K a оцтової кислоти.
Нагадаємо, що pH = p K a - це крок на сходовій діаграмі, яка ділить вісь рН на дві області, одна, де переважаючим видом є слабка кислота, і одна, де її сполученим слабким підставою є переважаючим видом.
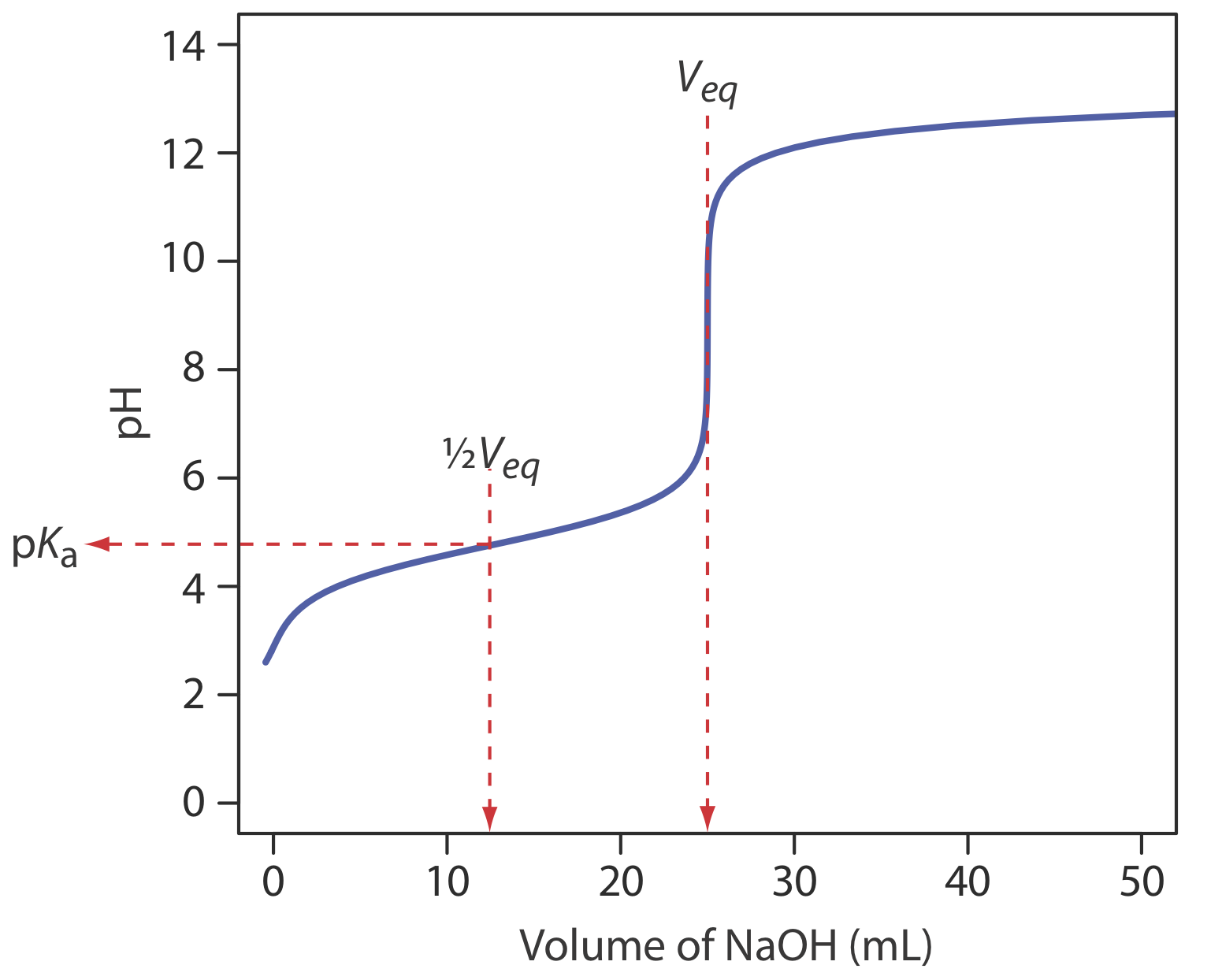
Цей метод дає розумну оцінку для слабкої кислоти р К а, якщо кислота не є ні занадто сильною, ні занадто слабкою. Ці обмеження легко оцінити, якщо розглядати два обмежувальних випадки. Для першого граничного випадку припустимо, що слабка кислота, HA, більш ніж на 50% дисоціюється до початку титрування (відносно велике значення K a); в цьому випадку концентрація ГК до точки еквівалентності завжди менше концентрації А - і є немає точки на кривій титрування, де [HA] = [A —]. З іншого боку, якщо кислота занадто слабка, то менше 50% слабкої кислоти реагує з титрантом в точці еквівалентності. При цьому концентрація ГК перед точкою еквівалентності завжди більша, ніж у А —. Визначення р К а методом точки напівеквівалентності завищує її значення, якщо кислота занадто сильна і занижує її значення, якщо кислота занадто слабка.
Використовуйте потенціометричну криву титрування на рисунку Template:index для оцінки значень p K a для слабкої кислоти у Вправі Template:index.
- Відповідь
-
При 1⁄2 В екв, або приблизно 18,5 мл, рН становить приблизно 2,2; таким чином, ми оцінюємо, що р К а аналіту дорівнює 2,2.
Другий підхід для визначення слабкої кислоти р К а полягає у використанні ділянки Гран. Наприклад, раніше в цьому розділі ми вивели наступне рівняння титрування слабкої кислоти з сильною основою.
\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] \times V_{b}=K_{a} V_{e q}-K_{a} V_{b} \nonumber\]
Ділянка [H 3 O +]\(\times\) V b проти V b для об'ємів, менших за точку еквівалентності, дає пряму лінію з нахилом — K a. Були розроблені інші лінеаризації, які використовують всю криву титрування або які не вимагають припущень [(a) Гонсалес, А.Г.; Asuero, A.G. Чим. Акт 1992 р., 256, 29—33; (б) Папанастасіу, Г.; Зіогас, І.; Коккіндіс, Г. Чим. Акт 1993, 277, 119—135]. Цей підхід до визначення константи кислотності був використаний для вивчення кислотно-лужних властивостей гумінових кислот, які є природними, великими молекулярними органічними кислотами з множинними кислотними ділянками. В одному дослідженні було виявлено, що гумінова кислота має шість титруваних ділянок, три яких були ідентифіковані як карбонові кислоти, дві, які вважалися вторинними або третинними амінами, і один, який був ідентифікований як фенольна група [Алексіо, Л.М.; Godinho, O.E. S.; da Costa, WF Anal. Чим. Акт 1992, 257, 35—39].
Значення K a, визначені цим методом, можуть мати істотну похибку, якщо ефект активності ігнорується. Див. Розділ 6.9 для обговорення діяльності.
Оцінка кислотно-базисної титриметрії
Масштаб операції
При кислотно-луговому титруванні обсяг титранту, необхідний для досягнення точки еквівалентності, пропорційний молям титранду. Оскільки рН титранду або титранту є функцією його концентрації, зміна рН у точці еквівалентності - і, отже, доцільність титрування кислотно-основи - залежить від їх відповідних концентрацій. Наприклад, на малюнку Template:index} показано ряд кривих титрування для титрування декількох концентрацій HCl з еквимолярними розчинами NaOH. Для концентрацій титранду і титранту менше 10 —3 М зміна рН в кінцевій точці занадто мала, щоб забезпечити точний і точний результат.
Кислотно-базова титриметрія є прикладом загальної методики аналізу, в якій сигнал пропорційний абсолютній кількості аналіту. Див. Розділ 3 для обговорення різниці між методами загального аналізу та методами концентрації.
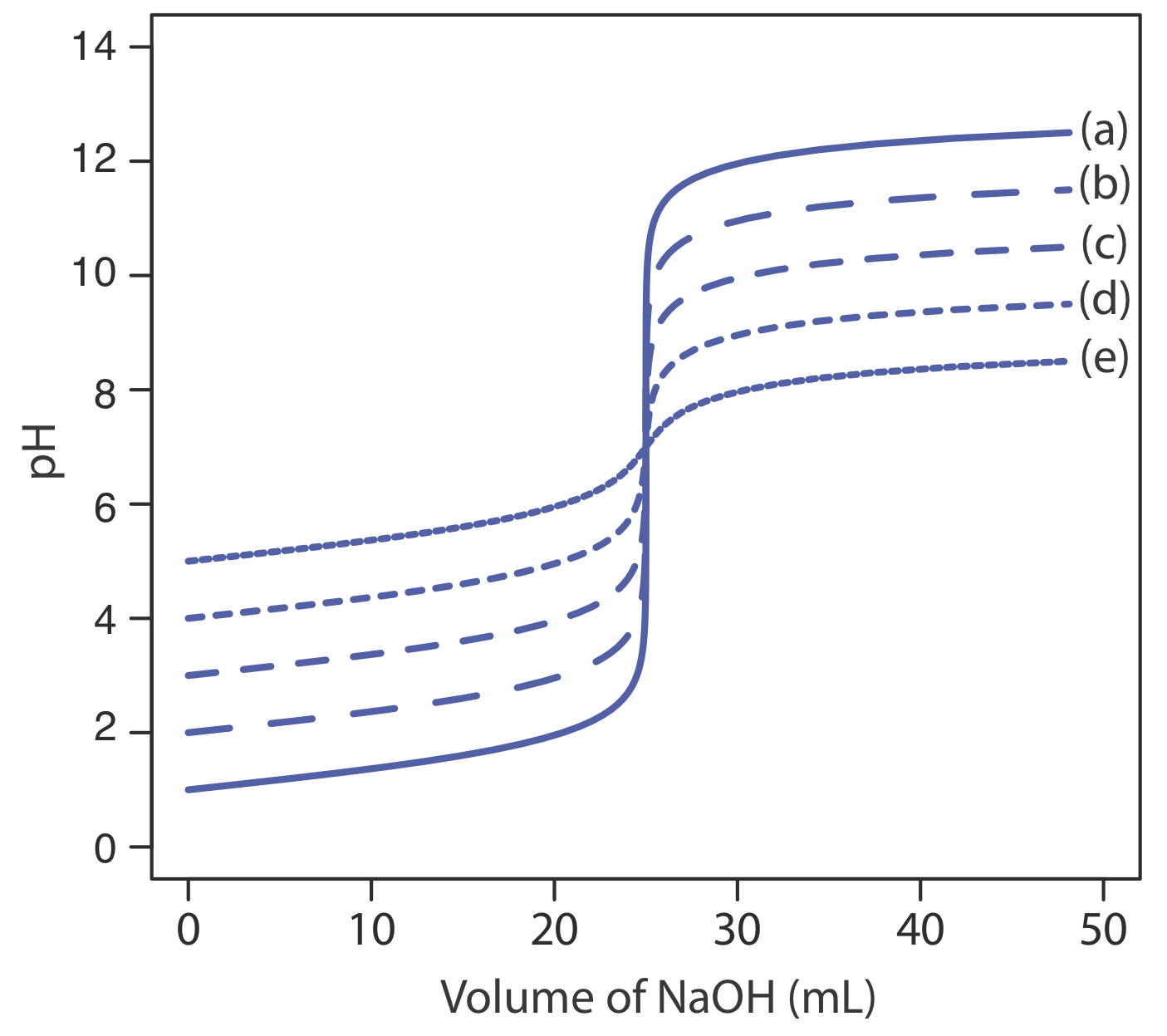
Мінімальна концентрація 10 —3 М встановлює обмеження на найменшу кількість аналіту, який ми можемо успішно проаналізувати. Наприклад, припустимо, що наш аналіт має формулу вага 120 г/моль. Для успішного контролю кінцевої точки титрування за допомогою індикатора або pH-зонда титранду потрібен початковий об'єм приблизно 25 мл. Якщо припустити, що вага формули аналіта становить 120 г/моль, то кожен зразок повинен містити не менше 3 мг аналіту. З цієї причини титрування кислотно-основними, як правило, обмежуються основними та незначними аналітами. Ми можемо розширити аналіз газів, щоб простежити аналіти, витягнувши великий обсяг газу через відповідний розчин для збору.
Нам потрібен обсяг титранду, достатній для покриття кінчика pH-зонда або для легкого спостереження за кольором індикатора. Обсяг 25 мл - це не необгрунтована оцінка мінімального обсягу.
Однією з цілей аналітичної хімії є поширення аналізів на менші зразки. Тут ми опишемо два цікавих підходу до титрування зразків мкл і pL. В одній експериментальній конструкції (рис. Template:index) зразки 20-100 мкл утримуються капілярною дією між електродом з плоскою поверхнею рН і етапом зразка з нержавіючої сталі [Steele, A.; Hieftje, G.M. Anal. Хім. 1984, 56, 2884—2888]. Титрант додається за допомогою коливань п'єзоелектричного керамічного пристрою для переміщення кутового скляного стрижня всередину та з трубки, з'єднаної з резервуаром, який містить титрант. Кожен раз, коли зі скляної трубки вилучається приблизно 2 нЛ мікрокрапелька титранту. Мікрокраплі дозволяється потрапляти на зразок, при цьому змішування здійснюється шляхом віджимання стадії зразка при 120 об/хв. Всього між кожним вимірюванням рН розподіляється 450 мікрокрапель із комбінованим об'ємом 0,81-0,84 мкл. Таким чином будується крива титрування. Цей метод був використаний для титрування розчинів 0,1 М HCl і 0,1 M CH 3 COOH з 0,1 М NaOH. Абсолютні похибки коливалися від мінімуму +0,1% до максимуму — 4,1%, при відносних стандартних відхиленнях від 0,15% до 4,7%. Зразки розміром 20 мкл були успішно титровані.
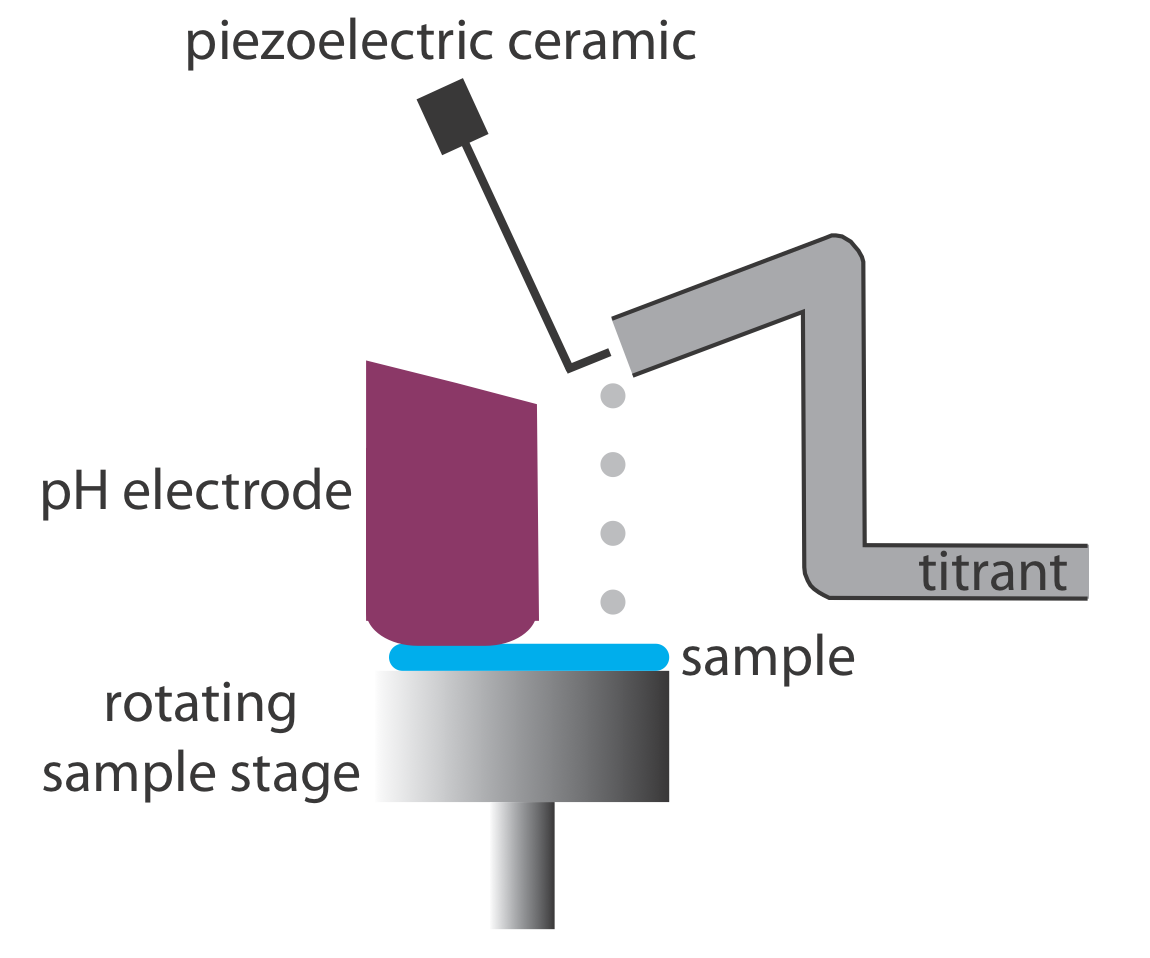
Інший підхід здійснює кислотно-лужне титрування в одній краплі розчину [(a) Gratzl, M.; Yi, C. Хім. 1993, 65, 2085—2088; (б) Йі, С; Грацль, М.анал. Хім. 1994, 66, 1976—1982; (c) Хуей, К.Ю.; Грацль, М.анал. Хім. 1997, 69, 695—698; (г) Йі, С.; Хуан, Д.; Грацль, М. анал. Хім. 1996, 68, 1580—1584; (е) Се, Х.; Грацль, М. анал. Хім. 1996, 68, 3665—3669]. Титрант доставляється за допомогою мікробурета, виготовленого зі скляного капілярного мікропіпету (Рисунок Template:index). Мікробурет має наконечник 1-2 мкм, наповнений мембраною агарового гелю. Наконечник мікробурета поміщають всередину краплі розчину зразка, який підвішений в гептані, і титранту дають дифузії в пробу. Прогрес титрування контролюється за допомогою кислотно-базового індикатора і вимірюється час, необхідний для досягнення кінцевої точки. Швидкість дифузії титранта з мікробурета визначається попередньою калібруванням. Після калібрування час кінцевої точки перетворюється на об'єм кінцевої точки. Зразки зазвичай складаються з об'ємів піколітра (10-12 літрів), при цьому найменший зразок становить 0,7 пЛ. Точність титрування становить близько 2%.
Титрування, проведені за допомогою мікролітрових або піколітрових обсягів проби, вимагають меншої абсолютної кількості аналіту. Наприклад, дифузійні титрування проводилися лише на 29 фемтомолах (10 —15 молів) азотної кислоти. Тим не менш, аналіт повинен бути присутнім у зразку на великому або незначному рівні, щоб титрування давало точні та точні результати.
Точність
При роботі з макро-мажорним або макро-незначним зразком титрування кислотно-основи може досягти відносної похибки 0,1— 0,2%. Основним обмеженням точності є різниця між кінцевою точкою і точкою еквівалентності.
Точність
Відносна точність кислотно-основного титрування залежить насамперед від точності, з якою ми можемо виміряти об'єм кінцевої точки та точність виявлення кінцевої точки. В оптимальних умовах кислотно-лужне титрування має відносну точність 0,1— 0,2%. Ми можемо поліпшити відносну точність, використовуючи максимально можливий бюрет і гарантуючи, що ми використовуємо більшу частину його потужності для досягнення кінцевої точки. Бюрет меншого обсягу є кращим вибором при використанні дорогих реагентів, коли утилізація відходів викликає занепокоєння або коли ми повинні швидко завершити титрування, щоб уникнути конкуруючих хімічних реакцій. Автоматичний титратор особливо корисний для титрування, які вимагають невеликих обсягів титранту, оскільки він забезпечує значно кращу точність (зазвичай близько ± 0,05% обсягу бюрета).
Точність виявлення кінцевої точки залежить від того, як вона вимірюється, і нахилу кривої титрування в кінцевій точці. З індикатором точність сигналу кінцевої точки зазвичай становить ± 0,03-0,10 мл. Потенціометричні кінцеві точки зазвичай більш точні.
Чутливість
Для кислотно-основного титрування ми можемо написати наступне загальне аналітичне рівняння, щоб висловити об'єм титранту через кількість титранду
\[\text { volume of titrant }=k \times \text { moles of titrand } \nonumber\]
де k, чутливість, визначається стехіометрією між титрандом і титрантом. Розглянемо, наприклад, визначення сірчистої кислоти, H 2 SO 3, шляхом титрування з NaOH до першої точки еквівалентності
\[\mathrm{H}_{2} \mathrm{SO}_{3}(a q)+\mathrm{OH}^{-}(a q) \rightarrow \mathrm{H}_{2} \mathrm{O}(l )+\mathrm{HSO}_{3}^{-}(a q) \nonumber\]
У точці еквівалентності співвідношення між родимками NaOH і родимками H 2 SO 3 становить
\[\mathrm{mol} \ \mathrm{NaOH}=\mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{3} \nonumber\]
Підстановка молярності і обсягу титранта на родимки NaOH і перестановка
\[M_{\mathrm{NaOH}} \times V_{\mathrm{NNOH}}=\mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{3} \nonumber\]
\[V_{\mathrm{NaOH}}=\frac{1}{M_{\mathrm{NaOH}}} \times \mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{3} \nonumber\]
ми знаходимо, що k
\[k=\frac{1}{M_{\mathrm{NaOH}}} \nonumber\]
Є два способи, за допомогою яких ми можемо покращити чутливість титрування. Перший, і найбільш очевидний, полягає в зменшенні концентрації титранта, оскільки вона обернено пропорційна чутливості, k. Другий підхід, який застосовується лише в тому випадку, якщо титранд мультипротичний, полягає в титруванні до більш пізньої точки еквівалентності. Якщо титрувати H 2 SO 3 до другої точки еквівалентності
\[ \mathrm{H}_{2} \mathrm{SO}_{3}(a q)+2 \mathrm{OH}^{-}(a q) \rightarrow 2 \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{SO}_{3}^{2-}(a q)\nonumber\]
то кожен моль H 2 SO 3 споживає два молі NaOH
\[\mathrm{mol} \ \mathrm{NaOH}=2 \times \mathrm{mol} \ \mathrm{H}_{2} \mathrm{SO}_{3} \nonumber\]
і чутливість стає
\[k=\frac{2}{M_{\mathrm{NaOH}}} \nonumber\]
Однак на практиці будь-яке поліпшення чутливості компенсується зниженням точності кінцевої точки, якщо більший обсяг титранту вимагає від нас поповнення бюрета. З цієї причини стандартні титриметричні процедури кислотно-основи написані, щоб гарантувати, що титрування використовує 60— 100% обсягу бюрета.
Вибірковість
Титранти на кислотній основі не є селективними. Наприклад, сильний базовий титрант реагує з усіма кислотами в пробі, незалежно від їх індивідуальних сильних сторін. Якщо титранд містить аналіт і інтерферент, то селективність залежить від їх відносної кислотної сили. Розглянемо дві обмежувальні ситуації.
Якщо аналіт є сильнішою кислотою, ніж інтерферент, то титрант буде реагувати з аналітом, перш ніж він почне реагувати з інтерферентом. Доцільність аналізу залежить від того, чи впливає реакція титранта з інтерферентом на точне розташування точки еквівалентності аналіта. Якщо константи дисоціації кислоти істотно відрізняються, кінцева точка для аналіта може бути визначена точно. І навпаки, якщо константи дисоціації кислоти для аналіту та інтерференту схожі, то для аналіту може не бути точної кінцевої точки. В останньому випадку кількісний аналіз на аналіт неможливий.
У другій граничній ситуації аналіт є слабшою кислотою, ніж інтерферент. У цьому випадку обсяг титранту, необхідний для досягнення точки еквівалентності аналіта, визначається концентрацією як аналіту, так і інтерференту. Щоб врахувати внесок інтерферента в кінцеву точку, кінцева точка для інтерференту повинна бути доступна. Знову ж таки, якщо константи дисоціації кислоти для аналіта і інтерферента значно відрізняються, то визначення аналіта можливо. Однак, якщо константи дисоціації кислоти подібні, існує лише одна точка еквівалентності, і ми не можемо відокремити внесок аналіта та інтерферента в об'єм точки еквівалентності.
Час, вартість та обладнання
Титрування на кислотній основі вимагають менше часу, ніж більшість гравіметричних процедур, але більше часу, ніж багато інструментальних методів аналізу, особливо при аналізі багатьох зразків. Однак з автоматичним титратором занепокоєння щодо часу аналізу є менш значними. Виконуючи титрування вручну, наше обладнання потребує - бюрет і, можливо, рН-метр - мало, недорогі, регулярно доступні та прості в обслуговуванні. Автоматичні титратори доступні за ціною від 3000 до 10 000 доларів.
