9.1: Огляд титриметрії
- Page ID
- 24847
У титриметрії ми додаємо реагент, званий титрантом, до розчину, який містить інший реагент, званий титрандом, і дозволяємо їм реагувати. Тип реакції дає нам простий спосіб розділити титриметрію на чотири категорії: кислотно-лужні титрування, при яких кислий або основний титрант реагує з титрандом, який є основою або кислотою; комплексометричні титрування, які засновані на комплексуванні метал-ліганд; окислювально-відновні титрування, в яких титрант є окислювачем або відновником; і осадження титрування, при яких титранд і титрант утворюють осад.
Ми навмисно уникнемо терміна аналіт на цьому етапі у нашому вступі до титриметрії. Хоча в більшості титрувань аналітом є титранд, існують обставини, коли аналіт є титрантом. Пізніше, коли ми обговоримо конкретні титриметричні методи, ми будемо використовувати термін аналіт, де це доречно.
Незважаючи на їх відмінність в хімії, все титрування мають кілька спільних рис. Перш ніж більш детально розглянути окремі титриметричні методи, давайте розглянемо деякі з цих подібностей. Під час роботи з цим розділом цей огляд допоможе вам зосередитися на подібності між різними титриметричними методами. Вам буде легше зрозуміти новий аналітичний метод, коли ви зможете побачити його зв'язок з іншими подібними методами.
Точки еквівалентності та кінцеві точки
Якщо титрування має дати точний результат, ми повинні об'єднати титран і титрант у стехіометрично еквівалентних кількостях. Ми називаємо цю стехіометричну суміш точкою еквівалентності. На відміну від гравіметрії опадів, де ми додаємо осадник в надлишку, точне титрування вимагає, щоб ми знали точний об'єм титранту в точці еквівалентності, V екв. Твір об'єму точки еквівалентності титранта та його молярності, M T, дорівнює молям титранту, які реагують з титрандом.
\[\text { moles titrant }=M_{T} \times V_{e q} \nonumber\]
Якщо нам відома стехіометрія реакції титрування, то можна обчислити родимки титранду.
На жаль, для більшості реакцій титрування немає явної ознаки, коли ми досягаємо точки еквівалентності. Натомість ми припиняємо додавати титрант в кінцевій точці нашого вибору. Часто ця кінцева точка є зміною кольору речовини, званої індикатором, який ми додаємо в розчин титранда. Різниця між об'ємом кінцевої точки та об'ємом точки еквівалентності є визначеною помилкою титрування. Якщо об'єми кінцевої точки і точки еквівалентності збігаються впритул, то ця помилка незначна і сміливо ігнорується. Зрозуміло, що вибір відповідної кінцевої точки має вирішальне значення.
Гучність як сигнал
Замість того, щоб вимірювати об'єм титранта, ми можемо вибрати його масу. Хоча, як правило, ми можемо виміряти масу точніше, ніж ми можемо виміряти обсяг, простота об'ємного титрування робить його більш популярним вибором.
Практично будь-яка хімічна реакція може служити титриметричним методом за умови, що вона відповідає наступним чотирьом умовам. Перша умова полягає в тому, що ми повинні знати стехіометрію між титрантом і титрандом. Якщо це не так, то ми не можемо перетворити родимки титранту, що використовуються для досягнення кінцевої точки, на родимки титранду в нашому зразку. По-друге, реакція титрування ефективно повинна переходити до завершення; тобто стехіометричне змішування титранту і титранду повинно привести до їх повної реакції. По-третє, реакція титрування повинна відбуватися швидко. Якщо додати титрант швидше, ніж він може реагувати з титрандом, то кінцева точка і точка еквівалентності будуть значно відрізнятися. Нарешті, ми повинні мати відповідний метод для точного визначення кінцевої точки. Це суттєві обмеження, і з цієї причини існує кілька загальних стратегій титрування.
Залежно від того, як ми виявляємо кінцеву точку, ми можемо зупинити титрування занадто рано або занадто пізно. Якщо кінцева точка є функцією концентрації титранта, то додавання титранту занадто швидко призводить до ранньої кінцевої точки. З іншого боку, якщо кінцева точка є функцією концентрації титранду, то кінцева точка перевищує точку еквівалентності.
Простим прикладом титрування є аналіз на Ag + з використанням тиоцианату, SCN —, як титранту.
\[\mathrm{Ag}^{+}(a q)+\mathrm{SCN}^{-}(a q)\rightleftharpoons\mathrm{Ag}(\mathrm{SCN})(s) \nonumber\]
Ця реакція відбувається швидко і при відомій стехіометрії, яка задовольняє двом нашим вимогам. Щоб вказати кінцеву точку титрування, ми додаємо невелику кількість Fe 3 + до розчину аналіта перед тим, як почати титрування. Коли реакція між Ag + і SCN — завершена, формування комплексу червоного кольору Fe (SCN) 2+ сигналізує про кінцеву точку. Це приклад прямого титрування, оскільки титрант безпосередньо реагує з аналітом.
Це приклад титрування опадів. Більше інформації про титрування опадів ви знайдете далі в цьому розділі.
Якщо реакція титрування занадто повільна, при відсутності відповідного показника або при відсутності корисної реакції прямого титрування, то може бути можливий непрямий аналіз. Припустимо, ви бажаєте визначити концентрацію формальдегіду, Н 2 СО, у водному розчині. Окислення Н 2 СО шляхом\(\text{I}_3^-\)
\[\mathrm{H}_{2} \mathrm{CO}(a q)+\mathrm{I}_{3}^-(a q)+3 \mathrm{OH}^{-}(a q)\rightleftharpoons\mathrm{HCO}_{2}^{-}(a q)+3 \mathrm{I}^{-}(a q)+2 \mathrm{H}_{2} \mathrm{O}(1) \nonumber\]
є корисною реакцією, але вона занадто повільна для титрування. Якщо ми додамо відомий надлишок\(\text{I}_3^-\) і дозволимо його реакції з Н 2 СО йти до завершення, ми можемо титрувати не прореагував\(\text{I}_3^-\) тіосульфатом,\(\text{S}_2\text{O}_3^{2-}\).
\[\mathrm{I}_{3}^{-}(a q)+2 \mathrm{S}_{2} \mathrm{O}_{3}^{2-}(a q)\rightleftharpoons\mathrm{S}_{4} \mathrm{O}_{6}^{2-}(a q)+3 \mathrm{I}^{-}(a q) \nonumber\]
Різниця між початковою кількістю\(\text{I}_3^-\) та надлишковою кількістю дає нам кількість\(\text{I}_3^-\), яка реагує з формальдегідом. Це приклад зворотного титрування.
Це приклад окислювально-відновного титрування. Ви знайдете більше інформації про окислювально-відновні титрування пізніше в цьому розділі.
Іони кальцію відіграють важливу роль у багатьох системах навколишнього середовища. Прямий аналіз на Ca 2 + може скористатися його реакцією з лігандом етилендіамінтетраоцтової кислоти (ЕДТА), яку ми представляємо тут як Y 4—.
\[\mathrm{Ca}^{2+}(a q)+\mathrm{Y}^{4-}(a q)\rightleftharpoons\mathrm{CaY}^{2-}(a q) \nonumber\]
На жаль, для більшості зразків це титрування не має корисного показника. Замість цього ми реагуємо на Ca 2 + з надлишком mGY 2—
\[\mathrm{Ca}^{2+}(a q)+\mathrm{MgY}^{2-}(a q)\rightleftharpoons\mathrm{Ca} \mathrm{Y}^{2-}(a q)+\mathrm{Mg}^{2+}(a q) \nonumber\]
вивільняючи кількість Mg 2 +, еквівалентну кількості Са 2+ в зразку. Тому що титрування Mg 2 + з ЕДТА
\[\mathrm{Mg}^{2+}(a q)+\mathrm{Y}^{4-}(a q)\rightleftharpoons\mathrm{MgY}^{2-}(a q) \nonumber\]
має відповідну кінцеву точку, ми можемо завершити аналіз. Кількість ЕДТА, що використовується при титруванні, забезпечує непряму міру кількості Са 2 + у вихідному зразку. Оскільки вид, який ми титруємо, був витіснений аналітом, ми називаємо це титруванням витіснення.
MgY 2— це комплекс метал-ліганд Mg 2 + —ЕДТА. Приготувати розчин MgY 2— можна шляхом комбінування еквимолярних розчинів Mg 2 + і ЕДТА. Це приклад комплексоутворення титрування. Більше інформації про титрування комплексоутворення ви знайдете далі в цьому розділі.
Якщо відповідної реакції з аналітом не існує, можливо, можна створити вид, який ми можемо титрувати. Наприклад, ми можемо визначити вміст сірки в вугіллі за допомогою реакції горіння для перетворення сірки в діоксид сірки.
\[\mathrm{S}(s)+\mathrm{O}_{2}(g) \rightarrow \mathrm{SO}_{2}(g) \nonumber\]
а потім перетворити SO 2 в сірчану кислоту, H 2 SO 4, шляхом барботирування її через водний розчин пероксиду водню, Н 2 О 2.
\[\mathrm{SO}_{2}(g)+\mathrm{H}_{2} \mathrm{O}_{2}(a q) \longrightarrow \mathrm{H}_{2} \mathrm{SO}_{4}(a q) \nonumber\]
Титрування H 2 SO 4 з NaOH
\[\mathrm{H}_{2} \mathrm{SO}_{4}(a q)+2 \mathrm{NaOH}(a q)\rightleftharpoons2 \mathrm{H}_{2} \mathrm{O}(l )+\mathrm{Na}_{2} \mathrm{SO}_{4}(a q) \nonumber\]
забезпечує непряме визначення сірки.
Це приклад кислотно-основного титрування. Докладнішу інформацію про титрування на основі кислоти ви знайдете далі в цьому розділі.
Криві титрування
Щоб знайти кінцеву точку титрування, нам потрібно контролювати деяку властивість реакції, яка має чітко визначене значення в точці еквівалентності. Наприклад, точка еквівалентності титрування HCl з NaOH відбувається при рН 7,0. Простим методом знаходження точки еквівалентності є моніторинг рН титрувальної суміші за допомогою pH-електрода, зупиняючи титрування, коли ми досягаємо рН 7,0. Крім того, ми можемо додати індикатор до розчину титранду, який змінює колір при рН 7,0.
Чому рН 7,0 є точкою еквівалентності для цього титрування - це тема, яку ми розглянемо пізніше в розділі про кислотно-лужні титрування.
Припустимо, єдиний доступний індикатор змінює колір при рН 6,8. Чи є різниця між цією кінцевою точкою і точкою еквівалентності достатньо мала, щоб ми могли безпечно ігнорувати помилку титрування? Щоб відповісти на це питання, нам потрібно знати, як змінюється рН під час титрування.
Крива титрування дає візуальну картину того, як змінюється властивість реакції титрування, коли ми додаємо титрант до титранду. Крива титрування на малюнку Template:index, наприклад, була отримана шляхом суспензії pH-електрода в розчині 0,100 М HCl (титранд) та моніторингу рН при додаванні 0,100 М NaOH (титрант). Уважне вивчення цієї кривої титрування повинно переконати вас, що кінцева точка рН 6,8 створює незначну помилку титрування. Однак вибір рН 11,6 в якості кінцевої точки призводить до неприпустимо великої помилки титрування.
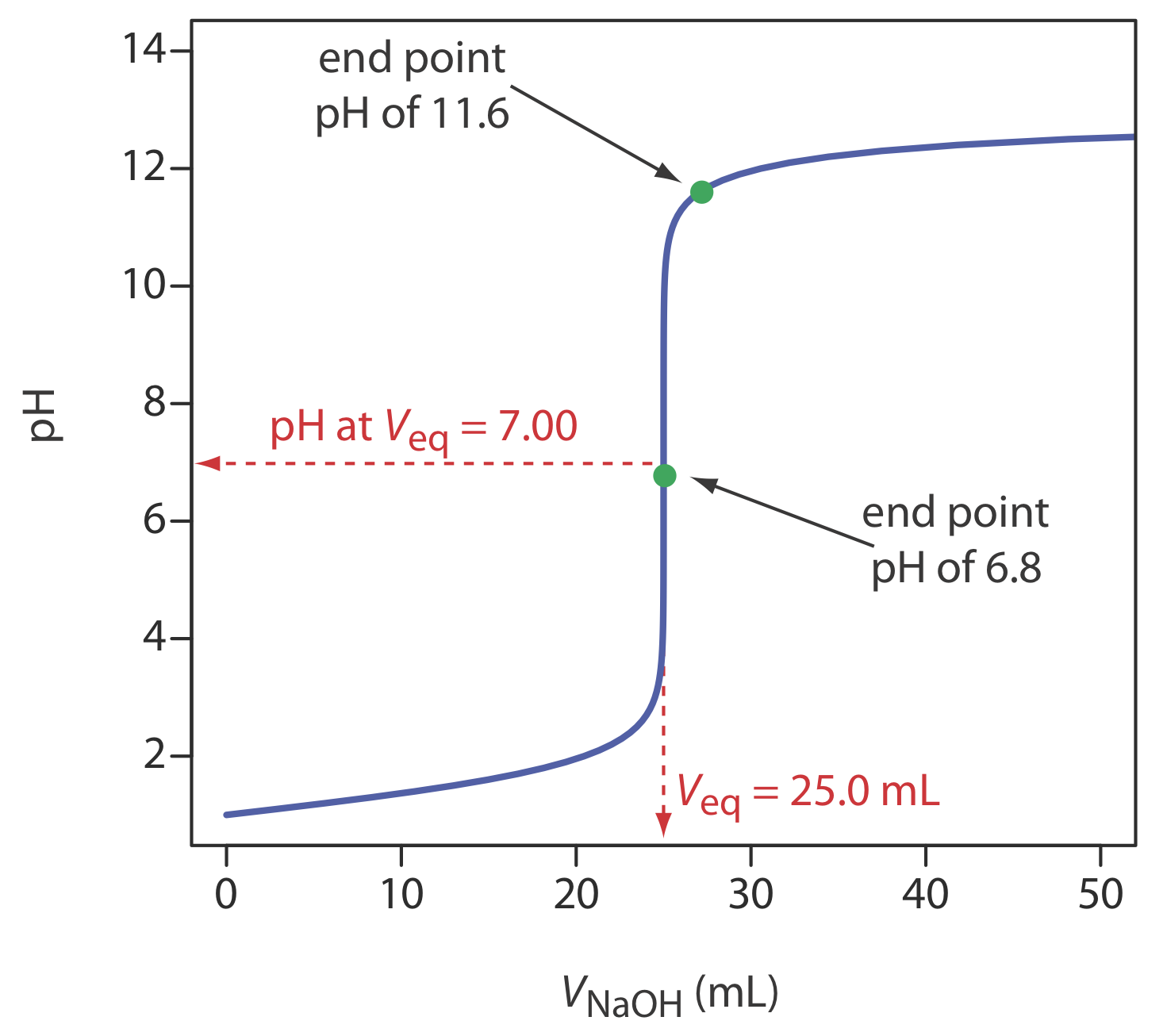
Для кривої титрування на рисунку Template:index об'єм титранту до рН 6,8 становить 24,99995 мл, похибка\(-2.00 \times 10^{-4}\) титрування% відносно точки еквівалентності 25,00 мл. Зазвичай ми можемо зчитувати обсяг лише до найближчого ± 0,01 мл, що означає, що ця невизначеність занадто мала, щоб вплинути на наші результати. Обсяг титранту для досягнення рН 11,6 становить 27,07 мл, або похибка титрування +8,28%. Це суттєва помилка.
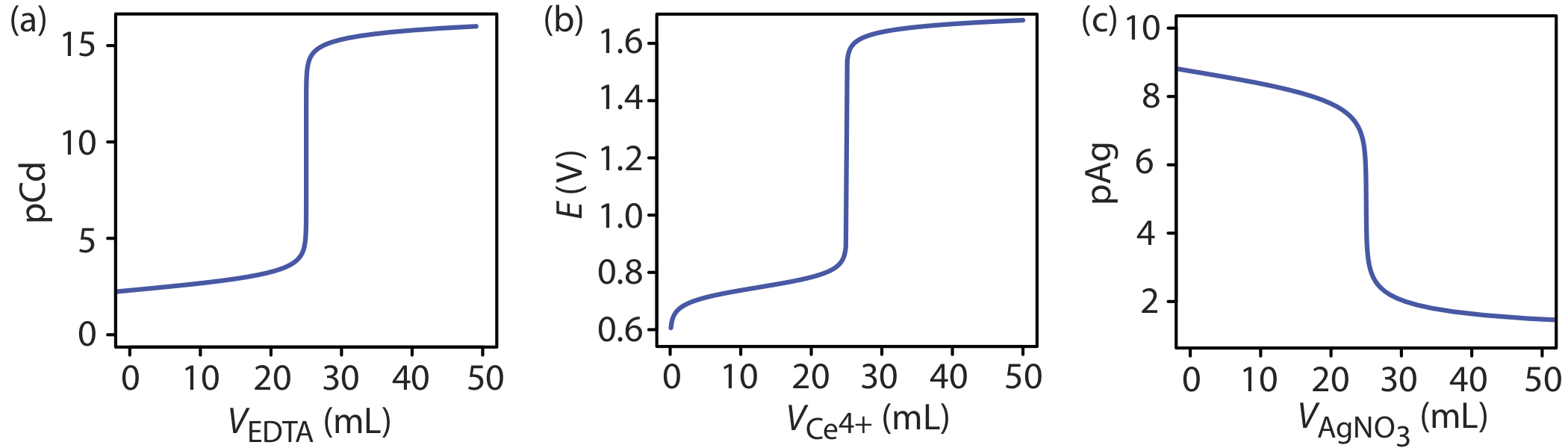
Форма кривої титрування на малюнку Template:index не є унікальною для кислотно-основного титрування. Будь-яка крива титрування, яка слідує за зміною концентрації виду в реакції титрування (побудована логарифмічно) як функція об'єму титранта, має однакову загальну сигмоїдальну форму. Кілька додаткових прикладів наведено на рисунку Template:index.
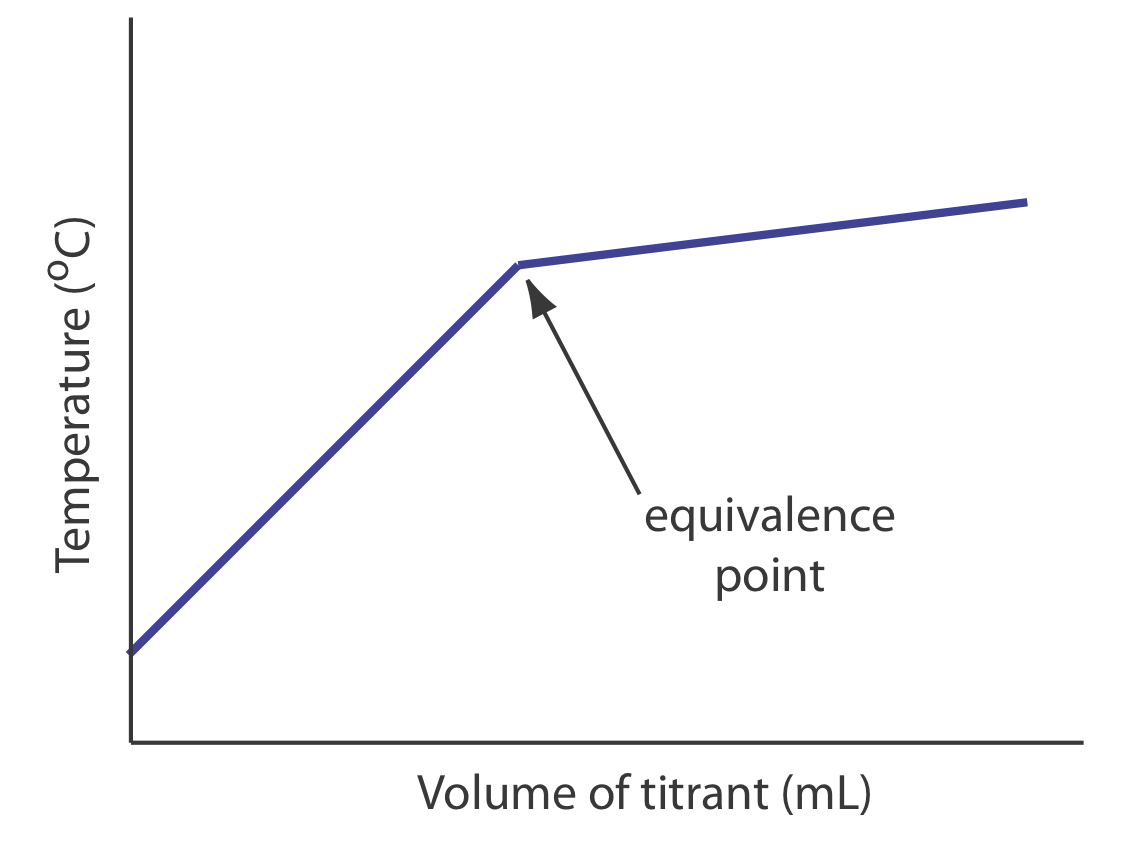
Концентрація титранду або титранту - не єдина властивість, яку ми можемо використовувати для запису кривої титрування. Інші параметри, такі як температура або поглинання розчину титранда, можуть забезпечити корисний сигнал кінцевої точки. Наприклад, багато реакцій титрування кислотно-основи є екзотермічними. У міру реагування титранта і титранда температура розчину титранда підвищується. Як тільки ми досягнемо точки еквівалентності, подальші додавання титранту не виробляють як екзотермічну відповідь. Рисунок Template:index показує типову термометричну криву титрування, де перетин двох лінійних сегментів вказує на точку еквівалентності.
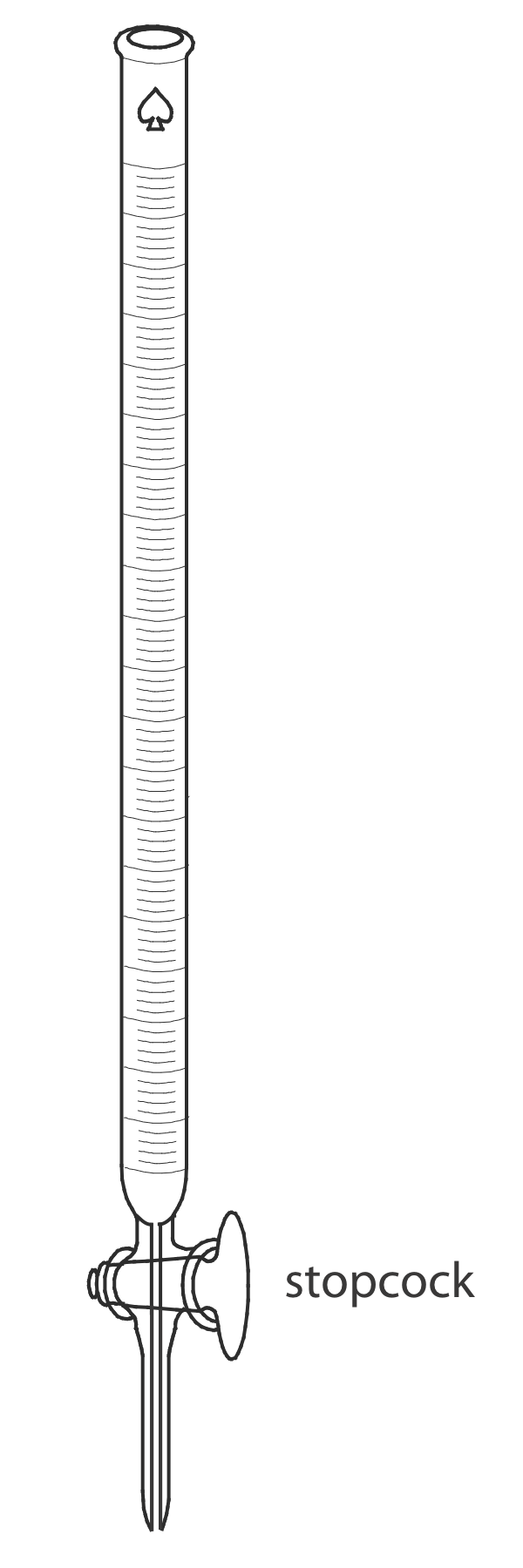
Бюрет
Єдиним необхідним обладнанням для кислотно-основного титрування є засіб для доставки титранту до розчину титранду. Найбільш поширеним методом доставки титранту є бюрет (рис. Template:index), який представляє собою довгу вузьку трубку з градуйованою маркуванням і оснащена запірним краном для дозування титранта. Невеликий внутрішній діаметр бюрета забезпечує більш чіткий меніск, що полегшує точне читання обсягу титранта. Бюретки доступні в різних розмірах і допусках (Таблиця Template:index), при цьому вибір бюрета визначається потребами аналізу. Ви можете підвищити точність бюрета, калібруючи його в декількох проміжних діапазонах об'ємів, використовуючи метод, описаний у розділі 5 для калібрування піпетів. Калібрування бюрета виправляє зміни внутрішнього діаметра бюрета.
| Обсяг (мл) | клас | підрозділ (мл) | толерантність (\(\pm\)) |
|---|---|---|---|
| 5 | A | 0,01 | \ (\ pm\))» клас = "лт-хім-165342">
± 0,01 |
| Б | 0,01 | \ (\ pm\))» клас = "лт-хім-165342">
± 0,01 |
|
| 10 | A | 0,02 | \ (\ pm\)) "> ± 0,02 |
| Б | 0,02 | \ (\ pm\)) "> ± 0,04 | |
| 25 | A | 0.1 | \ (\ pm\)) "> ± 0,03 |
| Б | 0.1 | \ (\ pm\)) "> ± 0,06 | |
| 50 | A | 0.1 | \ (\ pm\)) "> ± 0,05 |
| Б | 0.1 | \ (\ pm\)) "> ± 0,10 | |
| 100 | A | 0.2 | \ (\ pm\)) "> ± 0,10 |
| Б | 0.2 | \ (\ pm\)) "> ± 0,20 |
Автоматизоване титрування використовує насос для подачі титранту з постійною швидкістю потоку (рис. Template:index). Автоматизовані титрування пропонують додаткову перевагу використання мікрокомп'ютера для зберігання та аналізу даних.

