28.6: Іонообмінна хроматографія
- Page ID
- 27327
В іонообмінній хроматографії (IEC) стаціонарною фазою є зшита полімерна смола, як правило, дивінілбензол-зшитий полістирол, з ковалентно прикріпленими іонними функціональними групами (див. Рисунок Template:index і Таблиця {{Template.index (ID:1)}). Контрайони до цих фіксованих зарядів рухливі і витісняються іонами, які більш сприятливо конкурують для обмінних майданчиків. Іонообмінні смоли поділяються на чотири категорії: сильні катіонообмінники кислоти; слабкі катіонні обмінники кислоти; потужні базові аніонообмінники; і слабкі базові аніонообмінники.
 |
 |
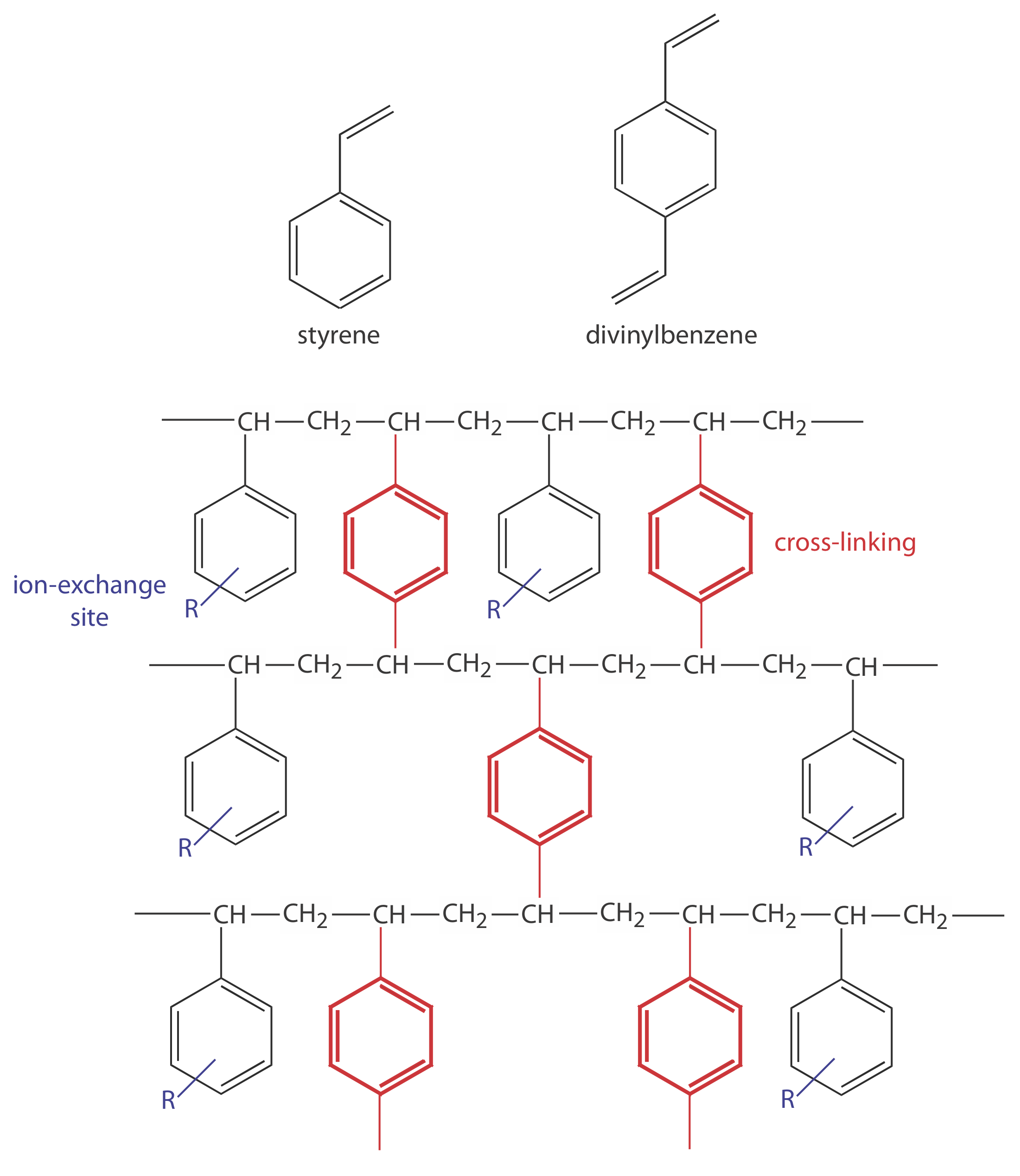
Рисунок Template:index. Зліва показані структури стиролу, дивінілбензолу та сополімеру стирол-дивінілбензолу, модифікованого для використання як іонообмінної смоли. Іонообмінні сайти, позначені R і показані синім кольором, в основному знаходяться в положенні пара-класу і не обов'язково пов'язані з усіма стирольними одиницями. Зшивання показано червоним кольором. На фото праворуч показаний приклад полімерних намистин. Ці намистини мають діаметр приблизно 0,30-0,85 мм. Смоли для використання в іонообмінній хроматографії зазвичай мають діаметр 5-11 мкм.
| тип | функціональна група | приклади |
|---|---|---|
| сильний кислотний катіонний обмінник | сульфонова кислота |
\(-\text{SO}_3^-\) \(-\text{CH}_2\text{CH}_2\text{SO}_3^-\) |
| слабкий кислотний катіонний обмінник | карбонова кислота |
\(-\text{COO}^-\) \(-\text{CH}_2\text{COO}^-\) |
| міцний базовий аніонний обмінник | четвертинний амін |
\(-\text{CH}_2\text{N(CH}_3)_3^+\) \(-\text{CH}_2\text{CH}_2\text{N(CH}_2\text{CH}_3)_3^+\) |
| слабке підставу аніонообмінника | амін |
\(-\text{NH}_4^+\) \(-\text{CH}_2\text{CH}_2\text{NH(CH}_2\text{CH}_3)_3^+\) |
Сильні кислотні катіоніти включають функціональну групу сульфонової кислоти, яка зберігає її аніонну форму - і, отже, її здатність до іонообміну - у сильнокислих розчині. Функціональні групи для слабкого катіонного обмінника кислоти, з іншого боку, повністю протонуються при рівнях рН менше 4 і втрачають свою обмінну здатність. До сильної бази аніонообмінників відноситься четвертинний амін, який зберігає позитивний заряд навіть в сильно базових рішеннях. Слабкі базові аніонообмінники залишаються протонованими лише при рівнях рН, які є помірно основними. При більш елементарних умовах слабке базове аніонообмінник втрачає протон і свою обмінну здатність.
Іонообмінна реакція одновалентного катіону, M +, обмінна ділянка становить
\[-\mathrm{SO}_{3}^{-} \mathrm{H}^{+}(s)+\mathrm{M}^{+}(a q)\rightleftharpoons-\mathrm{SO}_{3}^{-} \mathrm{M}^{+}(s)+\mathrm{H}^{+}(a q) \nonumber \]
Константа рівноваги для цієї іонообмінної реакції, яку ми називаємо коефіцієнтом селективності, К, дорівнює
де ми використовуємо фігурні дужки, {}, щоб вказати поверхневу концентрацію замість концентрації розчину.
Ми зазвичай не думаємо про концентрацію твердого тіла. Для цього є вагома причина. У більшості випадків концентрація твердої речовини є постійною. Якщо розбити шматочок крейди на дві частини, наприклад, маса і обсяг кожного шматочка зберігає таку ж пропорційну залежність, як і в вихідному шматку крейди. Однак, коли ми розглядаємо іонне зв'язування з реактивним місцем на поверхні твердого тіла, частка ділянок, які пов'язані, і, отже, концентрація пов'язаних ділянок, може приймати будь-яке значення між 0 і деяким максимальним значенням, пропорційним щільності реактивних ділянок.
Перестановка рівняння\ ref {12.1} показує нам, що коефіцієнт розподілу, D, для реакції обміну
\[D=\frac{\text { amount of } \mathrm{M}^{+} \text { in the stationary phase }}{\text { amount of } \mathrm{M}^{+} \text { in the mobile phase }} \nonumber \]
є функцією концентрації Н + і, отже, рН рухомої фази.
Вибірковість іонообмінної смоли дещо залежить від того, чи включає вона сильні чи слабкі обмінні сайти та від ступеня зшивання. Останнє особливо важливо, оскільки контролює проникність смоли, а отже, і доступність обмінних майданчиків. Приблизний порядок селективності для типової сильнокислотної катіонообмінної смоли, в порядку зменшення D, дорівнює
Аль 3 + > Ба 2 + > Пб 2 + > Са 2 + > Ні 2 + > Кд 2 + > Cu 2 + > Co 2 + > Zn 2 + > Mg 2 + > Ag + > K + >\(\text{NH}_4^+\) > Na + > H + > Li +
Зверніть увагу, що сильно заряджені катіони зв'язуються сильніше, ніж катіони нижчого заряду, і що для катіонів подібного заряду ті, що мають менший гідратований радіус, або які є більш поляризуючими, зв'язуються сильніше. Для міцного базового аніонного обмінника загальний порядок елюції становить
\(\text{SO}_4^{2-}\)> I —\(\text{HSO}_4^-\) >\(\text{NO}_3^-\) > > Br —\(\text{NO}_2^-\)\(\text{HCO}_3^-\) > Cl -> CH3COO -> ОН -> F —
Аніони більш високого заряду і меншого гідратного радіуса зв'язуються сильніше аніонів з меншим зарядом і більшим гідратованим радіусом.
Рухлива фаза в МЕК зазвичай являє собою водний буфер, рН та іонний склад якого визначає час утримання розчиненої речовини. Можливі градієнтні елюції, при яких іонна сила рухомої фази або рН змінюється з часом. Наприклад, розділення катіонів IEC може використовувати розведений розчин HCl як рухому фазу. Збільшення концентрації HCl прискорює швидкість елюції для більш сильно утримуваних катіонів, оскільки більша концентрація Н + дозволяє йому більш успішно конкурувати за іонообмінні ділянки.
З Equation\ ref {12.2} коефіцієнт розподілу катіону, D, стає меншим, коли концентрація H + в рухомій фазі збільшується.
Іонообмінна смола включена в колонку ВЕРХ або у вигляді пористих полімерних кульок 5-11 мкм, або шляхом покриття смоли на пористі частинки кремнезему. Колони зазвичай мають довжину 250 мм з внутрішніми діаметрами в межах 2-5 мм.
Вимірювання провідності рухомої фази при її елюації з колони служить універсальним детектором катіонних і аніонних аналітів. Оскільки рухлива фаза містить високу концентрацію іонів - наприклад, рухому фазу розведеного HCl, містить значні концентрації H+ та Cl - іонів, нам потрібен метод виявлення аналітів за наявності значної фонової провідності.
Щоб мінімізувати внесок рухомої фази в провідність, між аналітичною колоною і детектором розміщується колонка іоносупресора. Ця колонка вибірково видаляє рухомі фазові іони без видалення розчинених іонів. Наприклад, в катионообмінної хроматографії з використанням розведеного розчину HCl в якості рухомої фази супресорна колонка містить сильну основу аніонообмінної смоли. Реакція обміну
\[\mathrm{H}^{+}(a q)+\mathrm{Cl}^{-}(a q)+\mathrm{Resin}^{+} \mathrm{OH}^{-}(s)\rightleftharpoons\operatorname{Resin}^{+} \mathrm{Cl}^{-}(s)+\mathrm{H}_{2} \mathrm{O}(l ) \nonumber \]
замінює рухомі фазові іони Н + і Cl — на Н 2 О. Аналогічний процес застосовується в аніонообмінної хроматографії, де колонка супресора містить катионообмінну смолу. Якщо рухливою фазою є розчин Na 2 CO 3, реакція обміну
\[2 \mathrm{Na}^{+}(a q)+\mathrm{CO}_{3}^{2-}(a q)+2 \operatorname{Resin}^{-} \mathrm{H}^{+}(s)\rightleftharpoons2 \operatorname{Resin}^{-} \mathrm{Na}^{+}(s)+\mathrm{H}_{2} \mathrm{CO}_{3}(a q) \nonumber \]
замінює сильний електроліт, Na 2 CO 3, зі слабким електролітом, H 2 CO 3.
Іонне придушення необхідно, коли рухлива фаза містить високу концентрацію іонів. Одноколонкова іонна хроматографія, при якій не потрібна іонно-супресорна колонка, можлива, якщо концентрація іонів в рухомій фазі невелика. Зазвичай стаціонарна фаза являє собою смолу з низькою ємністю для іонообміну, а рухома фаза являє собою дуже розбавлений розчин метаносульфонової кислоти для катіонних аналітів, або бензоат калію або гідрофталат калію для аніонних аналітів. Оскільки фонова провідність досить мала, можна контролювати зміну провідності, коли аналіти елітуються з колони.
Детектор поглинання UV/Vis може бути використаний, якщо аналіти поглинають ультрафіолетове або видиме випромінювання. Крім того, ми можемо виявити опосередковано аналіти, які не поглинають в УФ/ВІС, якщо рухлива фаза містить вид, що поглинає УФ/ВІС. У цьому випадку, коли смуга розчинених речовин проходить через детектор, на детекторі вимірюється зменшення поглинання.
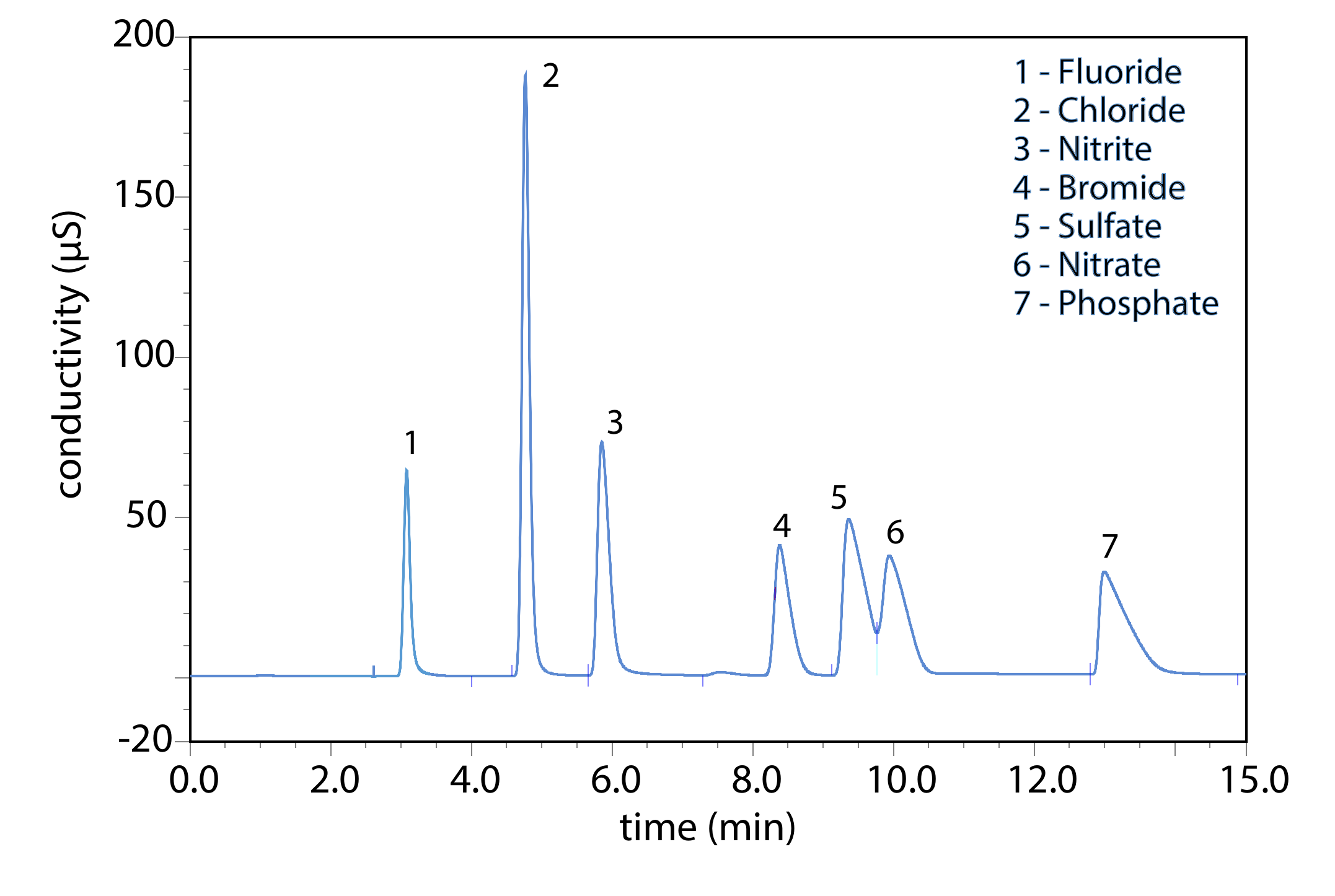
Іонообмінна хроматографія є важливою методикою аналізу аніонів і катіонів у воді. Наприклад, іонообмінний хроматографічний аналіз для аніонів F —, Cl —, Br —,\(\text{NO}_2^-\)\(\text{NO}_3^-\)\(\text{PO}_4^{3-}\), і\(\text{SO}_4^{2-}\) займає приблизно 15 хвилин (рис. Template:index). Для повного аналізу одного і того ж набору аніонів за допомогою комбінації потенціометрії і спектрофотометрії потрібно 1—2 дні. Іонообмінна хроматографія також використовується для аналізу білків, амінокислот, цукрів, нуклеотидів, фармацевтичних препаратів, споживчих товарів та клінічних зразків.