24.2: Кулометрія з контрольованим потенціалом
- Page ID
- 27455
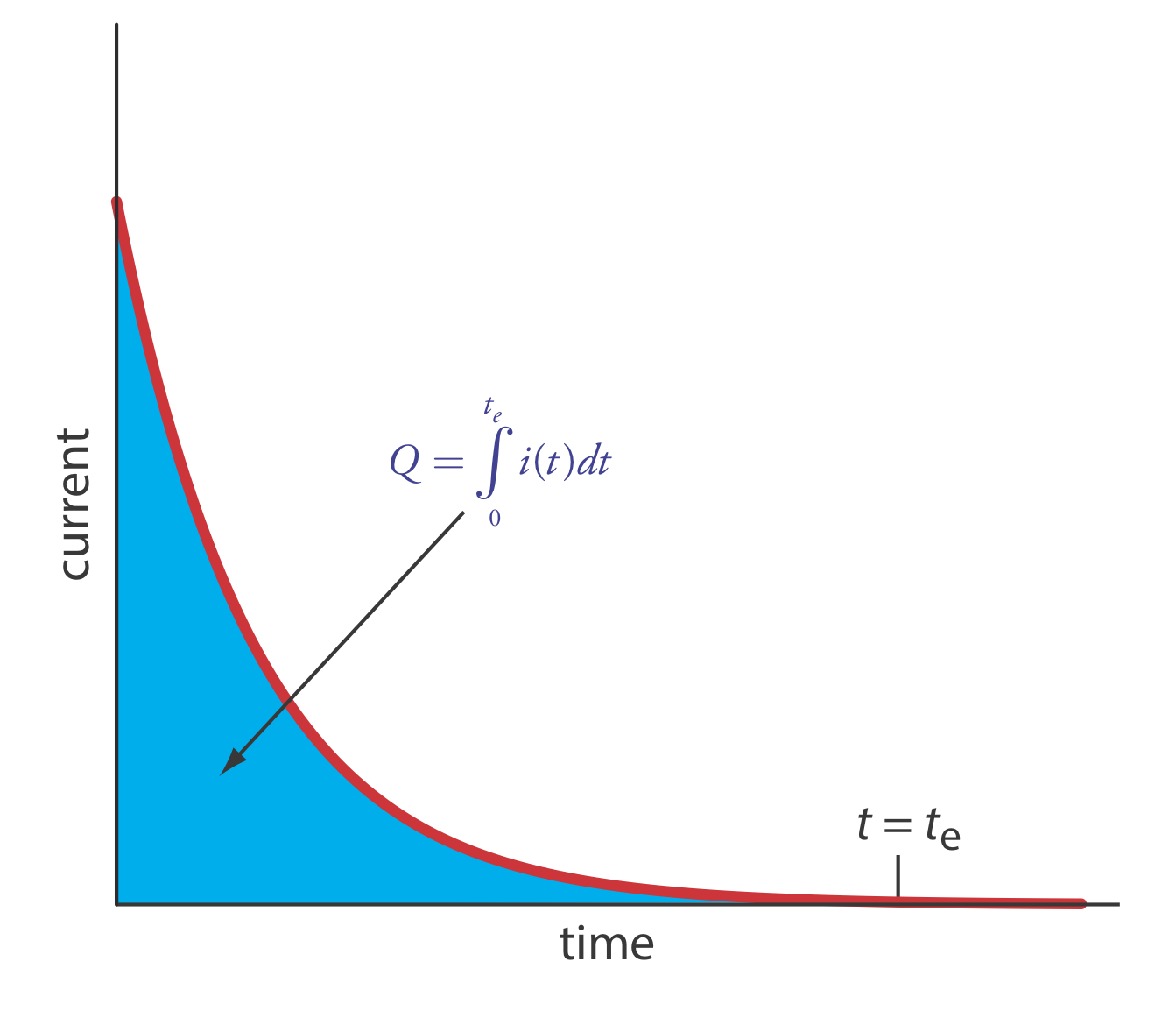
Найпростіший спосіб забезпечити 100% ефективність струму - утримувати робочий електрод при постійному потенціалі, коли аналіт окислюється або відновлюється повністю і де не окислюються або відновлюються будь-які потенційні заважаючі види. У міру прогресування електролізу концентрація аналіта і струм зменшуються. Отриманий профіль струму проти часу для кулометрії з керованим потенціалом показаний на рис\(\PageIndex{1}\). Інтеграція площі під кривою від t = 0 до t = t e дає загальний заряд. У цьому розділі розглядаються експериментальні параметри та приладобудування, необхідні для розробки кулометричного методу аналізу з керованим потенціалом та його застосування.
Вибір постійного потенціалу
Щоб зрозуміти, як підбирається відповідний потенціал для робочого електрода, розробимо кулометричний метод з постійним потенціалом для Cu 2+, заснований на його відновленні до мідного металу на робочому електроді Pt.
\[\mathrm{Cu}^{2+}(a q)+2 e^{-} \rightleftharpoons \mathrm{Cu}(s) \label{cp1} \]
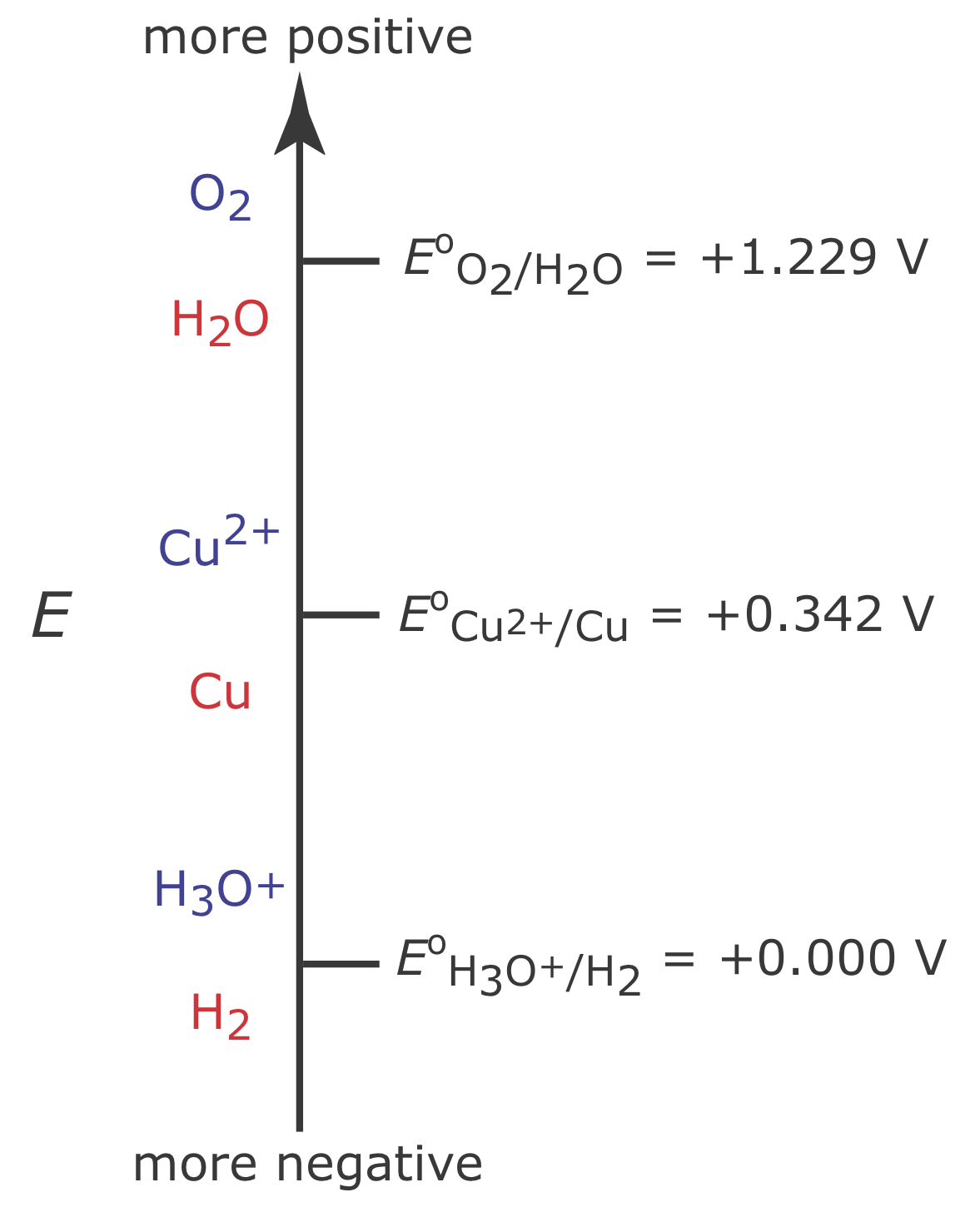
\(\PageIndex{2}\)На малюнку показані три відновні реакції, які можуть мати місце у водному розчині Cu 2 + та їх відновні потенціали стандартного стану: зниження O 2 до H 2 O, зниження Cu 2 + до Cu та зменшення Н 3 О + до Н 2. З діаграми ми знаємо, що реакція\ ref {cp1} сприятлива, коли потенціал робочого електрода більш негативний, ніж +0,342 В проти стандартного водневого електрода. Однак для забезпечення 100% ефективності струму потенціал повинен бути досить позитивним, ніж +0.000 В, щоб зниження Н 3 О + до Н 2 не сприяло суттєво сумарному струму, що протікає через електрохімічну комірку.
Ми можемо використовувати рівняння Нернста для реакції\ ref {cp1} для оцінки мінімального потенціалу кількісного зменшення Cu 2 +.
\[E=E_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\mathrm{o}}-\frac{0.05916}{2} \log \frac{1}{\left[\mathrm{Cu}^{2+}\right]} \label{cp2} \]
Отже, чому ми використовуємо концентрацію Cu 2 + у рівнянні\ ref {cp2} замість його активності, як ми це робили в главі 23, коли ми розглядали потенціометрію? У потенціометрії ми використовували активність, оскільки ми використовували E клітину для визначення концентрації аналіта. Тут ми використовуємо рівняння Нернста, щоб допомогти нам вибрати відповідний потенціал. Як тільки ми виявимо потенціал, ми можемо скорегувати його значення в міру необхідності, щоб забезпечити кількісне зниження Cu 2 +. Крім того, в кулометрії концентрація аналіта задається загальним зарядом, а не прикладеним потенціалом.
Якщо визначити кількісний електроліз як такий, при якому ми зменшуємо 99,99% Cu2+ до Cu, то концентрація Cu 2+ при t e дорівнює
\[\left[\mathrm{Cu}^{2+}\right]_{t_{e}}=0.0001 \times\left[\mathrm{Cu}^{2+}\right]_{0} \label{cp3} \]
де [Cu 2 +] 0 - початкова концентрація Cu 2 + в зразку. Підставляючи рівняння\ ref {cp3} на рівняння\ ref {cp2}, ми можемо обчислити необхідний потенціал.
\[E=E_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\circ}-\frac{0.05916}{2} \log \frac{1}{0.0001 \times\left[\mathrm{Cu}^{2+}\right]} \label{cp4} \]
Якщо початкова концентрація Cu 2+ дорівнює\(1.00 \times 10^{-4}\) M, то потенціал робочого електрода повинен бути більше негативного, ніж +0,105 В, щоб кількісно зменшити Cu 2 + до Cu. Відзначимо, що при цьому потенціал Н 3 О + не знижується до Н 2, зберігаючи 100% ККД струму.
Багато кулометричні методи з контрольованим потенціалом для Cu 2 + використовують потенціал, який є негативним відносно стандартного електрода водню - див., наприклад, Рехніц, Г.А. Аналіз контрольованого потенціалу, Макміллан: Нью-Йорк, 1963, с.49. Виходячи з малюнка,\(\PageIndex{2}\) ви можете очікувати, що застосування потенціалу <0.000 В частково зменшить H 3 O + до H 2, що призведе до ККД струму, який становить менше 100%. Причина, по якій ми можемо використовувати такий негативний потенціал, полягає в тому, що швидкість реакції на зниження Н 3 О + до Н 2 дуже повільна у електрода Pt. Це призводить до значного надпотенціалу - необхідності застосування потенціалу більш позитивного або більш негативного, ніж передбачене термодинамікою, - що зміщує E o для окислювально-відновлювальної пари H 3 O +/H 2 до більш негативного значення.
Мінімізація часу електролізу
У кулометрії з керованим потенціалом, як показано на малюнку\(\PageIndex{1}\), струм зменшується з часом. Як результат, швидкість електролізу - нагадаємо з глави 22, що струм є мірою швидкості - стає повільнішою, і вичерпний електроліз аналіту може зажадати тривалого часу. Оскільки час є важливим фактором при розробці аналітичного методу, ми повинні враховувати фактори, які впливають на час аналізу.
Ми можемо наблизити, як змінюється струм як функція часу (рис.\(\PageIndex{1}\)) як експоненціальний спад; таким чином, струм в час t дорівнює
\[i_{t}=i_{0} e^{-k t} \label{cp5} \]
де i 0 - струм при t = 0 і k - постійна швидкості, яка прямо пропорційна площі робочого електрода і швидкості перемішування, і що обернено пропорційно обсягу розчину. Для вичерпного електролізу, при якому ми окислюємо або зменшуємо 99,99% аналіту, струм в кінці аналізу, т е, дорівнює
\[i_{t_{e}} \leq 0.0001 \times i_{0} \label{cp6} \]
Підставляючи рівняння\ ref {cp6} на рівняння\ ref {cp5} і розв'язування для t e дає мінімальний час для вичерпного електролізу як
\[t_{e}=-\frac{1}{k} \times \ln (0.0001)=\frac{9.21}{k} \label{cp7} \]
З цього рівняння ми бачимо, що більша величина для k скорочує час аналізу. З цієї причини ми зазвичай проводимо кулометричний аналіз з контрольованим потенціалом в електрохімічній комірці невеликого об'єму, використовуючи електрод з великою площею поверхні та з високою швидкістю перемішування. Кількісний електроліз зазвичай вимагає приблизно 30-60 хв, хоча можливі коротші або тривалі терміни.
Контрольно-вимірювальні прилади
Ми можемо використовувати триелектродний потенціостат на малюнку (\(\PageIndex{3}\)) для встановлення та контролю потенціалу в кулометрії з керованим потенціалом. Потенціал робочого електрода вимірюється щодо опорного електрода з постійним потенціалом, який з'єднаний з робочим електродом через потенціометр з високим імпедансом. Для установки потенціалу робочого електрода регулюємо резистор ковзання дроту, який підключений до допоміжного електрода. Якщо потенціал робочого електрода починає дрейфувати, налаштовуємо резистор з проводом ковзання, щоб повернути потенціал до початкового значення. Струм, що протікає між допоміжним електродом і робочим електродом, вимірюється амперметром. Звичайно, сучасний потенціостат використовує операційні підсилювачі для підтримки постійного потенціалу без нашого втручання.

Робочий електрод зазвичай буває одного з двох видів: циліндричний Pt електрод, виготовлений з платиново-марлевого (рис.\(\PageIndex{4}\)), або електрод Hg басейну. Великий перенапруга для зниження H 3 O + при Hg робить його електродом вибору для аналіту, який вимагає негативного потенціалу. Наприклад, потенціал, більш негативний, ніж —1 В проти SHE, можливий при електроді Hg, але не на електроді Pt - навіть у дуже кислому розчині. Оскільки ртуть легко окислюється, вона менш корисна, якщо нам потрібно підтримувати потенціал, який є позитивним щодо SHE. Платина - це робочий електрод вибору, коли нам потрібно застосувати позитивний потенціал.

Допоміжний електрод, який часто є проводом Pt, відокремлений соляним містком від аналітичного розчину. Це необхідно для того, щоб продукти електролізу, що утворюються на допоміжному електроді, не вступали в реакцію з аналітом і не втручалися в аналіз. В якості опорного електрода служить насичений каломель або Ag/AgCl електрод.
Інша істотна потреба в кулометрії з контрольованим потенціалом - це засіб для визначення сумарного заряду. Одним з методів є моніторинг струму як функція часу і визначення площі під кривою, як показано на малюнку\(\PageIndex{1}\). Сучасні прилади використовують електронну інтеграцію для контролю заряду як функції часу. Загальний заряд в кінці електролізу зчитується безпосередньо з цифрового зчитування.
Електрогравіметрія
Якщо твір кулометрії з керованим потенціалом утворює наліт на робочому електроді, то в якості аналітичного сигналу можна використовувати зміну маси електрода. Наприклад, якщо застосувати потенціал, який зменшує Cu 2 + до Cu на робочому електроді Pt, різниця в масі електрода до і після електролізу є прямим вимірюванням кількості міді в зразку. Аналітична техніка, яка використовує масу як сигнал гравіметричною технікою; таким чином, ми називаємо цю електрогравіметрію.
Кількісні програми
Більшість кулометричних аналізів з контрольованим потенціалом передбачають визначення неорганічних катіонів та аніонів, включаючи мікрометали та іони галогенідів. Таблиця\(\PageIndex{1}\) узагальнює кілька цих методів.
| аналіт | електролітична реакція | електрод |
|---|---|---|
| сурму | \(\text{Sb}(\text{III}) + 3 e^{-} \rightleftharpoons \text{Sb}\) | Пт |
| миш'яку | \(\text{As}(\text{III}) \rightleftharpoons \text{As(V)} + 2 e^{-}\) | Пт |
| кадмію | \(\text{Cd(II)} + 2 e^{-} \rightleftharpoons \text{Cd}\) | Pt або Hg |
| кобальт | \(\text{Co(II)} + 2 e^{-} \rightleftharpoons \text{Co}\) | Pt або Hg |
| мідь | \(\text{Cu(II)} + 2 e^{-} \rightleftharpoons \text{Cu}\) | Pt або Hg |
| галогеніди (X —) | \(\text{Ag} + \text{X}^- \rightleftharpoons \text{AgX} + e^-\) | Ag |
| залізо | \(\text{Fe(II)} \rightleftharpoons \text{Fe(III)} + e^-\) | Пт |
| свинець | \(\text{Pb(II)} + 2 e^{-} \rightleftharpoons \text{Pb}\) | Pt або Hg |
| нікель | \(\text{Ni(II)} + 2 e^{-} \rightleftharpoons \text{Ni}\) | Pt або Hg |
| плутонію | \(\text{Pu(III)} \rightleftharpoons \text{Pu(IV)} + e^-\) | Пт |
| срібло | \(\text{Ag(I)} + 1 e^{-} \rightleftharpoons \text{Ag}\) | Пт |
| олово | \(\text{Sn(II)} + 2 e^{-} \rightleftharpoons \text{Sn}\) | Пт |
| уран | \(\text{U(VI)} + 2 e^{-} \rightleftharpoons \text{U(IV})\) | Pt або Hg |
| цинку | \(\text{Zn(II)} + 2 e^{-} \rightleftharpoons \text{Zn}\) | Pt або Hg |
|
Джерело: Rechnitz, Г.А. Аналіз контрольованого потенціалу, Макміллан: Нью-Йорк, 1963. Електролітичні реакції записуються з точки зору зміни ступеня окислення аналіта. Фактичний вид в розчині залежить від аналіту. |
||
Можливість контролювати селективність шляхом регулювання потенціалу робочого електрода робить кулометрію з керованим потенціалом особливо корисною для аналізу сплавів. Наприклад, ми можемо визначити склад сплаву, що містить Ag, Bi, Cd і Sb, розчиняючи зразок і помістивши його в матрицю 0,2 M H 2 SO 4 разом з робочим електродом Pt і зустрічним електродом Pt. Якщо застосувати постійний потенціал +0,40 В проти SCE, Ag (I) відкладення на електроді як Ag та інші іони металів залишаються в розчині. Коли електроліз завершений, ми використовуємо загальний заряд для визначення кількості срібла в сплаві. Далі зміщуємо потенціал робочого електрода на -0,08 В проти СКВ, відкладаючи Bi на робочий електрод. Коли кулометричний аналіз для вісмуту завершено, визначаємо сурму шляхом зміщення потенціалу робочого електрода до —0,33 В проти СКВ, осаджуючи Sb. Нарешті, ми визначаємо кадмій після його електроосадження на робочий електрод з потенціалом —0,80 В проти СКВ.
Ми також можемо використовувати кулометрію з контрольованим потенціалом для кількісного аналізу органічних сполук, хоча кількість застосувань значно менше, ніж для неорганічних аналітів. Одним із прикладів є шестиелектронне відновлення нітрогрупи, —NO 2, до первинного аміну, —NH 2, на ртутному електроді. Розчини пікринової кислоти - також відомий як 2,4,6-тринітрофенол, або TNP, близький родич ТНТ - аналізується шляхом зниження його до триамінофенолу.
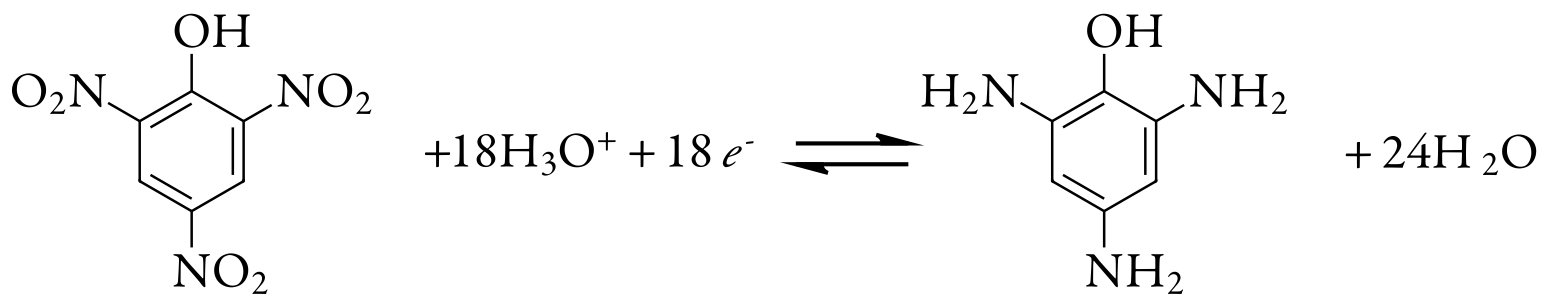
Іншим прикладом є послідовне зменшення трихлорацетату до дихлорацетату, а дихлорацетату - до монохлорацетату.
\[\text{Cl}_3\text{CCOO}^-(aq) + \text{H}_3\text{O}^+(aq) + 2 e^- \rightleftharpoons \text{Cl}_2\text{HCCOO}^-(aq) + \text{Cl}^-(aq) + \text{H}_2\text{O}(l) \nonumber \]
\[\text{Cl}_2\text{HCCOO}^-(aq) + \text{ H}_3\text{O}^+(aq) + 2 e^- \rightleftharpoons \text{ ClH}_2\text{CCOO}^-(aq) + \text{ Cl}^-(aq) + \text{H}_2\text{O}(l) \nonumber \]
Ми можемо проаналізувати суміш трихлорацетату та дихлорацетату, вибравши початковий потенціал, де реагує лише більш легко знижений трихлорацетат. Коли його електроліз завершиться, ми можемо зменшити дихлорацетат, регулюючи потенціал до більш негативного потенціалу. Загальний заряд для першого електролізу дає кількість трихлорацетата, а різниця в загальному заряді між першим електролізом і другим електролізом дає кількість дихлорацетата.
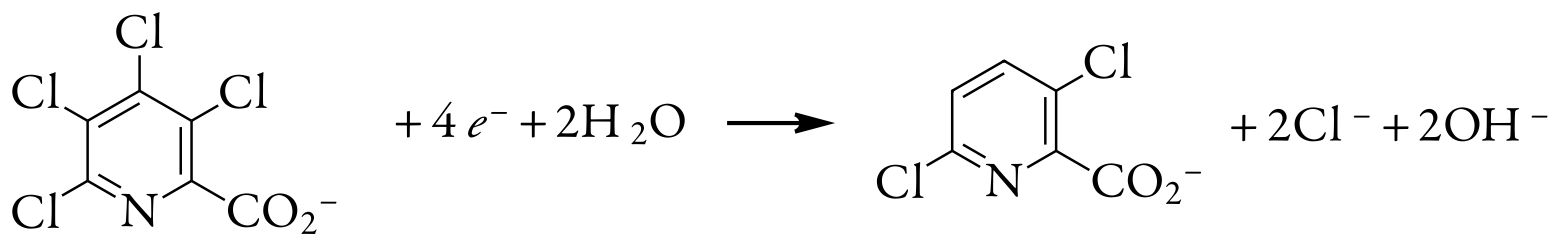
Одним з корисних застосувань кулометрії з керованим потенціалом є визначення кількості електронів, що беруть участь в окисно-відновній реакції. Для визначення ми завершуємо кулометричний аналіз з контрольованим потенціалом, використовуючи відому кількість чистої сполуки. Сумарний заряд в кінці електролізу використовується для визначення значення n за законом Фарадея. 0,3619-г зразка тетрахлоропіколінової кислоти, C 6 HNO 2 Cl 4, розчиняють у дистильованій воді, переносять у об'ємну колбу об'ємом об'ємом 1000 мл і розводять до об'єму. Для вичерпного електролізу з контрольованим потенціалом 10,00-мл порції цього розчину на губчастому срібному катоді потрібно 5,374 С заряду. Яке значення n для цієї реакції відновлення?
Рішення
10,00-мл частина зразка містить 3,619 мг, або\(1.39 \times 10^{-5}\) моль тетрахлоропіколінової кислоти. Розв'язування для n дає
\[n=\frac{Q}{F N_{A}}=\frac{5.374 \text{ C}}{\left(96478 \text{ C/mol } e^{-}\right)\left(1.39 \times 10^{-5} \text{ mol } \mathrm{C}_{6} \mathrm{HNO}_{2} \mathrm{Cl}_{4}\right)} = 4.01 \text{ mol e}^-/\text{mol } \mathrm{C}_{6} \mathrm{HNO}_{2} \mathrm{Cl}_{4} \nonumber \]
Таким чином, для відновлення молекули тетрахлоропіколінової кислоти потрібно чотири електрони. Загальна реакція, в результаті якої відбувається селективне утворення 3,6-дихлоропіколінової кислоти, становить