20.2: Джерела іонів
- Page ID
- 27112
Оскільки масовий спектр показує відносну кількість іонів з різним співвідношенням маси до заряду, мас-спектрометр повинен включати спосіб генерації іонів. Більш конкретно, йому потрібен метод, який генерує початковий іон, оскільки він після формування зазнає фрагментації без додаткової допомоги аналітика (що не означає, що аналітик не може допомогти в цій фрагментації; див. Обговорення тандемної мас-спектрометрії в Розділі 20.4). У цьому розділі ми розглянемо кілька поширених джерел іонів. Ми можемо описати ці джерела, використовуючи дві характерні властивості: (а) фізичний стан виду, який спочатку іонізований (газ, рідина або тверда фаза), і (б) чи сприяє іонізація утворенню фрагментних іонів або утворенню молекулярних іонів (тверді джерела або м'які джерела).
Джерела іонізації електронів (газова фаза/тверде джерело)
Джерело іонізації електронів (EI), також відоме як джерело удару електронів, використовує пучок енергетичних електронів для іонізації аналіту. Як показано в\(\PageIndex{1}\), зразок випаровується перед надходженням до джерела іонів у вигляді молекул газової фази, M (g). Нагріта вольфрамова нитка використовується для генерації електронів, які тягнуться до позитивно зарядженого анода. Цей електронний промінь перетинається з молекулами газової фази при 90°, де відбувається іонізація.
\[ \ce{M}(g) + e^- \rightarrow \ce{M^{+•}}(g) + 2e^- \label{ei1} \]
Потім\(\ce{M^{+•}}(g)\) молекулярні іони змітаються в аналізатор маси за допомогою набору прискорювальних пластин (тут не показано).
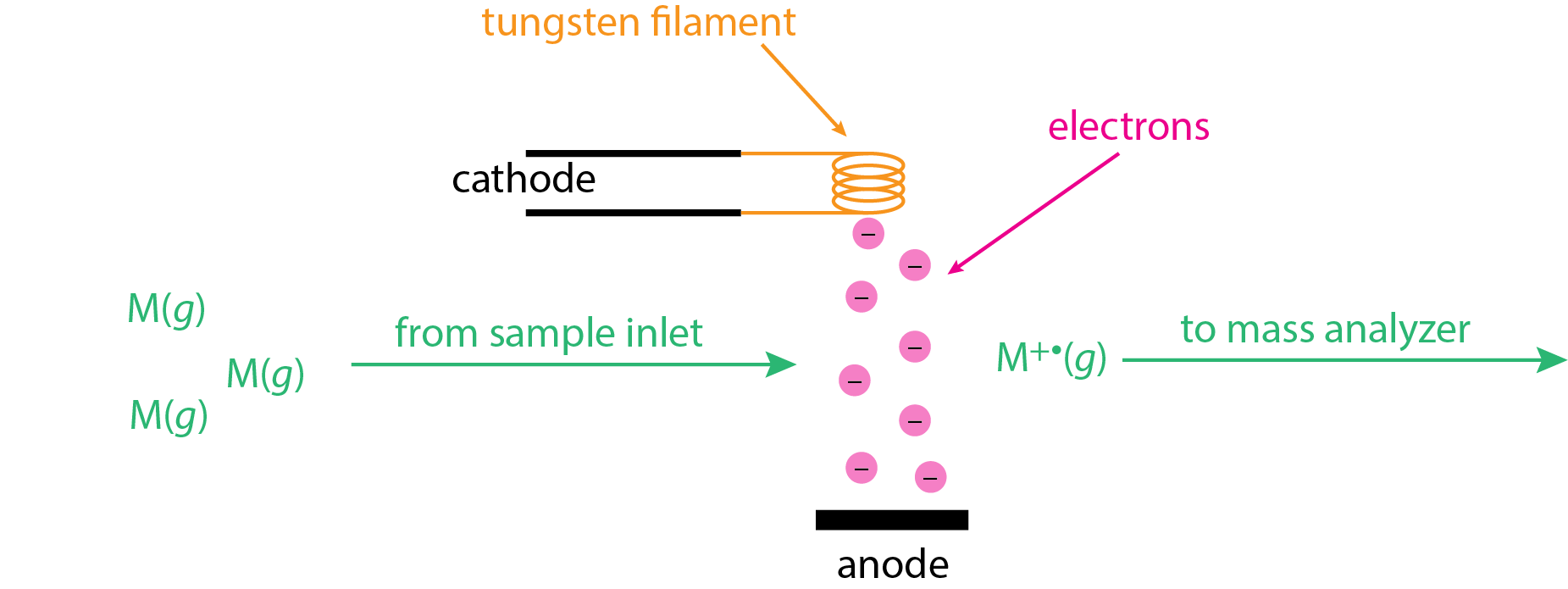
Електронний пучок на малюнку\(\PageIndex{1}\) має багато енергії завдяки значній різниці потенціалів між катодом і анодом, яка може становити цілих 70 В. Кінетична енергія цих електронів еквівалентна добутку заряду електрона в Кулоні, прикладеного потенціалу в вольтах і Номер Авогадро
\[e \times V \times N_A = 1.6 \times 10^{-19} \times 6.022 \times 10^{-23} = 6.7 \times 10^{6} \text{ J/mol} \nonumber \]
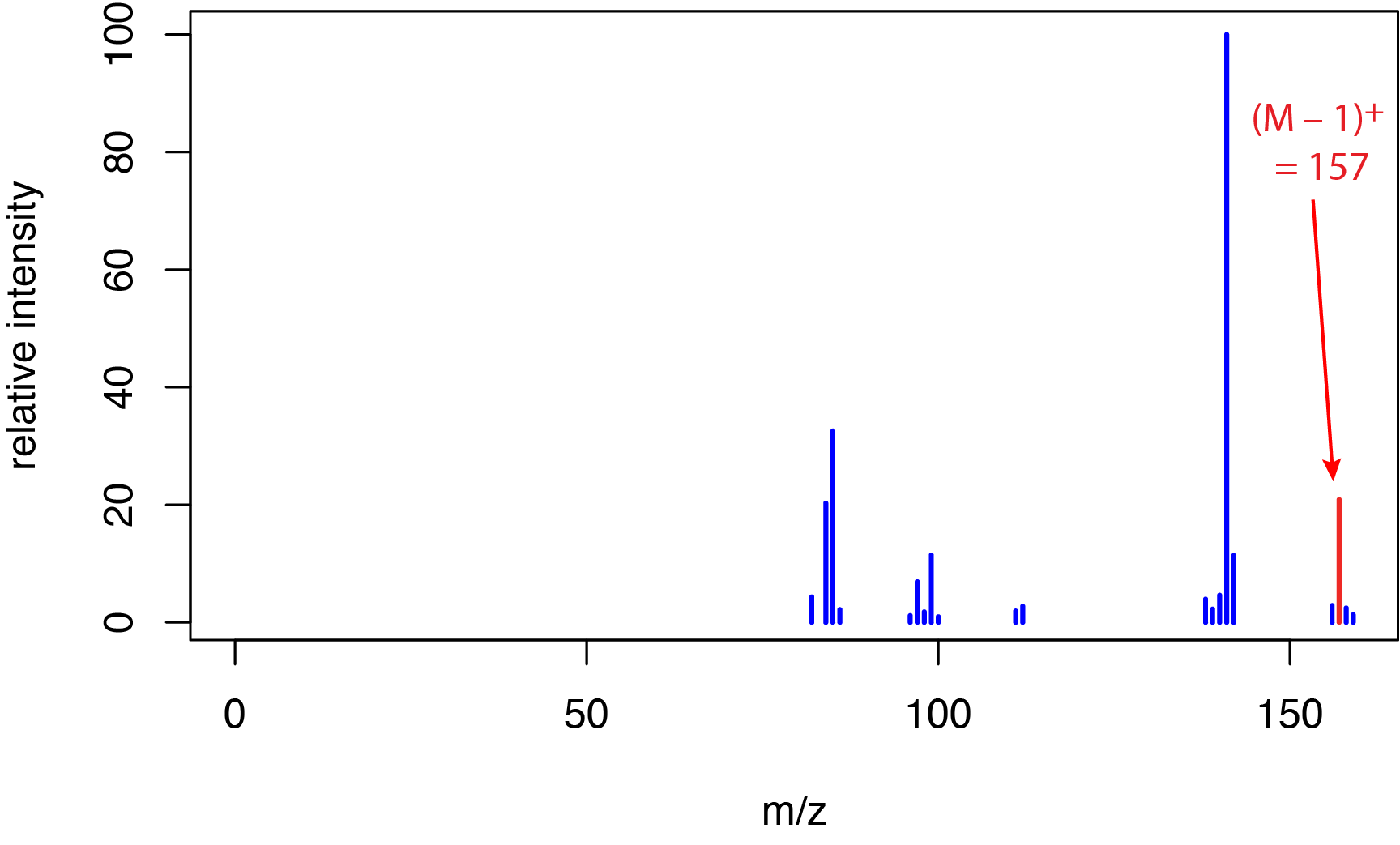
або 6700 кДж/моль. Ця енергія набагато більша, ніж типові енергії зв'язку, які коливаються приблизно від 150-600 кДж/моль для одиночних зв'язків, від приблизно 500—750 кДж/моль для подвійних зв'язків і приблизно від 800—1100 кДж/моль для потрійних зв'язків. Значна різниця між енергією електронів і енергіями зв'язку пояснює, чому спектри іонізації електронів багаті іонами фрагментів, як ми бачили раніше в розділі 20.1 для o -нітрофенолу, m -нітрофенолу і р -нітрофенолу. Ця велика фрагментація корисна для визначення структури аналіта, що є перевагою методу жорсткої іонізації, але за можливу ціну втрати піку молекулярних іонів для деяких аналітів. Наприклад, на малюнку\(\PageIndex{2}\) показаний спектр маси іонізації електронів від 1-деканолу, C 10 H 22 O, який має номінальну масу 158 дальтон. Малий пік при m/z = 157 припадає на фрагмент-іон C 10 H 21 O +; молекулярний іон в цьому спектрі не спостерігається.

Джерела хімічної іонізації (газова фаза/м'яке джерело)
Іонізація електронів є твердим джерелом, оскільки енергія електронного пучка призводить до легкої фрагментації. При хімічній іонізації ми ввели молекулу реагенту, таку як метан, у джерело іонізації електронів (CI), щоб вона була присутня на рівні, який\(10,000 \times\) перевищує аналіт.\(1000 \times\) При цій більш високій концентрації іонізується молекула реагенту; наприклад, при використанні CH 4 в якості газу реагенту\(\ce{CH3+}\) утворюються іони, такі як\(\ce{CH4+}\) і. Потім ці іони реагують з додатковими молекулами метану.
\[\ce{CH4+}(g) + \ce{CH4}(g) \rightarrow \ce{CH5+}(g) + \ce{CH3}(g) \label{ci1} \]
\[\ce{CH3+}(g) + \ce{CH4}(g) \rightarrow \ce{C2H5+}(g) + \ce{H2}(g) \label{ci2} \]
утворювати\(\ce{CH5+}\) і\(\ce{C2H5+}\), види, які є досить реактивними, що вони легко переносять водень до молекули аналіту, MH
\[\ce{CH5+}(g) + \ce{MH}(g) \rightarrow \ce{MH2+}(g) + \ce{CH4}(g) \label{ci3} \]
щоб дати молекулярний іон, який ми ідентифікуємо як [M + H] + і який має масу, яка на одну одиницю amu більше, ніж для М. Крім того, вони можуть легко видалити водень з молекули аналіту, MH
\[\ce{C2H5+}(g) + \ce{MH}(g) \rightarrow \ce{M+}(g) + \ce{C2H6}(g) \label{ci4} \]
щоб дати молекулярний іон, який ми ідентифікуємо як [M - H] - і який має масу, яка на одну аму менше, ніж для М. Оскільки утворення молекулярного іона відбувається опосередковано і менш енергетично, фрагментація пригнічується, що призводить до масового спектру з молекулярним іонним піком і лише з невеликим кількість інших іонів. \(\PageIndex{2}\)На малюнку показаний масовий спектр для 1-деканолу при використанні хімічної іонізації з реагентом в\(\ce{CH4}\) якості газу.
Джерела іонізації електроспрей (рідка фаза/м'яке джерело)
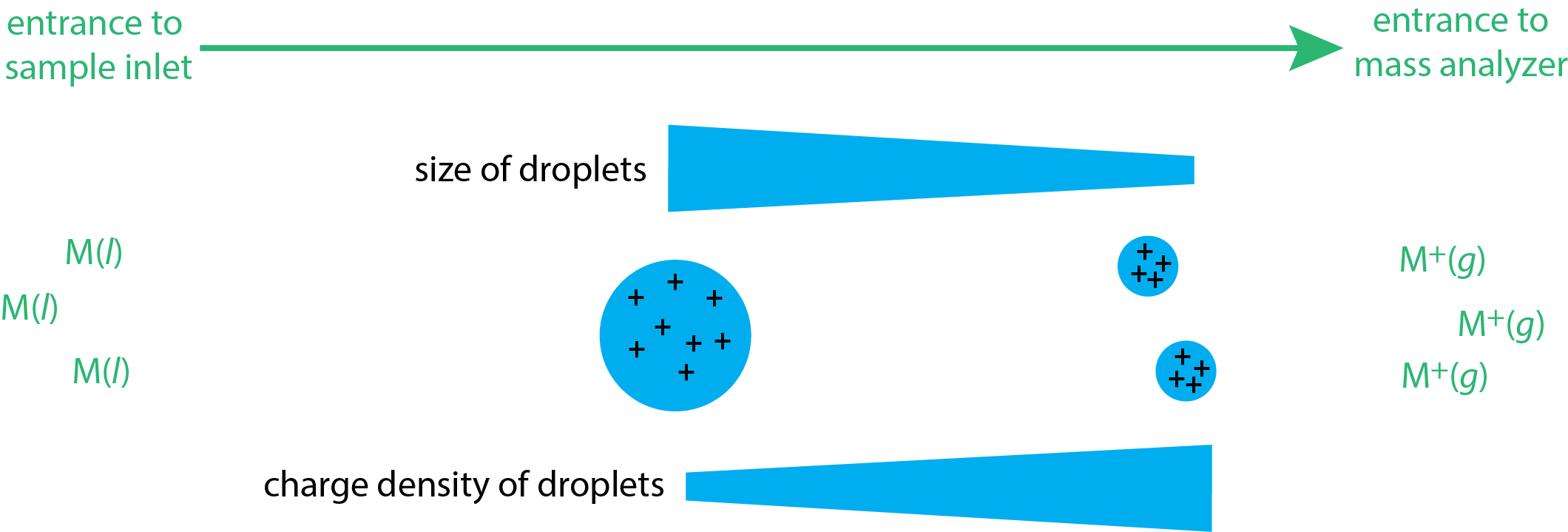
Електронний вплив та хімічна іонізація є джерелами газової фази, оскільки зразок випаровується перед тим, як він потрапляє на вхід мас-спектрометра. При електророзпилювальної іонізації (ESI) зразок являє собою рідину та іони десорбу з цієї матриці у вхідній системі мас-спектрометра. Рідкий зразок витягується у вхідний отвір спектрометра через капілярну голку, утворюючи туман крапель. Застосування великого потенціалу на цьому вході гарантує, що краплі несуть позитивні заряди. Ці заряджені краплі потім потрапляють в камеру, де вони проходять десольвацию, що зменшує розмір крапель і збільшує їх щільність заряду (див. Рис.\(\PageIndex{4}\)). У міру збільшення щільності заряду краплі з часом стають нестабільними, з причин, які до кінця не вивчені, а іонізовані іони газової фази десорбують з крапель і потрапляють в мас-аналізатор.
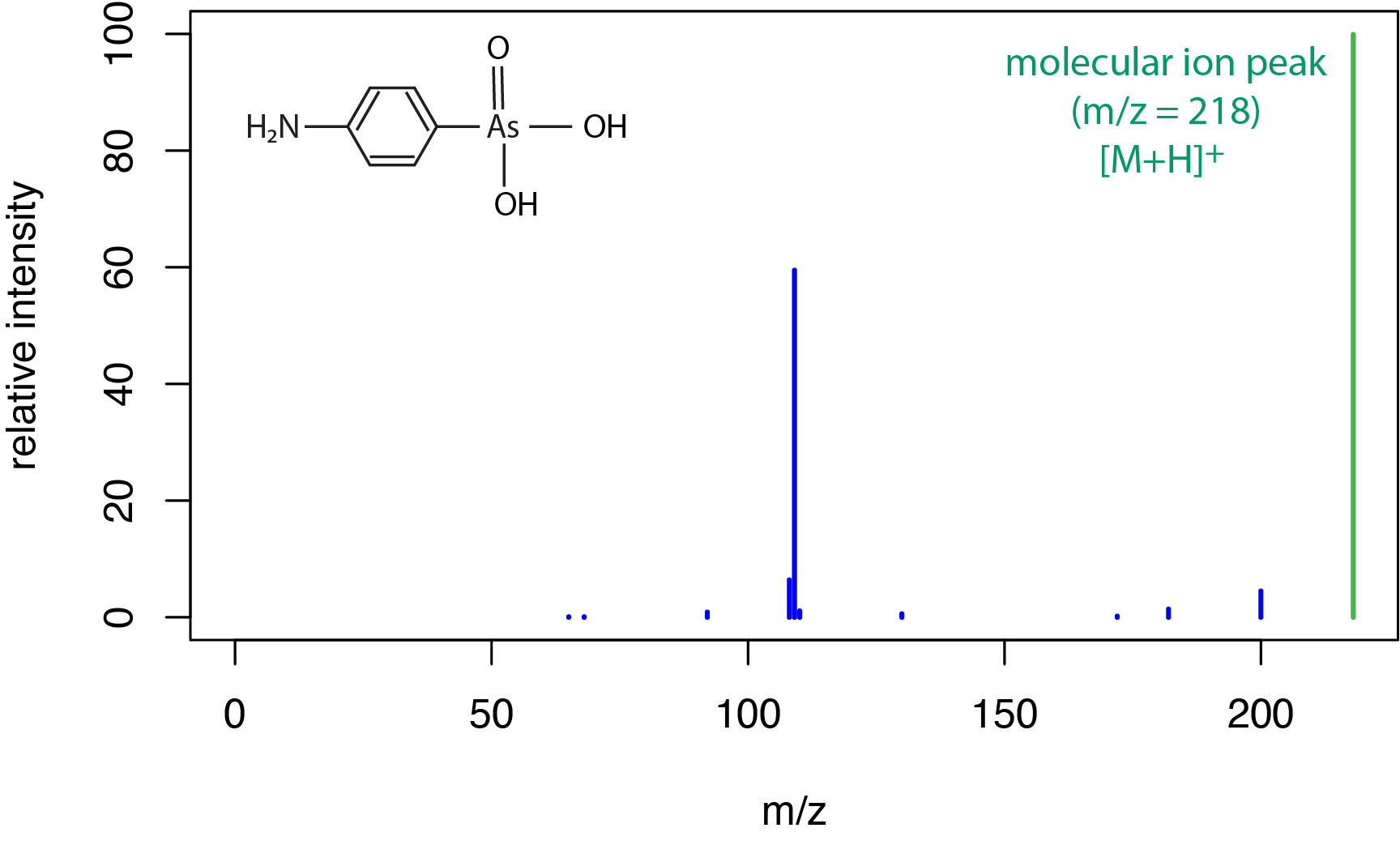
Типовий електроспрей іонізації масовий спектр для малої молекули показаний\(\PageIndex{5}\) на малюнку для сполуки (4-амінофеніл) арзвукової кислоти. Як ми бачили\(\PageIndex{3}\) на малюнку для хімічної іонізації, джерело м'якої іонізації призводить до обмеженої кількості фрагментації та сильного піку для молекулярного іона, який сюди включає перенесення протона, щоб дати [M + H] + пік при m /z 218 аму.
Електроспрей-іонізація особливо корисна для біологічних молекул, таких як пептиди та білки, оскільки м'яка іонізація забезпечує збереження інформації про молекулярну вагу. Оскільки ці молекули великі, вони легко забирають кілька протонів, утворюючи множинно заряджені іони загальної форми [M + z H] z +, де z - кількість доданих протонів. \(\PageIndex{6}\)На малюнку показаний гіпотетичний спектр для молекули M, а Таблиця\(\PageIndex{1}\) надає відповідні значення m /z для піків масового спектру.
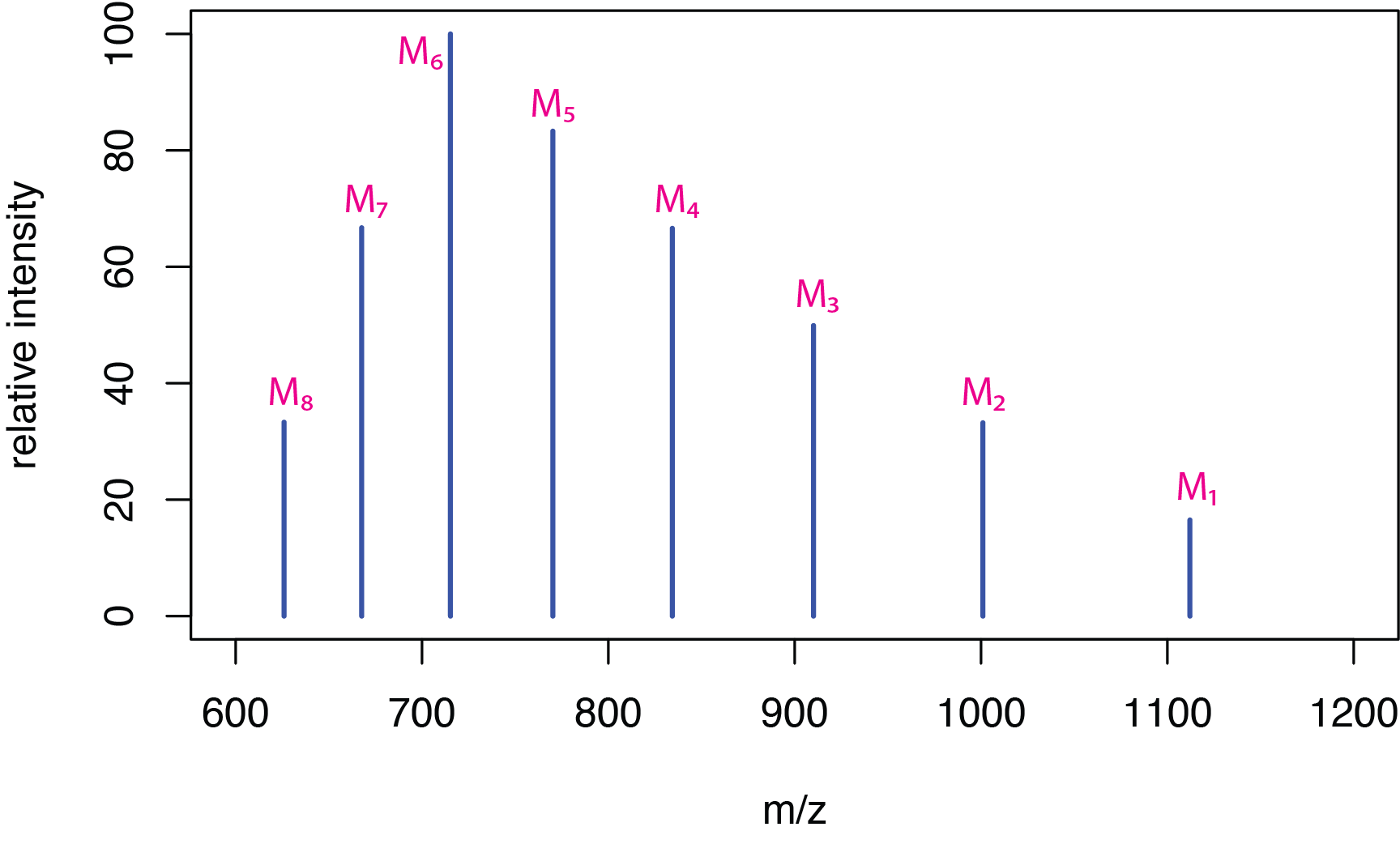
| пік | м/ з |
|---|---|
| М 1 | 1112 |
| М 2 | 1001 |
| М 3 | 910 |
| М 4 | 834 |
| М 5 | 770 |
| М 6 | 715 |
| М 7 | 667 |
| М 8 | 626 |
Якщо взяти відношення маси до заряду для будь-яких двох сусідніх піків,\(M_i\) причому\(M_j\), де пік\(M_i\) має більше значення для m/z, і якщо припустити, що\(M_j\) має один додатковий атом водню, даючи йому заряд, який на одиницю вище, то
\[Z_i = \frac{M_j - 1}{M_i - M_j} \label{findz} \]
де\(Z_i\) знаходиться заряд на іоні\(M_i\). Таблиця\(\PageIndex{2}\) показує розрахункові заряди для іонів\(M_1\) до\(M_7\).
Ось похідне для рівняння\ ref {findz}. Припустимо, що цікавить молекула має молекулярну масу\(m\). Якщо заряд на іоні, що відповідає за пік\(Z\),\(M_i\) є, то має бути так, що маса піку дорівнює m + Z, так як він має Z зайвих воднів і повинно бути так, що його відношення маси до заряду дорівнює
\[M_i = \frac{m + Z}{Z} \nonumber \]
і його молекулярна маса\(m\),
\[m = (M_i \times Z) - Z \nonumber \]
Таким же чином пік\(M_j\) має заряд\(Z + 1\) і
\[M_j = \frac{m + Z + 1}{Z + 1} \nonumber \]
\[m = (M_j \times Z )+ M_j - Z - 1 \nonumber \]
Встановлення двох рівнянь для\(m\) рівних один одному та розв'язування для\(Z\) заданих
\[(M_i \times Z) - Z = (M_j \times Z) + M_j - Z - 1 \nonumber \]
\[(M_i \times Z) = (M_j \times Z) + M_j - 1 \nonumber \]
\[(M_i \times Z) - (M_j \times Z) = M_j - 1 \nonumber \]
\[Z = \frac{M_j - 1}{M_i - M_j} \nonumber \]
| пік | м/ з | Z |
|---|---|---|
| М 1 | 1112 | 9 |
| М 2 | 1001 | 10 |
| М 3 | 910 | 11 |
| М 4 | 834 | 12 |
| М 5 | 770 | 13 |
| М 6 | 715 | 14 |
| М 7 | 667 | 15 |
| М 8 | 626 | — |
Молекулярна маса\(m\),, задається рівнянням
\[m = (M_i \times Z) - Z \label{findmw} \]
Таблиця\(\PageIndex{3}\) показує молекулярні маси для іонів\(M_1\) до\(M_7\) і їх середнє значення. Імітований масовий спектр був створений шляхом встановлення молекулярної маси в 10000 аму і з зарядами в діапазоні від +9 до +16.
| пік | м/ з | Z | \(m\) |
|---|---|---|---|
| М 1 | 1112 | 9 | \ (m\) ">9,999 |
| М 2 | 1001 | 10 | \ (m\) ">10,000 |
| М 3 | 910 | 11 | \ (m\) ">9,999 |
| М 4 | 834 | 12 | \ (m\) ">9,996 |
| М 5 | 770 | 13 | \ (m\) ">9,997 |
| М 6 | 715 | 14 | \ (m\) ">9,996 |
| М 7 | 667 | 15 | \ (m\) ">10,005 |
| М 8 | 626 | — | \ (m\) ">— |
| середня молекулярна маса | \ (m\) ">9,999 | ||
Матрична лазерна десорбція/іонізація Джерела (тверда фаза/м'яке джерело)
Матрична лазерна десорбційна іонізація (MALDI) є м'яким джерелом іонізації для отримання масового спектру біологічно важливих молекул, таких як білки та пептиди. Малюнок\(\PageIndex{7}\) ілюструє основні етапи отримання спектру MALDI. Зразок спочатку змішують з невеликою молекулою, яка називається матрицею, щоб сформувати розчин; матриця зазвичай присутня у співвідношенні 10:1. Краплю цієї суміші поміщають на пробник для проби і дають висохнути, залишаючи зразок в твердому вигляді. Імпульсний лазерний промінь (типовий\(\lambda = 237\) нм) орієнтований на суміш твердого зразка — матриця. Матриця поглинає лазерний імпульс і поглинання енергії лазера випаровує як матрицю, так і зразок. Іонізація зразка утворює молекулярні іони, зазвичай [M + H] + іони, які потім змітаються в аналізатор маси.

Коли в пробі відбувається перетравлення білка, то це суміш пептидів, кожен з яких проявляється як [М + Н] + пік в отриманому спектрі маси. Наприклад, пептид з послідовністю AWSVAR (аланін—триптофан—серин—валін—аланін—аргінін) з'явиться як пік з масою 689,8 дальтонів. Щоб знайти це значення, ми складаємо разом молекулярні маси амінокислот, враховуємо втрату молекули води для кожного пептидного зв'язку, який утворюється, а потім враховуємо водень, який дає [M + H] + іон. У цьому випадку ми маємо
\[ \ce{[M + H]^+} = 89.1 + 204.2 + 105.1 + 117.1 + 89.1 + 174.2 - (5 \times 18.0) + 1 = 689.8 \text{ amu} \nonumber \]
де термін\(5 \times 18.0\) припадає на втрату п'яти молекул\(\ce{H2O}\) при утворенні п'яти пептидних зв'язків.
Джерела швидкого бомбардування атомів (рідка фаза/м'яке джерело)
Швидка бомбардування атомами (FAB) несе деяку схожість з MALDI: зразок змішується з рідкою матрицею (часто гліцерином) і бомбардується пучком атомів ксенону або аргону (замість лазера). Десорбція зразка з його матриці утворює іони газової фази, які змітаються в мас-аналізатор. Спектри зазвичай містять як молекулярний іон, так і фрагментаційні візерунки.
