20.4: Застосування молекулярної мас-спектрометрії
- Page ID
- 27111
Якісні програми
У якісному аналізі наша зацікавленість полягає у визначенні ідентичності цікавить нас речовини. Сама по собі мас-спектрометрія є потужним інструментом для визначення ідентичності чистих сполук. Аналіз сумішей, однак, можливий, якщо ми використовуємо мас-спектрометр як детектор для техніки поділу, наприклад газової хроматографії, або якщо ми послідовно поєднуємо два або більше аналізаторів маси.
Ідентифікація чистих сполук
Існує кілька способів використання масового спектру для ідентифікації сполуки, включаючи визначення його молекулярної маси, використання ізотопних співвідношень, вивчення моделей фрагментації та пошук через бази даних.
Використання інформації про молекулярну вагу. Молекулярний іонний пік, M +•, коли він присутній, [M + H] + пік або [M - H] + пік, надає інформацію про молекулярну масу сполуки. При використанні мас-аналізатора низької роздільної здатності цього може бути достатньо, щоб розрізняти молекулярні іони з, наприклад, номінальною масою 95 аму і номінальною масою 96 аму, але недостатньою для розрізнення молекулярних іонів з більш точною масою 96.0399 аму і 96.0575 аму. При використанні аналізатора маси з високою роздільною здатністю різниця між останньою парою молекулярних іонів може бути здійсненною.
Використання ізотопних коефіцієнтів. Молекула циклогептену має формулу С 7 Н 12 і номінальну масу 96 аму, а молекула циклогексенона має формулу C 6 H 8 O і номінальну масу 96 аму. Хоча обидві молекули будуть виробляти молекулярний іон з однаковим номінальним співвідношенням маси до заряду, кожна також матиме пік з номінальною масою М + 1 через наявність ізотопів вуглецю, водню та кисню. Оскільки циклогептен і циклогексенон мають різні хімічні формули, відносні висоти їх піків M + 1 різні. Ось як ми можемо це зробити.
На кожні 100 атомів 12 С припадає 1,08 атома по 13 С (тобто 1,08% атомів вуглецю - 13 С), на кожні 100 атомів 1 Н припадає 0,015 атома по 2 Н, а на кожні 100 атомів 16 О припадає 0,04 атома 17 О. Для циклогептену це означає, що відносна висота його піку M + 1 до піку M дорівнює
\[(7 \times 1.08) + (12 \times 0.015) = 7.74 \nonumber \]
і для циклогексенону у нас є
\[(6 \times 1.08) + (8 \times 0.015) + (1 \times 0.04) = 6.64 \nonumber \]
Тут ми бачимо, що ретельний огляд відносної висоти піка М + 1 дає можливість розрізнити C 7 H 12 і C 6 H 8 O, навіть якщо вони мають однакові номінальні маси. Доступні он-лайн калькулятори - це посилання містить один приклад - який ви можете використовувати для обчислення повних ізотопних моделей достатку, включаючи M + 2, M + 3 та інші піки. Ізотопні візерунки особливо корисні для ідентифікації присутності хлору та брому в молекулі, оскільки кожен має один ізотоп зі значною кількістю: для хлору 37 Cl має велику кількість 32,5% щодо 35 Cl, а для брому 81 Br має велику кількість 98,0% від 79 Бр.
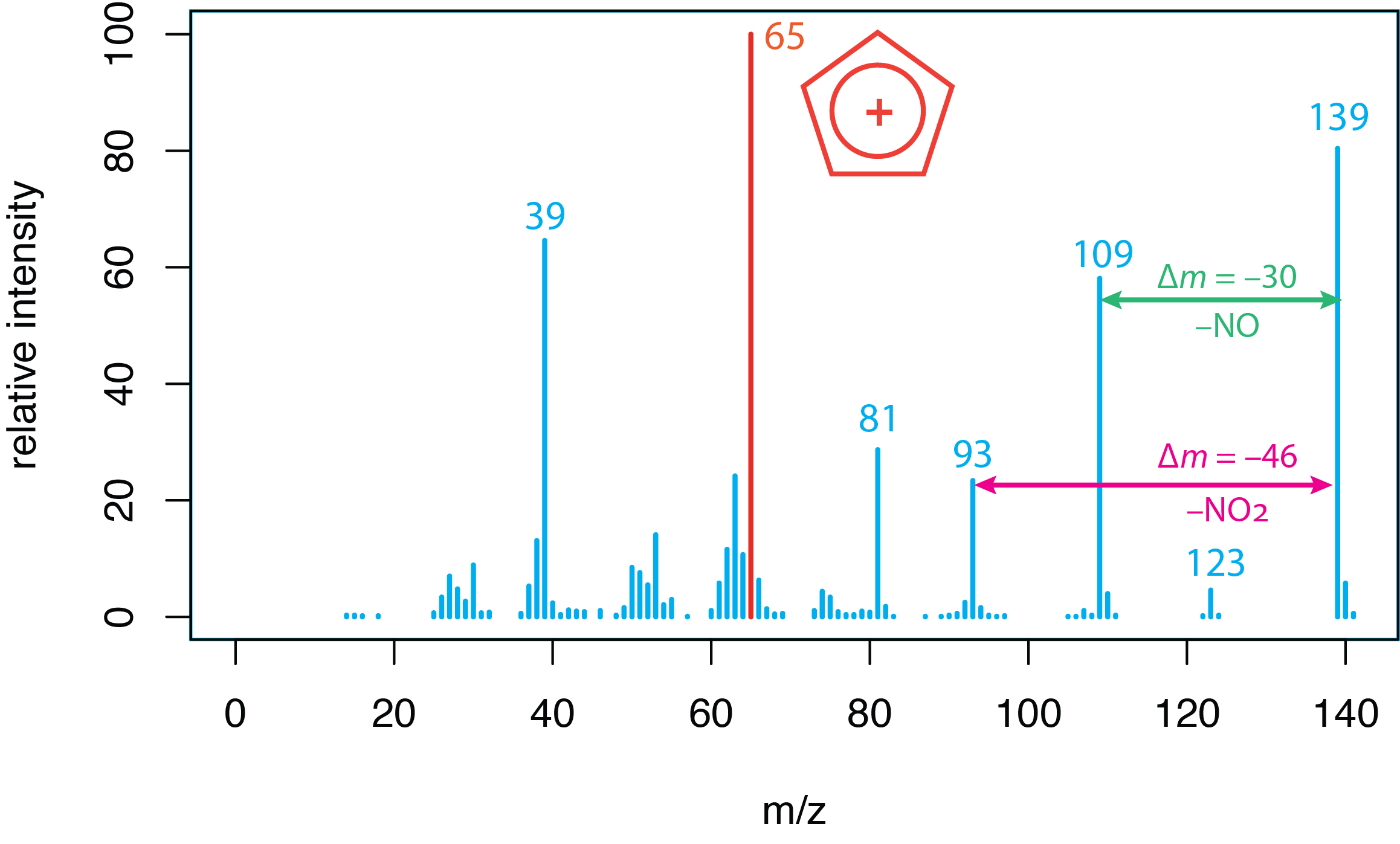
Використання шаблонів фрагментації. \(\PageIndex{1}\)На малюнку показаний масовий спектр р -нітрофенолу, який ми вперше розглянули в розділі 20.1. Масовий спектр молекули унікальний і містить інформацію, яку ми можемо використовувати для виведення її структури. Інтерпретація масового спектру спирається на виявлення можливих джерел втрати маси, таких як a\(\Delta m\) 30 amu, що відповідає втраті NO, або a\(\Delta m\) 46 amu, що відповідає втраті NO 2. Деякі співвідношення маси до заряду визнаються доказом для конкретного іона, наприклад C 5 H 5 + при співвідношенні маси до заряду 65. Інтерпретація моделей фрагментації висвітлюється в інших місцях навчальної програми, особливо в органічній хімії, і тут не приділяється більше уваги.
Використання комп'ютерного пошуку. Доступні великі бази даних масових спектрів (див. тут джерело з NIST). Пікова таблиця співвідношень маси до заряду і пікових інтенсивностей для вибірки вводиться в алгоритм, який здійснює пошук в базі даних і визначає найбільш ймовірні збіги.
Аналіз сумішей з використанням МС як детектора для поділу ГК або LC
Мас-спектрометрія є потужним аналітичним методом, коли зразок, який ми аналізуємо, є чистим (або якщо домішки мають досить низьку концентрацію, що вони мало впливають на масовий спектр). Для суміші двох і більше аналітів інтерпретація масового спектру утруднена, якщо не неможлива. Для аналізу такої суміші нам знадобиться засіб відокремлення аналітів один від одного. Один з підходів полягає в інтерфейсі мас-спектрометра до газового хроматографа або рідинного хроматографа. ГК, або LC розділяє суміш на складові частини за допомогою мас-спектрометра, який служить детектором. Див. розділ 27 та розділ 28 для отримання додаткової інформації про GC-MS та LC-MS.
Аналіз сумішей за допомогою тандемної мас-спектрометрії
Інший підхід до роботи зі складним зразком полягає у використанні двох або більше мас-аналізаторів в тому, що називається тандемною мас-спектрометрії. Наприклад, якщо розмістити три квадрупольні аналізатори маси в послідовності, ми можемо використовувати джерело м'якої іонізації для генерації переважно молекулярних іонів форми [M + H] + для кожного з аналітів зразка, а потім дозволити першому квадруполі розділити ці молекулярні іони за різницею в їх масі до- коефіцієнт заряду. Молекулярні іони [M + H] + для одного з аналітів потім вибірково передаються у другий квадруполь, де йому дозволяється піддаватися фрагментації при зіткненні з газом, таким як Він. Нарешті, ці фрагментні іони передаються уздовж третього квадруполя, де отримують масовий спектр. Послідовно пропускаючи кожен з молекулярних іонів з першого квадруполя через другий і третій квадруполя, ми можемо отримати масові спектри для кожної молекули в суміші.
Кількісні програми
Як детектор для інших інструментальних методів, таких як газова хроматографія та рідинна хроматографія, мас-спектрометрія передбачає кількісний аналіз шляхом моніторингу або загальної кількості іонів, або шляхом моніторингу іонів одного співвідношення маси до заряду, яке відоме як селективний моніторинг іонів. Як незалежний метод визначення концентрації аналіта, мас-спектрометрія менш приваблива через складність контролю кількості зразка або стандарту, введеного в прилад, і впливу матриці зразка на фрагментацію. Використання внутрішнього стандарту підвищує точність і точність.
