15.3: Застосування та методи фотолюмінесценції
- Page ID
- 27027
Кількісні програми
Молекулярна флуоресценція і, в меншій мірі, фосфоресценція використовуються для прямого або непрямого кількісного аналізу аналітів в різних матрицях. Прямий кількісний аналіз можливий, коли флуоресцентний або фосфоресцентний квантовий вихід аналіта сприятливий. Якщо аналіт не є флуоресцентним або фосфоресцирующим, або якщо квантовий вихід несприятливий, то непрямий аналіз може бути здійсненним. Одним із підходів є реакція аналіту з реагентом для утворення продукту, який є флуоресцентним або фосфоресцирующим. Інший підхід полягає в вимірюванні зменшення флуоресценції або фосфоресценції, коли аналіт додається до розчину, який містить флуоресцентну або фосфоресцентну молекулу зонда. Зниження емісії спостерігається, коли реакція між аналітом і молекулою зонда посилює безрадіаційну дезактивацію або призводить до невипромінюючого продукту. У цьому розділі розглянуто застосування флуоресценції та фосфоресценції до неорганічних та органічних аналітів.
неорганічні аналіти
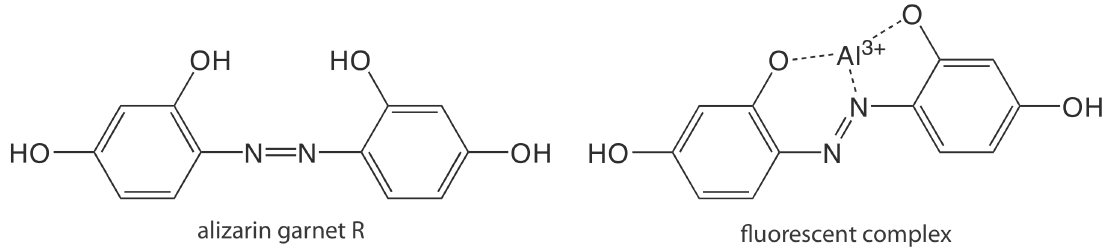
За винятком декількох іонів металів, особливо\(\text{UO}_2^+\), більшість неорганічних іонів недостатньо флуоресцентні для прямого аналізу. Багато іони металів визначаються опосередковано шляхом взаємодії з органічним лігандом з утворенням флуоресцентного або, рідше, фосфоресцентного комплексу метал-ліганд. Одним із прикладів є реакція Al 3 + з натрієвою сіллю 2, 4, 3′-тригідроксиазобензен-5′-сульфонової кислоти - також відомої як алізарин гранат R - який утворює флуоресцентний комплекс метал-ліганд (рис.\(\PageIndex{1}\)). Аналіз проводиться з використанням довжини хвилі збудження 470 нм, при цьому флуоресценція контролюється при 500 нм. У таблиці\(\PageIndex{1}\) наведено додаткові приклади хелатних реагентів, що утворюють флуоресцентні комплекси метал—ліганд з іонами металів. Кілька неорганічних неметалів визначаються їх здатністю знижувати або гасити флуоресценцію іншого виду. Одним із прикладів є аналіз для F - на основі його здатності гасити флуоресценцію комплексу граната Al 3 + -алізарину.
| хелатуючий агент | іони металів |
|---|---|
| 8-гідроксихінолін | Al 3 +, Be 2 +, Zn 2 +, Li +, Mg 2 + (та інші) |
| флавональний | Зр 2 +, Сн 4 + |
| бензоїн | \(\text{B}_4\text{O}_6^{2-}\), Зн 2 + |
| \(2^{\prime},3^{\prime},4^{\prime},5,7-\text{pentahydroxylflavone}\) | Бути 2 + |
| 2- (о -гідроксифеніл) бензоксазол | Кд 2 + |
Органічні аналіти
Як зазначалося раніше, органічні сполуки, які містять ароматичні кільця, як правило, є флуоресцентними, а ароматичні гетероцикли часто є фосфоресцентними. Таблиця\(\PageIndex{2}\) містить приклади декількох важливих біохімічних, фармацевтичних та екологічних сполук, які кількісно аналізуються за допомогою флуориметрії або фосфориметрії. Якщо органічний аналіт не є природним флуоресцентним або фосфоресцентним, можливо, його можна включити в хімічну реакцію, яка виробляє флуоресцентний або фосфоресцентний продукт. Наприклад, фермент креатинфосфокінази визначається шляхом його використання для каталізації утворення креатину з фосфокреатину. Реакція креатину з нінгідрином виробляє флуоресцентний продукт невідомої структури.
| клас | сполуки (F = флуоресценція, P = фосфоресценція) |
|---|---|
| ароматичні амінокислоти |
фенілаланін (F) тирозин (F) триптофан (F, P) |
| вітаміни |
вітамін А (F) вітамін В2 (F) вітамін В6 (F) вітамін В12 (F) вітамін Е (F) фолієва кислота (F) |
| катехоламіни |
дофамін (F) норадреналін (F) |
| Фармацевтика і лікарські засоби |
хінін (F) саліцилова кислота (F, P) морфін (F) барбітурати (F) ЛСД (Ф) кодеїн (P) кофеїн (P) сульфаніламід (Р) |
| забруднювачі навколишнього середовища |
пірен (F) бензо [а] пірен (F) органотіофосфорні пестициди (F) карбаматні інсектициди (F) ДДТ (Р) |
Стандартизація методу
У розділі 15.1 показано, що інтенсивність флуоресценції або фосфоресценції є лінійною функцією концентрації аналіту за умови, що поглинання зразка вихідного випромінювання (\(A = \varepsilon bC\)) менше приблизно 0,01. Калібрувальні криві часто є лінійними на чотири-шість порядків величини для флуоресценції та понад два-чотири порядки для фосфоресценції. Для більш високих концентрацій аналіту калібрувальна крива стає нелінійною, оскільки припущення про те, що поглинання незначне, більше не застосовується. Нелінійність може спостерігатися при менших концентраціях аналітних флуоресцентних або фосфоресцентних забруднень. Як обговорювалося раніше, квантова ефективність чутлива до температури і матриці зразків, обидва з яких повинні контролюватися при використанні зовнішніх стандартів. Крім того, інтенсивність випромінювання залежить від молярної поглинання фотолюмінесцентного виду, чутливого до матриці зразка.
Представницький метод: Визначення хініну в сечі
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий аналітичний метод. Хоча кожен метод унікальний, наступний опис визначення хініну в сечі дає повчальний приклад типової процедури. Опис тут засновано на Муле, С.Дж.; Хушині, П.Л. анал. Хім. 1971, 43, 708—711, і О'Рейлі, Дж. Е.; Дж. Едук. 1975, 52, 610-612.
Опис методу
Хінін - алкалоїд, який використовується для лікування малярії. Являє собою сильно флуоресцентне з'єднання в розведених розчинами H 2 SO 4 (\(\Phi_f = 0.55\)). Спектр збудження хініну має смуги поглинання на 250 нм і 350 нм, а його спектр випромінювання має єдину смугу випромінювання при 450 нм. Хінін швидко виводиться з організму з сечею і визначається шляхом вимірювання його флуоресценції після його вилучення з зразка сечі.
Порядок дій
Перенесіть 2,00-мл зразка сечі в 15-мл пробірку і використовуйте 3,7 М NaOH, щоб відрегулювати його рН до 9 і 10. Додайте 4 мл суміші хлороформу та ізопропанолу 3:1 (в/в) і струсіть вміст пробірки протягом однієї хвилини. Дозвольте органічному та водному (сечі) шарам відокремити та перенести органічну фазу в чисту пробірку. Додайте 2,00 мл 0,05 M H 2 SO 4 до органічної фази і струсіть вміст протягом однієї хвилини. Дозвольте органічному та водному шарам відокремити та перенести водну фазу в клітинку зразка. Виміряйте флуоресцентне випромінювання при 450 нм, використовуючи довжину хвилі збудження 350 нм. Визначають концентрацію хініну в пробі сечі за допомогою набору зовнішніх норм в 0,05 М Н 2 SO 4, приготованого з 100,0 проміле розчину хініну в 0,05 M H 2 SO 4. В якості заготовки використовуйте дистильовану воду.
Питання
1. Хлорид-іон гасить інтенсивність флуоресцентного випромінювання хініну. Наприклад, за наявності 100 ppm NaCl (61 ppm Cl —) інтенсивність викиду хініну становить лише 83% від інтенсивності його емісії за відсутності хлориду. Наявність 1000 ppm NaCl (610 ppm Cl —) додатково знижує флуоресцентну емісію хініну до менш ніж 30% інтенсивності його емісії за відсутності хлориду. Концентрація хлориду в сечі зазвичай коливається в межах 4600—6700 ppm Cl —. Поясніть, як ця процедура запобігає втручанню хлориду.
У процедурі використовується два вилучення. У першому з цих екстракцій хінін відокремлюють від сечі шляхом екстракції його в суміш хлороформу і ізопропанолу, залишаючи іон хлориду позаду в вихідному зразку.
2. Зразки сечі можуть містити невелику кількість інших флуоресцентних сполук, які будуть заважати аналізу, якщо їх проводити через два екстракції. Поясніть, як можна змінити процедуру, щоб врахувати це?
Одним із підходів є підготовка заготовки, яка використовує зразок сечі, який, як відомо, не містить хініну. Віднімання флуоресцентного сигналу бланка з виміряної флуоресценції із зразків сечі коригує інтерференційні сполуки.
3. Флуоресцентне випромінювання для хініну при 450 нм може бути індуковано за допомогою частоти збудження 250 нм або 350 нм. Флуоресцентна квантова ефективність однакова для будь-якої довжини хвилі збудження. Спектр поглинання хініну показує,\(\varepsilon_{250}\) що більше, ніж\(\varepsilon_{350}\). Враховуючи, що хінін має більш сильне поглинання при 250 нм, поясніть, чому його інтенсивність флуоресцентного випромінювання більша при використанні 350 нм в якості довжини хвилі збудження.
Ми знаємо, що I f є функцією наступних термінів: k\(\Phi_f\),, P 0\(\varepsilon\), b, і C. Ми знаємо\(\Phi_f\), що b і C однакові для обох довжин хвиль збудження, і\(\varepsilon\) це більше для довжини хвилі 250 нм; отже, ми можемо ігнорувати ці терміни. Більша інтенсивність випромінювання при використанні довжини хвилі збудження 350 нм повинна бути обумовлена більшим значенням для Р 0 або k. Насправді P 0 при 350 нм для дугової лампи високого тиску Xe становить близько 170% від цього при 250 нм. Крім того, чутливість типового фотомультиплікатора детектора (що сприяє значенню k) при 350 нм становить близько 140% від такої при 250 нм.
Для оцінки описаного вище методу готують і аналізують ряд зовнішнього стандарту, надаючи результати, наведені в наступній таблиці. Всі флуоресцентні інтенсивності коригуються за допомогою заготовки, приготовленої з зразка сечі без хініну. Флуоресцентні інтенсивності нормалізуються шляхом встановлення I f для найвищого стандарту концентрації до 100.
| [хінін] (мкг/мл) | I ф |
|---|---|
| 1.00 | 10.11 |
| 3.00 | 30.20 |
| 5.00 | 49.84 |
| 7.00 | 69.89 |
| 10.00 | 100.0 |
Після прийому 10,0 мг хініну волонтер надає зразок сечі через 24 години. Аналіз зразка сечі дає відносну інтенсивність викиду 28,16. Повідомте про концентрацію хініну в зразку в мг/л і відсоток відновлення для прийнятого хініну.
Рішення
Лінійна регресія відносної інтенсивності випромінювання в порівнянні з концентрацією хініну в стандартах дає калібрувальну криву, наведену нижче, і наступне калібрувальне рівняння.
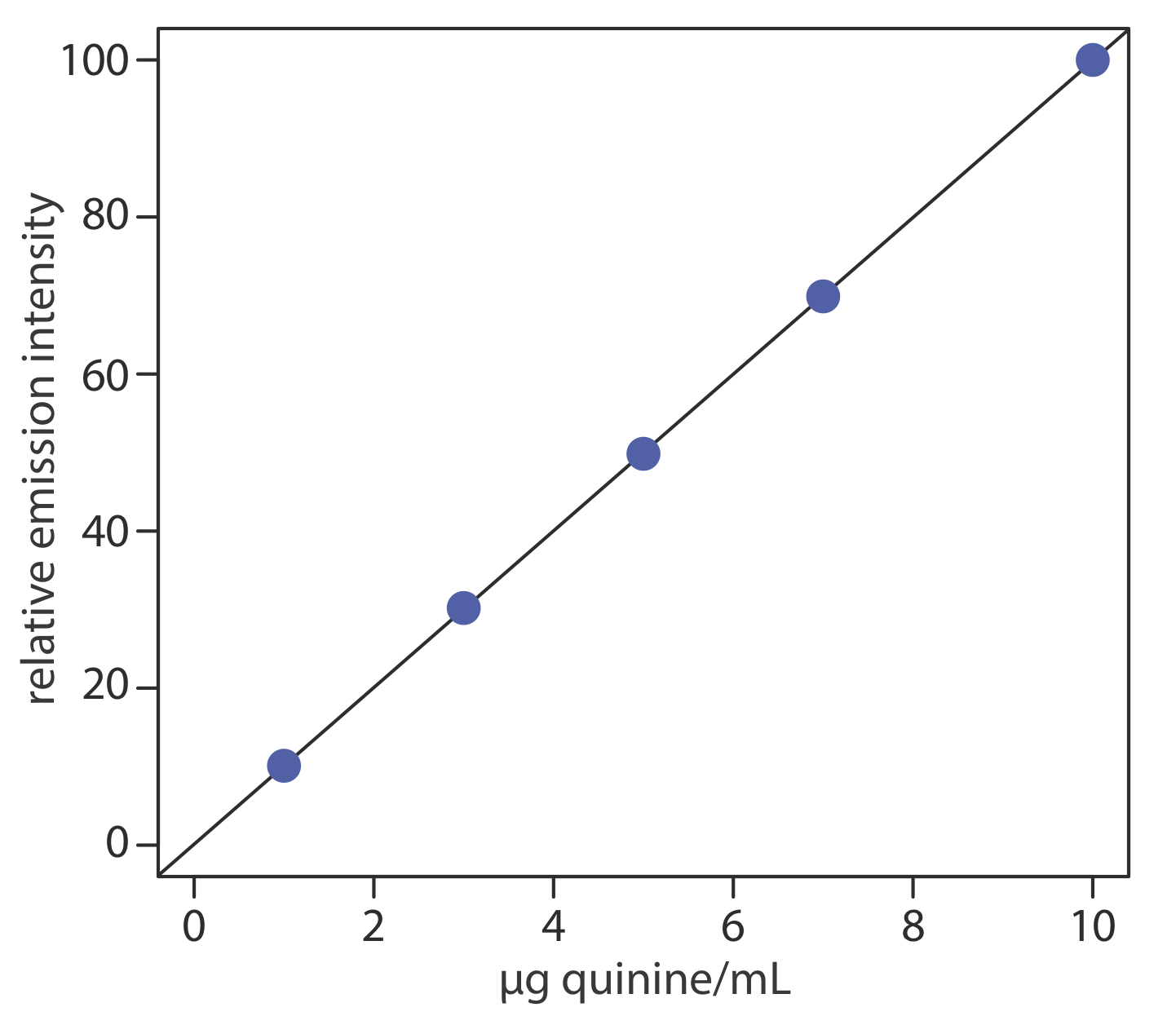
\[I_{f}=0.122+9.978 \times \frac{\mathrm{g} \text { quinine }}{\mathrm{mL}} \nonumber \]
Підстановка відносної інтенсивності випромінювання зразка в калібрувальне рівняння дає концентрацію хініну як 2,81 мкг/мл. Оскільки обсяг взятої сечі, 2,00 мл, такий же, як об'єм 0,05 M H 2 SO 4, який використовується для вилучення хініну, концентрація хініну в сечі також становить 2,81 мкг/мл. Відновлення проковтнутого хініну є
\[\frac{\frac{2.81 \ \mu \mathrm{g} \text { quinine }}{\mathrm{mL} \text { urine }} \times 2.00 \ \mathrm{mL} \text { urine } \times \frac{1 \mathrm{mg}}{1000 \ \mu \mathrm{g}}} {10.0 \ \mathrm{mg} \text { quinine ingested }} \times 100=0.0562 \% \nonumber \]
Для повного виведення з організму хініну може знадобитися 10-11 днів, тому не дивно, що з цього зразка сечі відновлюється така невелика кількість хініну.
