15.1: Теорія флуоресценції та фосфоресценції
- Page ID
- 27026
Використання молекулярної флуоресценції для якісного аналізу та напівкількісного аналізу датується початком-серединою 1800-х років, з більш точними кількісними методами, що з'явилися в 1920-х роках. Прилади для флуоресцентної спектроскопії з використанням фільтра або монохроматора для вибору довжини хвилі з'явилися, відповідно, в 1930-х і 1950-х роках. Хоча відкриття фосфоресценції передувало флуоресценції майже 200 років, якісне та кількісне застосування молекулярної фосфоресценції не приділяло великої уваги лише після розробки приладів флуоресценції.
Джерело флуоресценції та фосфоресценції
Фотолюмінесценція ділиться на дві категорії: флуоресценція і фосфоресценція. Пара електронів, які займають однаковий електронний стан заземлення, мають протилежні спини і знаходяться в стані синглетного спина (рис.\(\PageIndex{1}a\)).
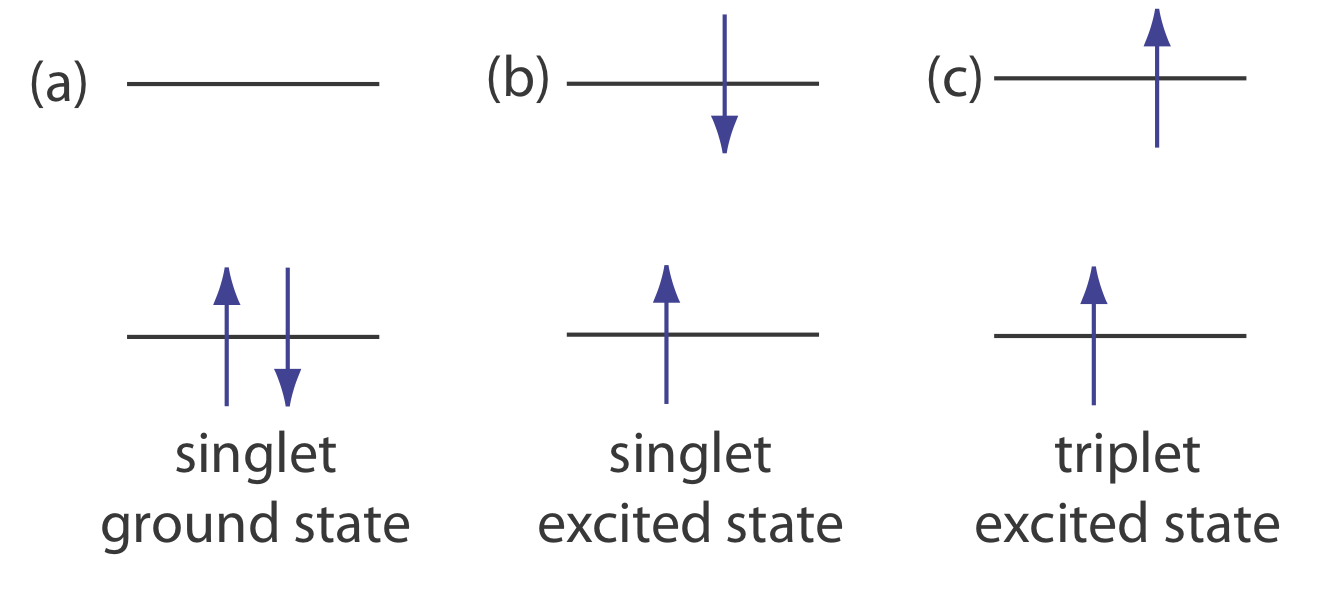
Коли аналіт поглинає ультрафіолет або видимий фотон, один з його валентних електронів переходить з основного стану в збуджений стан зі збереженням спіна електрона (рис.\(\PageIndex{1}b\)). Випромінювання фотона з синглетного збудженого стану до синглетного стану землі - або між будь-якими двома рівнями енергії з однаковим спіном - називається флуоресценцією. Імовірність флуоресценції дуже висока і середній час життя електрона в збудженому стані становить лише 10 —5 —10 —8 с. флуоресценція, отже, швидко розпадається після видалення джерела збудження.
У деяких випадках електрон в синглетному збудженому стані перетворюється в триплетний збуджений стан (рис.\(\PageIndex{1}c\)), в якому його спін більше не парний з наземним станом. Емісія між триплетним збудженим станом і синглетним станом землі - або між будь-якими двома енергетичними рівнями, які відрізняються у відповідних спінових станах - називається фосфоресценцією. Оскільки середній термін служби фосфоресценції може бути досить довгим - він коливається від 10 до 4 - 10 4 секунд - фосфоресценція може тривати деякий час після того, як ми видалимо джерело збудження.
Щоб оцінити походження флуоресценції та фосфоресценції, ми повинні розглянути, що відбувається з молекулою після поглинання фотона. Припустимо, що спочатку молекула займає найнижчий коливальний енергетичний рівень свого електронного стану землі, який є синглетним станом з позначкою S 0 на малюнку\(\PageIndex{2}\). Поглинання фотона збуджує молекулу до одного з декількох коливальних енергетичних рівнів в першому збудженому електронному стані, S 1, або другому електронному збудженому стані, S 2, обидва з яких є синглетними станами. Релаксація до стану землі відбувається цілим рядом механізмів, деякі з яких призводять до випромінювання фотона, а інші, що відбуваються без випромінювання фотона. Ці механізми релаксації показані на рис\(\PageIndex{2}\). Найбільш вірогідний шлях розслаблення від будь-якого збудженого стану - це той, який має найкоротший термін життя.

Процеси деактивації
Молекула в збудженому стані може повернутися до свого основного стану різними способами, які ми разом називаємо дезактиваційними процесами.
Безрадіаційна дезактивація
Коли молекула розслабляється, не випромінюючи фотон, ми називаємо процес безрадіаційної дезактивацією. Одним із прикладів безрадіаційної деактивації є вібраційна релаксація, при якій молекула в збудженому коливальному енергетичному рівні втрачає енергію, переходячи на більш низький рівень вібраційної енергії в тому ж електронному стані. Вібраційна релаксація дуже швидка, із середнім терміном життя <10 —12 с Оскільки вібраційна релаксація настільки ефективна, молекула в одному з вищих коливальних енергетичних рівнів збудженого стану швидко повертається до найнижчого коливального енергетичного рівня збудженого стану.
Іншою формою безрадіаційної деактивації є внутрішнє перетворення, при якому молекула в грунті коливального рівня збудженого стану переходить безпосередньо в більш високий коливальний енергетичний рівень нижчого енергетичного електронного стану того ж спінового стану. Шляхом поєднання внутрішніх перетворень і коливальних розслаблень молекула в збудженому електронному стані може повернутися в наземний електронний стан, не випромінюючи фотона. Споріднена форма безрадіаційної дезактивації - це зовнішнє перетворення, при якому надлишкова енергія передається розчиннику або іншому компоненту матриці зразка.
Давайте використаємо Рисунок,\(\PageIndex{2}\) щоб проілюструвати, як молекула може розслабитися до свого наземного стану, не випромінюючи фотон. Припустимо, наша молекула знаходиться в найвищому коливальному енергетичному рівні другого електронного збудженого стану. Після того, як ряд коливальних релаксацій доводить молекулу до найнижчого коливального енергетичного рівня S 2, вона піддається внутрішньому перетворенню в більш високий коливальний енергетичний рівень першого збудженого електронного стану. Вібраційні релаксації доводять молекулу до найнижчого коливального енергетичного рівня S 1. Після внутрішнього перетворення в більш високий коливальний енергетичний рівень основного стану молекула продовжує піддаватися коливальній релаксації, поки не досягне найнижчого коливального енергетичного рівня S 0.
Кінцевою формою безрадіаційної деактивації є міжсистемний перетин, при якому молекула в землі коливального енергетичного рівня збудженого електронного стану переходить в один з вищих коливальних енергетичних рівнів нижчого енергетичного електронного стану з іншим спіновим станом. Наприклад, міжсистемний перетин показано на малюнку\(\PageIndex{2}\) між синглетним збудженим станом S 1 і триплетним збудженим станом T 1.
Змінні які впливають на флуоресценцію
Флуоресценція виникає, коли молекула в збудженому стані найнижчий рівень вібраційної енергії повертається до нижчого енергетичного електронного стану, випромінюючи фотон. Оскільки молекули повертаються до свого основного стану найшвидшим механізмом, флуоресценція спостерігається лише в тому випадку, якщо вона є більш ефективним засобом релаксації, ніж поєднання внутрішніх перетворень і вібраційних релаксацій.
Кількісним вираженням ефективності флуоресценції є флуоресцентний квантовий вихід\(\Phi_f\), який є часткою збуджених молекул стану, які повертаються до основного стану шляхом флуоресценції. Флуоресцентні квантові виходи варіюються від 1, коли кожна молекула в збудженому стані піддається флуоресценції, до 0, коли флуоресценція не відбувається.
Інтенсивність флуоресценції, I f, пропорційна кількості випромінювання, поглиненого зразком, P 0 - P T, і квантовому виходу флуоресценції
\[I_{f}=k \Phi_{f}\left(P_{0}-P_{\mathrm{T}}\right) \label{10.1} \]
де k - константа, яка становить ефективність збору та виявлення флуоресцентного випромінювання. З закону Пива ми знаємо, що
\[\frac{P_{\mathrm{T}}}{P_{0}}=10^{-\varepsilon b C} \label{10.2} \]
де С - концентрація флуоресцентних видів. Розв'язування рівняння\ ref {10.2} для P T і підстановка в рівняння\ ref {10.1} дає, після спрощення
\[I_{f}=k \Phi_{f} P_{0}\left(1-10^{-\varepsilon b C}\right) \label{10.3} \]
При\(\varepsilon bC\) < 0,01, що часто буває, коли концентрація аналіта мала, Equation\ ref {10.3} спрощує
\[I_{f}=2.303 k \Phi_{f} \varepsilon b C P_{0}=k^{\prime} P_{0} \label{10.4} \]
де k ′ — сукупність констант. Інтенсивність флуоресценції, отже, збільшується зі збільшенням квантової ефективності, падаючої потужності джерела та молярної поглинання та концентрації флуоресцентних видів.
Флуоресценція, як правило, спостерігається, коли найнижче поглинання енергії молекули є\(\pi \rightarrow \pi^*\) переходом, хоча деякі\(n \rightarrow \pi^*\) переходи показують слабку флуоресценцію. Багато незаміщені, негетероциклічні ароматичні сполуки мають сприятливий квантовий вихід флуоресценції, хоча заміни на ароматичному кільці можуть впливати\(\Phi_f\) значно. Наприклад, присутність групи відведення електронів, такої як —NO 2, зменшується\(\Phi_f\), при додаванні електронної донорської групи, такої як —OH, збільшується\(\Phi_f\). Флуоресценція також збільшується для ароматичних кільцевих систем та ароматичних молекул з жорсткими площинними структурами. \(\PageIndex{3}\)На малюнку показана флуоресценція хініну під УФ-лампою.

На флуоресцентний квантовий вихід молекули також впливають зовнішні змінні, такі як температура та розчинник. Підвищення температури, як правило, зменшується,\(\Phi_f\) оскільки частіші зіткнення між молекулою і розчинником збільшує зовнішню конверсію. Зниження в'язкості розчинника зменшується з аналогічних\(\Phi_f\) причин. Для аналіту з кислотними або основними функціональними групами зміна рН може змінити структуру аналіта та його флуоресцентні властивості.
Як показано на малюнку\(\PageIndex{3}\), флуоресценція може повернути молекулу до будь-якого з декількох коливальних енергетичних рівнів в наземному електронному стані. Таким чином, флуоресценція виникає в діапазоні довжин хвиль. Оскільки зміна енергії для флуоресцентного випромінювання, як правило, менше, ніж для поглинання, спектр флуоресценції молекули зміщується на більш високі довжини хвиль, ніж спектр її поглинання.
Змінні, що впливають на фосфоресценцію
Молекула в триплетному електронному збудженому стані найнижчий рівень вібраційної енергії зазвичай розслабляється до основного стану шляхом міжсистемного перетину до синглетного стану або зовнішнім перетворенням. Фосфоресценція виникає, коли молекула розслабляється, випромінюючи фотон. Як показано на малюнку\(\PageIndex{2}\), фосфоресценція відбувається в діапазоні довжин хвиль, всі з яких мають менші енергії, ніж смуга поглинання молекули. Інтенсивність фосфоресценції задається рівнянням\(I_p\), подібним до Equation\ ref {10.4} для флуоресценції
\[\begin{align} I_{P} &= 2.303 k \Phi_{P} \varepsilon b C P_{0} \nonumber \\[4pt] &= k^{\prime} P_{0} \label{10.5} \end{align}\]
де\(\Phi_p\) - квантовий вихід фосфоресценції.
Фосфоресценція найбільш сприятлива для молекул з\(n \rightarrow \pi^*\) переходами, які мають більшу ймовірність міжсистемного перетину, ніж\(\pi \rightarrow \pi^*\) переходи. Наприклад, фосфоресценція спостерігається з ароматичними молекулами, які містять карбонільні групи або гетероатоми. Ароматичні сполуки, які містять атоми галогенідів, також мають більш високу ефективність для фосфоресценції. В цілому збільшення фосфоресценції відповідає зниженню флуоресценції.
Оскільки середній термін служби фосфоресценції може бути досить довгим, починаючи від 10 —4 —10 4 с, квантовий вихід фосфоресценції зазвичай досить малий. Поліпшення\(\Phi_p\) реалізується за рахунок зниження ефективності зовнішнього перетворення. Це досягається декількома способами, включаючи зниження температури, використання більш в'язкого розчинника, осадження зразка на тверду підкладку або захоплення молекули в розчині. \(\PageIndex{4}\)На малюнку показаний приклад фосфоресценції.

Спектри випромінювання та збудження
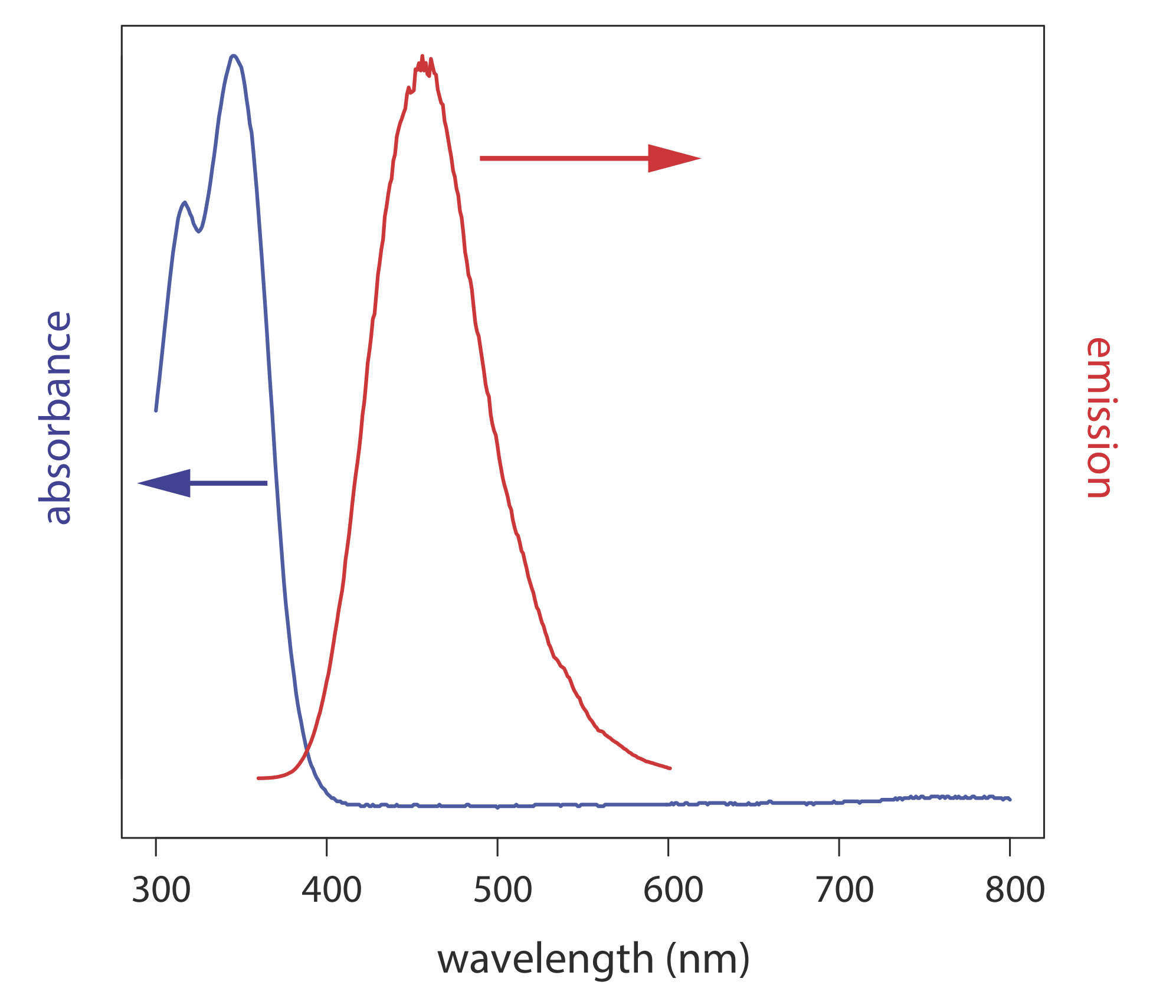
Спектри фотолюмінесценції реєструються шляхом вимірювання інтенсивності випромінюваного випромінювання в залежності від довжини хвилі збудження або довжини хвилі випромінювання. Спектр збудження отримують шляхом моніторингу випромінювання на фіксованій довжині хвилі при зміні довжини хвилі збудження. При корекції варіацій інтенсивності джерела та відгуку детектора спектр збудження зразка майже ідентичний спектру поглинання. Спектр збудження забезпечує зручний засіб для вибору найкращої довжини хвилі збудження для кількісного або якісного аналізу.
У спектрі випромінювання фіксована довжина хвилі використовується для збудження зразка, а інтенсивність випромінюваного випромінювання контролюється як функція довжини хвилі. Хоча молекула має єдиний спектр збудження, вона має два спектри випромінювання, один для флуоресценції та один для фосфоресценції. \(\PageIndex{5}\)На малюнку показаний спектр поглинання УФ та спектр випромінювання ультрафіолетової флуоресценції для хініну.