15.3: Фактори вірулентності
- Page ID
- 3921
Цілі навчання
- Поясніть, як фактори вірулентності сприяють ознакам і симптомам інфекційного захворювання
- Диференціювати ендотоксини та екзотоксини
- Опишіть та розмежуйте різні типи екзотоксинів
- Опишіть механізми використання вірусів для адгезії та антигенної варіації
У попередньому розділі ми пояснили, що деякі збудники є більш вірулентними, ніж інші. Це пов'язано з унікальними факторами вірулентності, що виробляються окремими збудниками, які визначають ступінь і тяжкість захворювання, яке вони можуть викликати. Фактори вірулентності збудника кодуються генами, які можна ідентифікувати за допомогою молекулярних постулатів Коха. Коли гени, що кодують фактори вірулентності інактивуються, вірулентність у збудника зменшується. У цьому розділі ми розглянемо різні типи та конкретні приклади факторів вірулентності та те, як вони сприяють кожному кроку патогенезу.
Фактори вірулентності для адгезії
Як обговорювалося в попередньому розділі, перші два етапи патогенезу - це експозиція та адгезія. Нагадаємо, що адгезин - це білок або глікопротеїн, виявлений на поверхні збудника, який прикріплюється до рецепторів на клітині-господаря. Адгезії виявляються на бактеріальних, вірусних, грибкових та найпростіших збудників. Одним із прикладів бактеріального адгезину є фімбриальний адгезин типу 1, молекула, виявлена на кінчиках фімбрий ентеротоксигенної кишкової палички (ETEC). Нагадаємо, що бахромки - це волосяна білкова щетина на поверхні клітин. Фімбриальний адгезин типу 1 дозволяє фімбріям клітин ЕТЕК прикріплюватися до гліканів маннози, виражених на кишкових епітеліальних клітині. У таблиці\(\PageIndex{1}\) перераховані загальні адгезії, виявлені в деяких патогенних мікроорганізмах, про які ми обговорювали або побачимо пізніше в цьому розділі.
| Збудник | Хвороба | Адгезін | Сайт вкладень | |
|---|---|---|---|---|
| стрептокок піогенний | Стреп в горлі | Протеїн F | Дихальні епітеліальні клітини | |
| Стрептокок мутанс | Карієс зубів | Клей Р1 | Зуби | |
| Нейсерія гонорейна | гонорея | Тип IV котушки | Епітеліальні клітини уретри | |
| Ентеротоксигенна кишкова паличка (ETEC) | Пронос мандрівника | Тип 1 балочка | Клітини епітелію кишечника | |
| холерний вібріон | Холера | N-метилфенілаланін таблетки | Клітини епітелію кишечника |
Клінічна спрямованість: Частина 3
Наявність бактерій в крові Майкла є ознакою зараження, так як кров в нормі стерильна. Немає жодних ознак того, що бактерії потрапили в кров через травму. Натомість, здається, портал входу був шлунково-кишковим шляхом. Виходячи з симптомів Майкла, результатів його аналізу крові та того факту, що Майкл був єдиним у родині, хто брав участь у хот-догах, лікар підозрює, що Майкл страждає на випадок лістеріозу.
Listeria monocytogenes, факультативний внутрішньоклітинний збудник, який викликає лістеріоз, є поширеним забруднювачем готових до вживання продуктів, таких як м'ясо обіду та молочні продукти. Потрапивши всередину, ці бактерії вторгаються в епітеліальні клітини кишечника і транслокуються в печінку, де вони ростуть всередині печінкових клітин. Лістеріоз смертельний приблизно у кожного п'ятого нормального здорового людини, а рівень смертності дещо вищий у пацієнтів з раніше існуючими станами, які послаблюють імунну відповідь. Кластер генів вірулентності, закодованих на острові патогенності, відповідає за патогенність L. monocytogenes. Ці гени регулюються транскрипційним фактором, відомим як фактор вивільнення пептидного ланцюга 1 (PrFA). Одним з генів, що регулюються prFA, є гіл, який кодує токсин, відомий як лістеріолізин O (LLO), який дозволяє бактерії виходити вакуолі при попаданні в клітину-господаря. Другий ген, регульований prFA, - це ActA, який кодує для поверхневого білка, відомого як протеїн, що індукує асамблею актину (ActA). Акта виражається на поверхні лістерій і полімеризує актин господаря. Це дозволяє бактерії виробляти актинові хвости, переміщатися по цитоплазмі клітини та поширюватися від клітини до клітини, не виходячи у позаклітинний відсік.
Стан Михайла почав погіршуватися. Зараз він відчуває ригідність шиї і геміпарез (слабкість однієї сторони тіла). Стурбований тим, що інфекція поширюється, лікар вирішує провести додаткові аналізи, щоб визначити, що викликає ці нові симптоми.
Вправа\(\PageIndex{1}\)
- Який збудник викликає лістеріоз, і які фактори вірулентності сприяють ознакам і симптомам, які переживає Майкл?
- Чи ймовірно, що інфекція пошириться з крові Майкла? Якщо так, то як це може пояснити його нові симптоми?
Бактеріальні екзоферменти та токсини як фактори вірулентності
Після впливу і адгезії наступним етапом патогенезу є інвазія, яка може залучати ферменти і токсини. Багато патогенних мікроорганізмів досягають інвазії, потрапляючи в кров, ефективний засіб дисемінації, оскільки кровоносні судини проходять близько до кожної клітини в організмі. Мінусом цього механізму розгону є те, що в кров також входять численні елементи імунної системи. Для опису присутності збудників у крові використовуються різні терміни, що закінчуються на —emia. Наявність бактерій в крові називається бактеріємією. Бактеріємія за участю піогенів (гноєутворюючих бактерій) називається піємією. Коли віруси виявляються в крові, це називається віремія. Термін токсемія описує стан, коли токсини виявляються в крові. Якщо бактерії присутні і розмножуються в крові, цей стан називається септицемією.
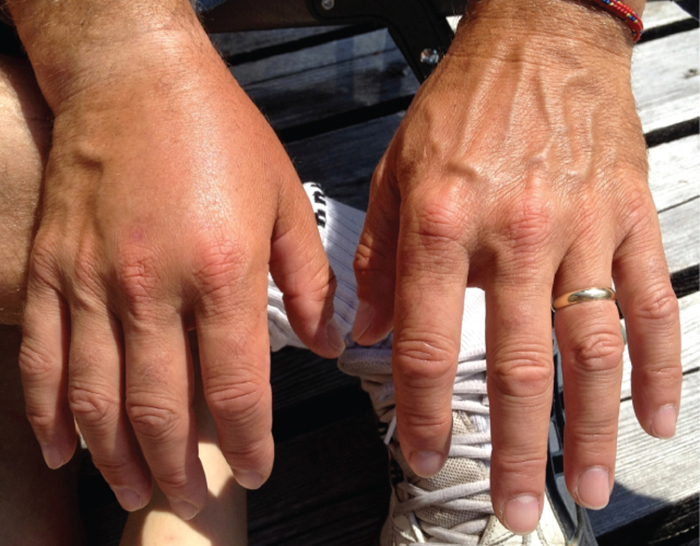
Пацієнтів з септицемією описують як септичний, який може призвести до шоку, небезпечного для життя зниження артеріального тиску (систолічний тиск <90 мм рт.ст.), що перешкоджає клітинам і органам отримувати достатню кількість кисню і поживних речовин. Деякі бактерії можуть викликати шок через виділення токсинів (фактори вірулентності, які можуть спричинити пошкодження тканин) і призвести до низького артеріального тиску. Грамнегативні бактерії поглинаються фагоцитами імунної системи, які потім виділяють фактор некрозу пухлини, молекулу, яка бере участь у запаленні та лихоманці. Фактор некрозу пухлини зв'язується з кровоносними капілярами для підвищення їх проникності, дозволяючи рідині виходити з кровоносних судин і в тканини, викликаючи набряк, або набряк (рис.\(\PageIndex{1}\)). При високих концентраціях фактора некрозу пухлини запальна реакція сильна і з кровоносної системи втрачається достатня кількість рідини, що артеріальний тиск знижується до небезпечно низьких рівнів. Це може мати жахливі наслідки, оскільки серце, легені та нирки покладаються на нормальний кров'яний тиск для правильної роботи; таким чином, може статися поліорганна недостатність, шок та смерть.
Екзоферменти
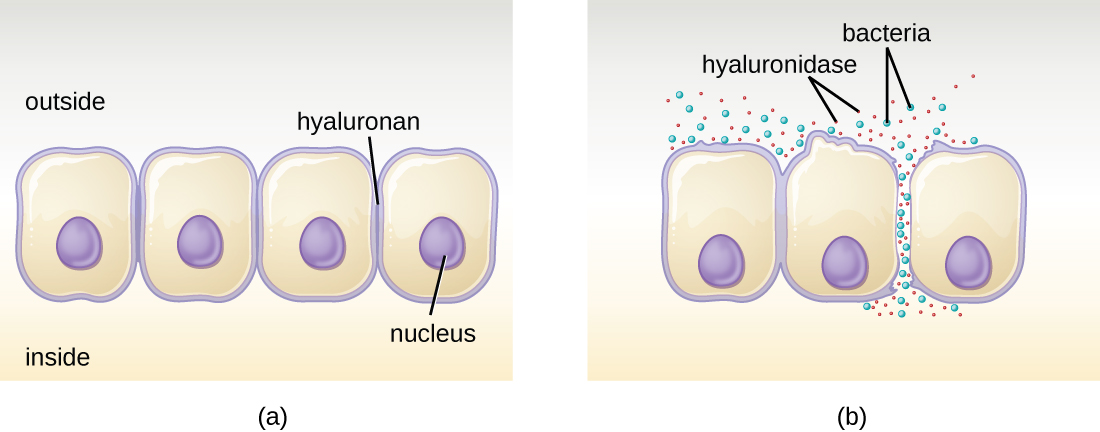
Деякі патогени виробляють позаклітинні ферменти, або екзоферменти, які дозволяють їм вторгатися в клітини господаря і більш глибокі тканини. Екзоферменти мають найрізноманітніші мішені. Деякі загальні класи екзоферментів і супутніх збудників наведені в табл\(\PageIndex{2}\). Кожен з цих екзоферментів функціонує в контексті певної структури тканини, щоб полегшити вторгнення або підтримувати власний ріст і захищати від імунної системи. Наприклад, гіалуронідаза S, фермент, що виробляється патогенами, такими як Staphylococcus aureus, Streptococcus pyogenes та Clostridium perfringens, погіршує глікозид гілауронан (гіалуронова кислота), який діє як міжклітинний цемент між сусідніми клітинами в сполучній тканину (рис.\(\PageIndex{2}\)). Це дозволяє збуднику проходити крізь тканинні шари біля порталу входу і поширюватися в інших місцях тіла (рис.\(\PageIndex{2}\)).
| Клас | Приклад | Функція |
|---|---|---|
| Глікогідролази | Гіалуронідаза S в золотистому стафілококу | Погіршує гіалуронову кислоту, яка цементує клітини разом для сприяння поширенню через тканини |
| нуклеази | ДНКАз, вироблений S. aureus | Погіршує ДНК, що виділяється відмираючими клітинами (бактеріями та клітинами-господарями), які можуть затримувати бактерії, сприяючи тим |
| Фосфоліпази | Фосфоліпаза С Bacillus anthracis | Деградує фосфоліпідний бішар клітин господаря, викликаючи клітинний лізис, і деградує мембрану фагосом, щоб забезпечити вихід у цитоплазму |
| Протеази | Колагеназа в Clostridium перфрінгенс | Погіршує колаген у сполучній тканині для сприяння поширенню |
Нуклеази, що продукуються патогенами, такі як ДНКАза, що виробляється S. aureus, деградують позаклітинну ДНК як засіб втечі та поширення через тканини. Оскільки бактеріальні клітини і клітини господаря гинуть в місці зараження, вони лизуються і виділяють свій внутрішньоклітинний вміст. ДНК-хромосома є найбільшою з внутрішньоклітинних молекул, а маси позаклітинної ДНК можуть затримувати бактерії і перешкоджати їх поширенню. S. aureus виробляє ДНК для деградації сітки позаклітинної ДНК, щоб вона могла втекти і поширюватися на сусідні тканини. Ця стратегія також використовується S. aureus та іншими патогенами для деградації та виходу з павутини позаклітинної ДНК, що виробляється фагоцитами імунної системи для захоплення бактерій.
Ферменти, що руйнують фосфоліпіди клітинних мембран, називаються фосфоліпазами. Їх дії специфічні щодо типу фосфоліпідів, на які вони діють, і де вони ферментативно розщеплюють молекули. Збудник, відповідальний за сибірську виразку, B. anthracis, продукує фосфоліпазу С. Коли B. anthracis потрапляє в організм фагоцитарними клітинами імунної системи, фосфоліпаза С погіршує мембрану фагосоми, перш ніж вона зможе злитися з лізосомою, дозволяючи збуднику втекти в цитоплазми і розмножуються. Фосфоліпази також можуть націлюватися на мембрану, яка охоплює фагосому всередині фагоцитарних клітин. Як описано раніше в цьому розділі, це механізм, який використовується внутрішньоклітинними збудниками, такими як L. monocytogenes та Rickettsia для виходу з фагосоми та розмноження в цитоплазмі фагоцитарних клітин. Роль фосфоліпаз у вірулентності бактерій не обмежується фагосомним втечею. Багато патогенів виробляють фосфоліпази, які діють на деградацію клітинних мембран і викликають лізис клітин-мішеней. Ці фосфоліпази беруть участь у лізисі еритроцитів, лейкоцитів та клітин тканин.
Бактеріальні збудники також виробляють різні ферменти, що перетравлюють білок, або протеази. Протеази можна класифікувати відповідно до їх субстратної мішені (наприклад, серин-протеази цільові білки з амінокислотою серин) або якщо вони містять метали в їх активній ділянці (наприклад, металопротеази цинку містять іон цинку, необхідний для ферментативної активності).
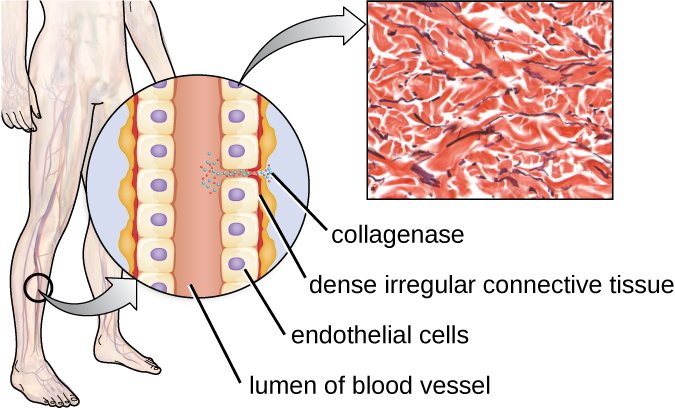
Одним із прикладів протеази, яка містить іон металу, є екзоферментна колагеназа. Колагеназа перетравлює колаген, домінантний білок у сполучній тканині. Колаген можна знайти в позаклітинному матриксі, особливо поблизу слизових оболонок, кровоносних судин, нервів, а також в шарах шкіри. Подібно до гіалуронідази, колагеназа дозволяє збуднику проникати і поширюватися через тканину господаря шляхом перетравлення цього сполучнотканинного білка. Наприклад, колагеназа, що виробляється грампозитивною бактерією Clostridium perfringens, дозволяє бактерії пробиратися через тканинні шари і згодом потрапити і розмножуватися в крові (септицемія). C. perfringens потім використовує токсини і фосфоліпазу, щоб викликати клітинний лізис і некроз. Після того, як клітини господаря загинули, бактерія виробляє газ, ферментуючи м'язові вуглеводи. Поширений некроз тканини і супутнього газу характерні для стану, відомого як газова гангрена (рис.\(\PageIndex{3}\)).
Токсини
Крім екзоферментів, певні хвороботворні мікроорганізми здатні виробляти токсини, біологічні отрути, які сприяють їх здатності вторгатися і завдавати шкоди тканинам. Здатність збудника виробляти токсини, щоб завдати шкоди клітинам господаря називається токсигенністю.
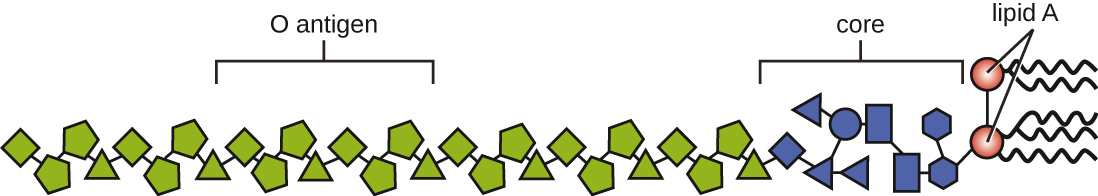
Токсини можна класифікувати як ендотоксини або екзотоксини. Ліпополісахарид (ЛПС), виявлений на зовнішній мембрані грамнегативних бактерій, називається ендотоксином (рис.\(\PageIndex{4}\)). Під час інфекції та захворювання грамнегативні бактеріальні збудники виділяють ендотоксин або тоді, коли клітина гине, в результаті чого відбувається розпад мембрани, або коли бактерія піддається бінарному поділу. Ліпідний компонент ендотоксину, ліпідний А, відповідає за токсичні властивості молекули ЛПС. Ліпідний А відносно зберігається у різних пологах грамнегативних бактерій; отже, токсичні властивості ліпідів А схожі незалежно від грамнегативного збудника. Подібно до фактора некрозу пухлини, ліпідний А запускає запальну реакцію імунної системи (див. Запалення та лихоманка). Якщо концентрація ендотоксину в організмі низька, запальна реакція може забезпечити господареві ефективний захист від інфекції; з іншого боку, високі концентрації ендотоксину в крові можуть викликати надмірну запальну реакцію, що призводить до сильного падіння артеріального тиску, поліорганної невдача, і смерть.
Класичним методом виявлення ендотоксину є використання тесту Limulus амебоцитів лізату (LAL). При цій процедурі клітини крові (амебоцити) краба-підкови (Limulus polyphemus) змішуються з сироваткою пацієнта. Амебоцити відреагують на присутність будь-якого ендотоксину. Цю реакцію можна спостерігати або хромогенно (колір), або шукаючи коагуляцію (реакцію згортання), яка відбудеться всередині сироватки крові. Альтернативним методом, який був використаний, є імуноферментний аналіз (ІФА), який використовує антитіла для виявлення наявності ендотоксину.
На відміну від токсичного ліпідного А ендотоксину, екзотоксини - це білкові молекули, які виробляються найрізноманітнішими живими патогенними бактеріями. Хоча деякі грамнегативні збудники виробляють екзотоксини, більшість виробляються грампозитивними збудниками. Екзотоксини відрізняються від ендотоксину кількома іншими ключовими характеристиками, зведеними в табл\(\PageIndex{3}\). На відміну від ендотоксину, який стимулює загальну системну запальну реакцію при вивільненні, екзотоксини набагато специфічніші за своєю дією і клітинами, з якими вони взаємодіють. Кожен екзотоксин націлений на конкретні рецептори на конкретні клітини і пошкоджує ці клітини за допомогою унікальних молекулярних механізмів. Ендотоксин залишається стабільним при високих температурах і вимагає нагрівання при 121° C (250° F) протягом 45 хвилин для інактивації. На відміну від цього, більшість екзотоксинів є теплолабільними через їх білкову структуру, а багато з них денатуровані (інактивовані) при температурі вище 41° C (106° F). Як обговорювалося раніше, ендотоксин може стимулювати летальну запальну реакцію при дуже високих концентраціях і має вимірюваний LD 50 0, 24 мг/кг. На відміну від цього, дуже малі концентрації екзотоксинів можуть бути летальними. Наприклад, ботулотоксин, який викликає ботулізм, має ЛД 50 0,000001 мг/кг (в 240 000 разів смертельніше, ніж ендотоксин).
| Характерні | Ендотоксин | Екзотоксин |
|---|---|---|
| Джерело | Грамнегативні бактерії | Грампозитивні (в першу чергу) і грамнегативні бактерії |
| Склад | Ліпідний компонент ліпополісахариду | Протеїн |
| Вплив на господаря | Загальні системні симптоми запалення і лихоманки | Специфічні пошкодження клітин, залежні від рецепторно-опосередкованого націлювання клітин і специфічних механізмів дії |
| Стійкість до нагрівання | Тепло стабільне | Більшість з них теплостійкі, але деякі з них термостійкі |
| Світлодіодний 50 | Високі | Низький |
Екзотоксини можна згрупувати в три категорії залежно від їх мети: внутрішньоклітинний таргетинг, порушення мембрани та суперантигени. Таблиця\(\PageIndex{4}\) містить приклади добре охарактеризованих токсинів в межах кожної з цих трьох категорій.
| Категорія | Приклад | Збудник | Механізм і захворювання |
|---|---|---|---|
| Токсини внутрішньоклітинного націлювання | Токсин холери | холерний вібріон | Активація аденілатциклази в клітині кишечника, спричиняючи підвищення рівня циклічного аденозинмонофосфату (цАМФ) та секрецію рідини та електролітів з клітин, викликаючи діарею |
| правцевий токсин | Клостридій чай в | Пригнічує вивільнення гальмівних нейромедіаторів в центральній нервовій системі, викликаючи спастичний параліч | |
| Ботулотоксин | Клостридіум ботулінум | Пригнічує вивільнення нейромедіатора ацетилхоліну з нейронів, що призводить до млявого паралічу | |
| Дифтерійний токсин | Коринебактерія дифтерія | Пригнічення синтезу білка, що викликає клітинну загибель | |
| Токсини, що руйнують мембрану | Стрептолізин | стрептокок піогенний | Білки, які збираються в пори в клітинних мембранах, порушуючи їх функцію і вбиваючи клітину |
| Пневмолізин | Пневмонія стрептокока | ||
| Альфа-токсин | Золотистий стафілокок | ||
| Альфа-токсин | Клостридіум перфрінгенс | Фосфоліпази, що руйнують фосфоліпіди клітинної мембрани, порушуючи мембранну функцію і вбиваючи клітину | |
| Фосфоліпаза С | синьогнійна паличка | ||
| Бета-токсин | Золотистий стафілокок | ||
| Суперантигени | Токсичний шок синдром токсин | Золотистий стафілокок | Стимулює надмірну активацію клітин імунної системи і вивільнення цитокінів (хімічних медіаторів) з клітин імунної системи. Результатом є небезпечна для життя лихоманка, запалення та шок. |
| Стрептококовий мітогенний екзотоксин | стрептокок піогенний | ||
| стрептококові пірогенні токсини | стрептокок піогенний |
Внутрішньоклітинні таргетинні токсини містять два компоненти: A для активності та B для зв'язування. Таким чином, ці види токсинів відомі як екзотоксини А-В (рис.\(\PageIndex{5}\)). Компонент В відповідає за клітинну специфічність токсину і опосередковує початкове приєднання токсину до конкретних рецепторів поверхні клітин. Після того, як А-В-токсин зв'язується з клітиною-господарем, він заноситься в клітину ендоцитозом і захоплюється вакуоллю. Субодиниці A і B відокремлюються, коли вакуоль підкислює. Субодиниця А потім потрапляє в цитоплазму клітини і втручається у специфічну внутрішню клітинну функцію, на яку вона націлена.
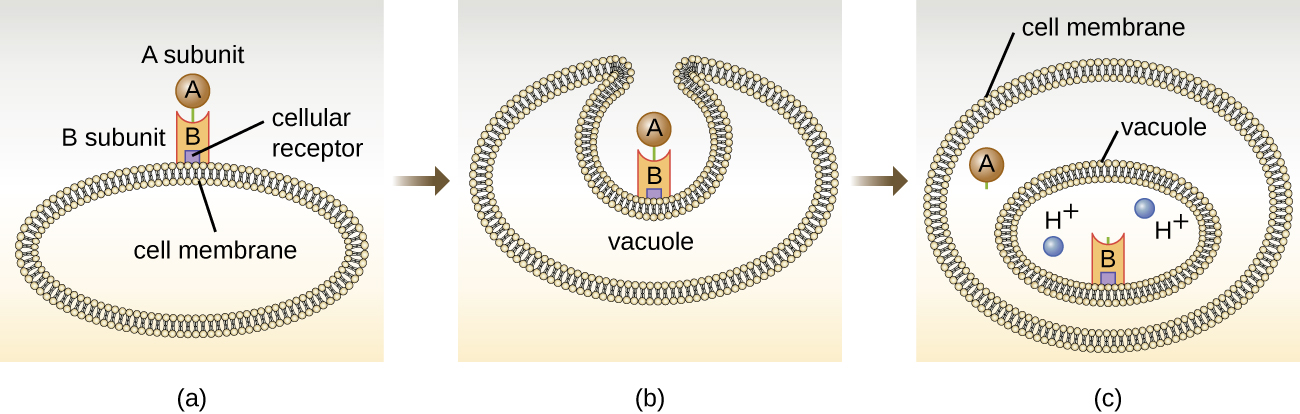
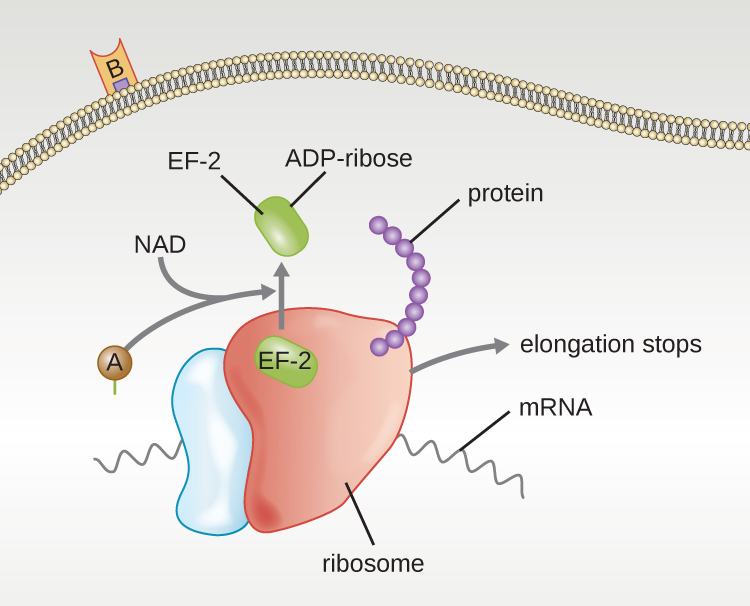
Чотири унікальні приклади токсинів А-В - це токсини дифтерії, холери, ботуліну та правця. Дифтерійний токсин виробляється грампозитивною бактерією Corynebacterium diphtheriae, збудником носоглоткової і шкірної дифтерії. Після того, як субодиниця дифтерійного токсину відокремлюється і отримує доступ до цитоплазми, це полегшує перенесення аденозиндифосфату (АДФ) -рибози на білок фактора подовження (ЕФ-2), який необхідний для синтезу білка. Отже, дифтерійний токсин пригнічує синтез білка в клітині-господаря, в кінцевому підсумку вбиваючи клітину (рис.\(\PageIndex{6}\)).
Холерний токсин - це ентеротоксин, що виробляється грамнегативною бактерією Vibrio cholerae і складається з однієї субодиниці А та п'яти субодиниць В. Механізм дії холерного токсину складний. Субодиниці В зв'язуються з рецепторами на кишкової епітеліальної клітці тонкої кишки. Після отримання надходження в цитоплазму епітеліальної клітини субодиниця А активує внутрішньоклітинний білок G. Активований білок G, в свою чергу, призводить до активації ферменту аденілциклази, який починає виробляти збільшення концентрації циклічної АМФ (вторинної молекули месенджера). Підвищений цАМФ порушує нормальну фізіологію епітеліальних клітин кишечника і змушує їх виділяти надмірну кількість рідини і електролітів в просвіт кишкового тракту, в результаті чого виникає важка «рисово-водяний стілець» діарея, характерна для холери.
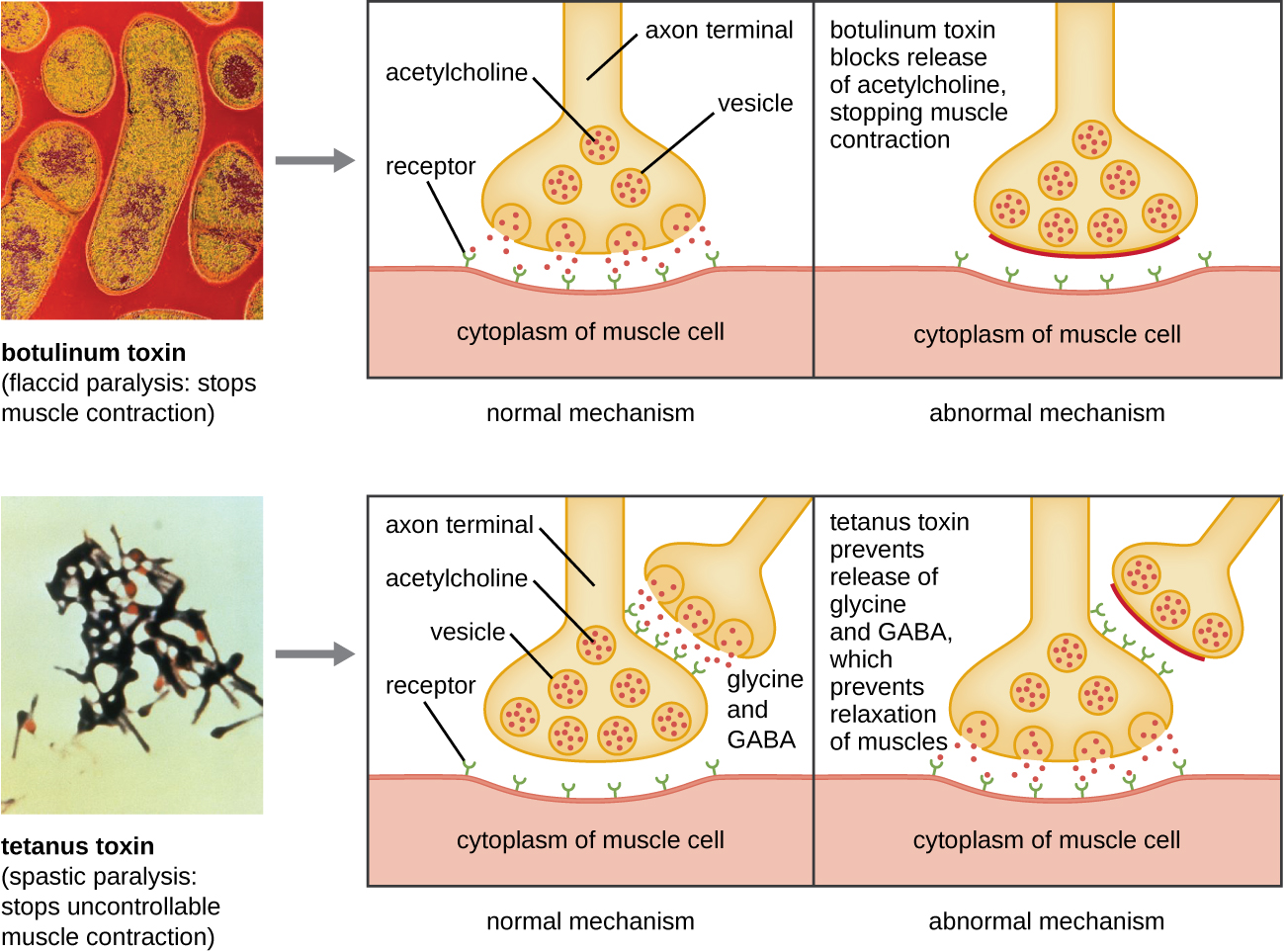
Ботулотоксин (також відомий як ботокс) - це нейротоксин, що виробляється грампозитивною бактерією Clostridium botulinum. Це найбільш гостро токсична речовина, відоме на сьогоднішній день. Токсин складається з легкої субодиниці А і важкого білкового ланцюга B субодиниці. Субодиниця B зв'язується з нейронами, щоб ботулотоксин потрапляв в нейрони на нервово-м'язовому з'єднанні. Субодиниця А діє як протеаза, розщеплюючи білки, що беруть участь у вивільненні нейроном ацетилхоліну, молекули нейромедіатора. Зазвичай нейрони виділяють ацетилхолін, щоб викликати скорочення м'язових волокон. Здатність токсину блокувати вивільнення ацетилхоліну призводить до гальмування м'язових скорочень, що призводить до розслаблення м'язів. Це може зупинити дихання і спричинити смерть. Через його дії низькі концентрації ботокса використовуються для косметичних і лікувальних процедур, включаючи видалення зморшок і лікування гіперактивного сечового міхура.
Ще один нейротоксин - правцевий токсин, який виробляється грампозитивною бактерією Clostridium tetani. Цей токсин також має легку субодиницю А та субодиницю важкого білкового ланцюга В. На відміну від ботулотоксину, правцевий токсин зв'язується з інгібуючими інтернейронами, які відповідають за вивільнення інгібіторних нейромедіаторів гліцину і гамма-аміномасляної кислоти (ГАМК). У нормі ці нейромедіатори зв'язуються з нейронами на нервово-м'язовому з'єднанні, що призводить до гальмування вивільнення ацетилхоліну. Правцевий токсин пригнічує вивільнення гліцину і ГАМК з інтернейрона, в результаті чого відбувається постійне скорочення м'язів. Першим симптомом, як правило, є скутість щелепи (фіксація щелепи). Насильницькі м'язові спазми в інших частині тіла слідують, як правило, кульмінацією яких є дихальна недостатність і смерть. \(\PageIndex{7}\)На малюнку показані дії як ботулінічних, так і правцевих токсинів.
Мембранні токсини впливають на функцію клітинної мембрани або утворюючи пори, або порушуючи фосфоліпідний бішар в мембранах клітин господаря. Два типи екзотоксинів, що руйнують мембрану, - це гемолізини та лейкоцидини, які утворюють пори в клітинних мембранах, викликаючи витік цитоплазматичного вмісту та лізис клітин. Спочатку вважалося, що ці токсини орієнтовані на еритроцити (еритроцити) та лейкоцити (лейкоцити) відповідно, але тепер ми знаємо, що вони можуть впливати і на інші клітини. Грампозитивна бактерія Streptococcus pyogenes виробляє стрептолізини, водорозчинні гемолізини, які зв'язуються з частинами холестерину в мембрані клітин господаря, утворюючи пори. Два типи стрептолізинів, O і S, класифікуються за здатністю викликати гемоліз в еритроцитах при відсутності або наявності кисню. Стрептолізин О не активний в присутності кисню, тоді як стрептолізин S активний в присутності кисню. Інші важливі пористоутворюючі мембрани руйнують токсини включають альфа-токсин золотистого стафілокока і пневмолізин Streptococcus pneumoniae.
Бактеріальні фосфоліпази - це токсини, що руйнують мембрану, які погіршують фосфоліпідний бішар клітинних мембран, а не утворюють пори. Ми вже обговорювали фосфоліпази, пов'язані з видами B. anthracis, L. pneumophila та Rickettsia, які дозволяють цим бактеріям впливати на лізис фагосом. Ці ж фосфоліпази - це і гемолізини. Інші фосфоліпази, які функціонують як гемолізини, включають альфа-токсин Clostridium perfringens, фосфоліпазу С P. aeruginosa та бета-токсин золотистого стафілокока.
Деякі штами S. aureus також виробляють лейкоцидин, який називається лейкоцидин Пантон-Валентин (PVL). ПВЛ складається з двох субодиниць, S і F. Компонент S діє як B-субодиниця екзотоксину А-В тим, що зв'язується з гліколіпідами на зовнішній плазматичній мембрані клітин тварин. F-компонент діє як субодиниця А екзотоксину А-В і несе ферментативну активність. Токсин вставляється і збирається в пори в мембрані. Гени, які кодують PVL, частіше присутні у штамах S. aureus, які викликають шкірні інфекції та пневмонію. 1 ПВЛ сприяє інфекціям шкіри, викликаючи набряк, еритему (почервоніння шкіри через розширення кровоносних судин) та некроз шкіри. Показано, що ПВЛ також викликає некротизуючу пневмонію. ПВЛ сприяє прозапальному і цитотоксичному впливу на альвеолярні лейкоцити. Це призводить до вивільнення ферментів з лейкоцитів, які, в свою чергу, викликають пошкодження легеневої тканини.
Третій клас екзотоксинів - суперантигени. Це екзотоксини, які викликають надмірну, неспецифічну стимуляцію імунних клітин до секреції цитокінів (хімічних месенджерів). Надмірне вироблення цитокінів, які часто називають цитокіновим штормом, викликає сильну імунну та запальну реакцію, яка може спричинити небезпечну для життя високу лихоманку, низький кров'яний тиск, поліорганну недостатність, шок та смерть. Прототипом суперантигену є токсин синдрому токсичного шоку S. aureus. Більшість випадків синдрому токсичного шоку пов'язані з колонізацією піхви шляхом вироблення токсину S. aureus у жінок, що менструюють; однак також може відбуватися колонізація інших ділянок тіла. Деякі штами Streptococcus pyogenes також виробляють суперантигени; їх називають стрептококовими мітогенними екзотоксинами та стрептококовими пірогенними токсинами.
Вправа\(\PageIndex{2}\)
- Опишіть, як екзоферменти сприяють бактеріальної інвазії.
- Поясніть різницю між екзотоксинами і ендотоксином.
- Назвіть три класи екзотоксинів.
Фактори вірулентності для виживання у господаря та імунного ухилення
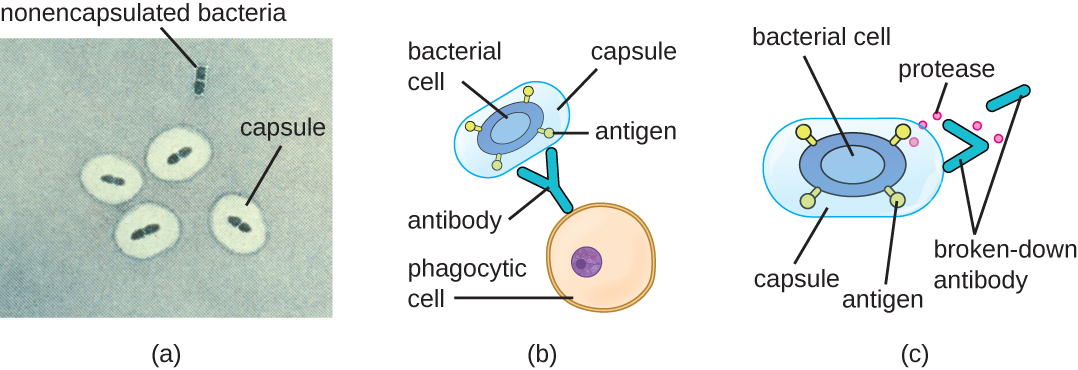
Ухилення від імунної системи також важливо для інвазивності. Бактерії використовують різні фактори вірулентності, щоб уникнути фагоцитозу клітинами імунної системи. Наприклад, багато бактерій виробляють капсули, які використовуються в адгезії, але також допомагають в імунному ухиленні, запобігаючи проковтування фагоцитами. Склад капсули запобігає імунним клітинам можливість прилипати, а потім фагоцитозувати клітину. Крім того, капсула робить бактеріальну клітину набагато більшою, що ускладнює проникнення імунних клітин збудника (рис.\(\PageIndex{8}\)). Помітною бактерією, що продукує капсули, є грампозитивний збудник Streptococcus pneumoniae, який викликає пневмококову пневмонію, менінгіт, септицемію та інші інфекції дихальних шляхів. Інкапсульовані штами S. pneumoniae більш вірулентні, ніж некапсульовані штами, і частіше вторгаються в кров і викликають септицемію та менінгіт.
Деякі збудники також можуть виробляти протеази, щоб захистити себе від фагоцитозу. Як описано в Adaptive Specific Host Defenses, імунна система людини виробляє антитіла, які зв'язуються з поверхневими молекулами, виявленими на конкретних бактеріях (наприклад, капсулах, бахромах, джгутиках, LPS). Це зв'язування ініціює фагоцитоз та інші механізми антибактеріального вбивства та кліренсу. Протеази борються з антитілами, опосередкованим вбивством та очищенням, атакуючи та перетравлюючи молекули антитіл (рис.\(\PageIndex{8}\)).
Крім капсул і протеаз, деякі бактеріальні збудники продукують інші фактори вірулентності, що дозволяють їм ухилятися від імунної системи. Фімбрії деяких видів Streptococcus містять білок М, який змінює поверхню стрептокока і пригнічує фагоцитоз, блокуючи зв'язування молекул комплементу, які допомагають фагоцитам потрапляти в організм бактеріальних патогенів. Кислотостійка бактерія Mycobacterium tuberculosis (збудник туберкульозу) виробляє воскову речовину, відому як міколева кислота у своїй клітинній оболонці. Коли він поглинається фагоцитами в легені, захисна оболонка міколевої кислоти дозволяє бактерії протистояти деяким механізмам вбивства всередині фаголізосоми.
Деякі бактерії виробляють фактори вірулентності, які сприяють зараженню, експлуатуючи молекули, природно вироблені господарем. Наприклад, більшість штамів золотистого стафілокока виробляють екзоферментну коагулазу, яка експлуатує природний механізм згортання крові для ухилення від імунної системи. У нормі згортання крові запускається у відповідь на пошкодження кровоносних судин; тромбоцити починають закупорювати згусток, і відбувається каскад реакцій, при яких фібриноген, розчинний білок, вироблений печінкою, розщеплюється на фібрин. Фібрин - це нерозчинний ниткоподібний білок, який зв'язується з тромбоцитами крові, перехресними зв'язками і стискається, утворюючи сітку згорнутих тромбоцитів і еритроцитів. Отриманий згусток перешкоджає подальшій втраті крові з пошкоджених кровоносних судин. Однак якщо бактерії виділяють коагулазу в кров, каскад фібриноген-фібрин спрацьовує за відсутності пошкодження кровоносних судин. Отриманий згусток покриває бактерії фібрином, захищаючи бактерії від впливу фагоцитарних імунних клітин, що циркулюють у крові.
У той час як коагулаза викликає згортання крові, кінази мають протилежний ефект, запускаючи перетворення плазміногену в плазмін, який бере участь у перетравленні згустків фібрину. Переварюючи згусток, кінази дозволяють патогенам, що потрапили в згусток, втекти та поширюватися, подібно до того, як колагеназа, гіалуронідаза та ДНКАза сприяють поширенню інфекції. Приклади кіназ включають стафілокінази і стрептокінази, що продукуються золотистим стафілококом і Streptococcus pyogenes відповідно. Інтригує те, що S. aureus може виробляти як коагулазу для сприяння згортанню, так і стафілокіназу для стимуляції перетравлення згустків. Дія коагулази забезпечує важливий захисний бар'єр з боку імунної системи, але коли запаси поживних речовин зменшуються або інші умови сигналізують про необхідність виходу збудника і поширення, вироблення стафілокінази може ініціювати цей процес.
Остаточний механізм, який патогени можуть використовувати для захисту від імунної системи, називається антигенною варіацією, яка є зміною поверхневих білків, щоб патоген більше не розпізнавався імунною системою господаря. Наприклад, бактерія Borrelia burgdorferi, збудник хвороби Лайма, містить поверхневий ліпопротеїн, відомий як VLSE. Через генетичну рекомбінацію під час реплікації та відновлення ДНК цей бактеріальний білок зазнає антигенних змін. Кожен раз, коли виникає лихоманка, білок vLSE в B. burgdorferi може відрізнятися настільки, що антитіла проти попередніх послідовностей vLSE не ефективні. Вважається, що ця варіація VLSE сприяє здатності B. burgdorferi викликати хронічне захворювання. Ще одним важливим бактеріальним збудником людини, який використовує антигенні варіації, щоб уникнути імунної системи, є Neisseria gonorrhoeae, який викликає гонорею, що передається статевим шляхом. Ця бактерія добре відома своєю здатністю піддаватися антигенним варіаціям IV типу, щоб уникнути імунного захисту.
Вправа\(\PageIndex{3}\)
- Назвіть хоча б два способи, якими капсула забезпечує захист від імунної системи.
- Крім капсул, назвіть два інших фактори вірулентності, які використовуються бактеріями для ухилення від імунної системи.
Клінічна спрямованість: Дозвіл
Грунтуючись на повідомлених Майклом симптомах жорсткої шиї та геміпарезу, лікар підозрює, що інфекція, можливо, поширилася на його нервову систему. Лікар вирішує замовити спинний кран, щоб шукати будь-які бактерії, які, можливо, вторглися в мозкові оболонки та спинномозкову рідину (спинномозкову рідину), яка, як правило, була б стерильною. Для виконання спинномозкового крана поперек Михайла промазують йодовим антисептиком, а потім накривають стерильною простирадлом. Голка асептично видаляється з герметичної пластикової упаковки виробника руками клініциста в рукавичках. Голка вставляється і невеликий обсяг рідини втягується в прикріплену пробірку для зразка. Трубка знімається, закупорюється і на неї наклеюється підготовлена етикетка з даними Майкла. Цей зразок STAT (необхідний терміновий або негайний аналіз) ділиться на три окремі стерильні пробірки, кожна з яких має 1 мл ліквору. Ці трубки негайно доставляються в лікарняну лабораторію, де їх аналізують у відділеннях клінічної хімії, гематології та мікробіології. Попередні результати всіх трьох відділів вказують на наявність цереброспінальної інфекції, при цьому відділ мікробіології повідомляє про наявність грампозитивного стрижня в лікворі Михайла.
Ці результати підтверджують те, що підозрював його лікар: нові симптоми Майкла є результатом менінгіту, гострого запалення оболонок, що захищають головний і спинний мозок. Оскільки менінгіт може бути небезпечним для життя і через те, що перша антибіотикотерапія не була ефективною для запобігання поширенню інфекції, Майклу призначають агресивний курс двох антибіотиків - ампіциліну та гентаміцину, які будуть доставлені внутрішньовенно. Михайло залишається в лікарні кілька днів для підтримуючої терапії та для спостереження. Через тиждень йому дозволяють повернутися додому для постільного режиму і прийому пероральних антибіотиків. Через 3 тижні такого лікування він робить повне одужання.
Вірулентність
Хоча вірусні збудники не схожі з бактеріальними збудниками за структурою, деякі властивості, що сприяють їх вірулентності, схожі. Віруси використовують адгезії для полегшення адгезії до клітин господаря, а деякі обволікаючі віруси покладаються на антигенні варіації, щоб уникнути імунного захисту господаря. Ці фактори вірулентності більш детально розглянуті в наступних розділах.
Вірусні адгезійні речовини
Одним з перших кроків при будь-якій вірусній інфекції є адгезія вірусу до специфічних рецепторів на поверхні клітин. Цей процес опосередкований адгезинами, які входять до складу вірусної капсидної або мембранної оболонки. Взаємодія вірусних адгезинів зі специфічними рецепторами клітин визначає тропізм (переважне націлювання) вірусів на конкретні клітини, тканини та органи в організмі. Спайковий білок гемаглютинін, виявлений на Influenzavirus, є прикладом вірусного адгезину; він дозволяє вірусу зв'язуватися з сіаловою кислотою на мембрані респіраторних і кишкових клітин господаря. Ще одним вірусним адгезином є глікопротеїн gp20, виявлений на ВІЛ. Щоб ВІЛ інфікував клітини імунної системи, він повинен взаємодіяти з двома рецепторами на поверхні клітин. Перша взаємодія передбачає зв'язування між gp120 та клітинним маркером CD4, який знаходиться на деяких основних клітині імунної системи. Однак перед тим, як вірусне потрапляння в клітину може статися друга взаємодія між gp120 і одним з двох хемокінних рецепторів (CCR5 і CXCR4). У таблиці\(\PageIndex{5}\) наведено адгезії для деяких поширених вірусних збудників та конкретні сайти, до яких ці адгезії дозволяють прикріплюватися вірусам.
| Збудник | Хвороба | Адгезін | Сайт вкладень |
|---|---|---|---|
| вірус грипу | Грип | Гемаглютинін | Сіалова кислота дихальних і кишкових клітин |
| Вірус простого герпесу I або II | Пероральний герпес, генітальний | Глікопротеїни gB, gC, Gd | Гепаран сульфат на слизових поверхнях рота і статевих органів |
| Вірус імунодефіциту людини | СНІДУ | Глікопротеїн gp120 | CD4 і CCR5 або CXCR4 клітин імунної системи |
Антигенні варіації вірусів
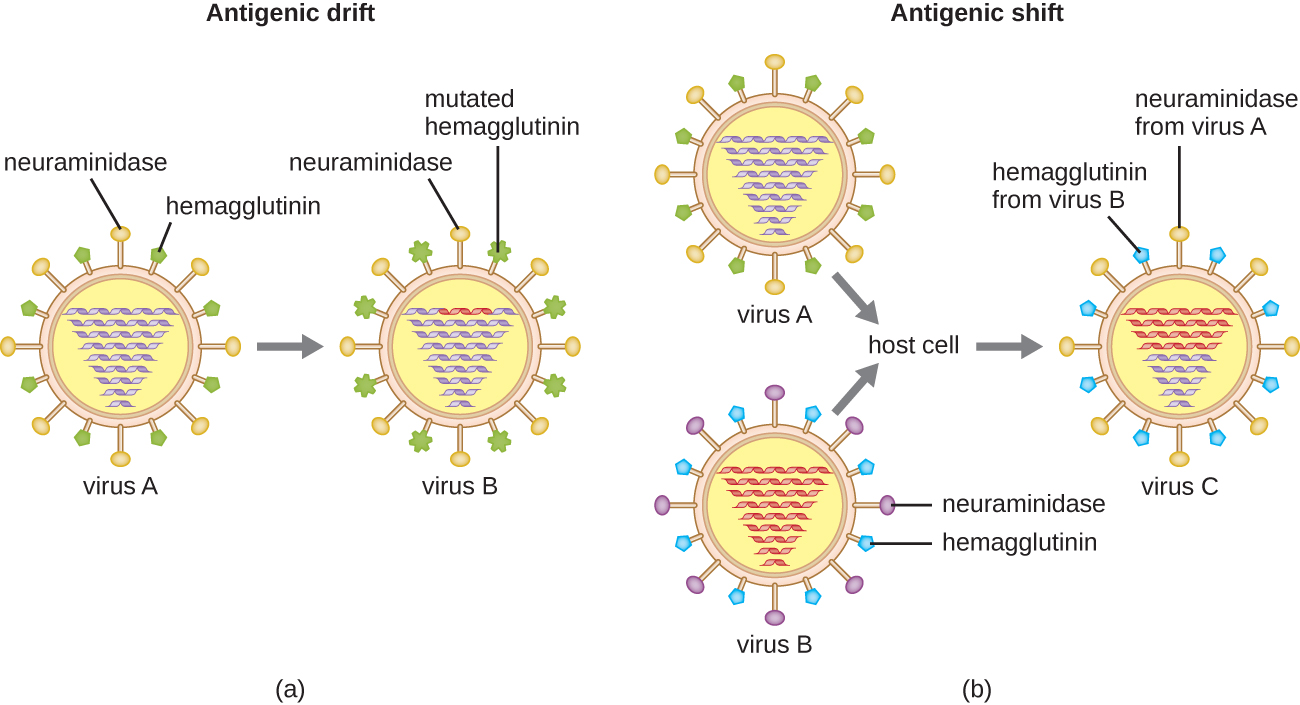
Антигенна варіація зустрічається також у певних типів обволікаючих вірусів, включаючи віруси грипу, які проявляють дві форми антигенної варіації: антигенний дрейф і антигенний зсув (рис.\(\PageIndex{9}\)). Антигенний дрейф є результатом точкових мутацій, що викликають незначні зміни в спайкових білках гемаглютиніну (Н) і нейрамінідази (N). З іншого боку, антигенний зсув є основною зміною білків спайка через пересортування генів. Ця переоцінка антигенного зсуву відбувається, як правило, коли два різних віруси грипу заражають одного і того ж господаря.
Швидкість антигенних варіацій вірусів грипу дуже висока, що ускладнює для імунної системи розпізнавання багатьох різних штамів грипу. Хоча організм може виробити імунітет до одного штаму шляхом природного впливу або вакцинації, антигенні зміни призводить до постійної появи нових штамів, які імунна система не розпізнає. Це основна причина того, що вакцини проти вірусу грипу необхідно давати щорічно. Щороку вакцина проти грипу забезпечує захист від найбільш поширених штамів цього року, але нові або різні штами можуть бути більш поширеними наступного року.
Ще одне пояснення того, як відбуваються антигенні зрушення і дрейф, дивіться це відео.
Вправа\(\PageIndex{4}\)
- Опишіть роль адгезинів у вірусному тропізмі.
- Поясніть різницю між антигенним дрейфом і антигенним зрушенням.
Ключові поняття та резюме
Фактори вірулентності сприяють здатності збудника викликати захворювання. Екзоферменти і токсини дозволяють хвороботворним мікроорганізмам вторгнутися в тканини господаря і викликати пошкодження тканин. Екзоферменти класифікуються відповідно до макромолекули, на яку вони орієнтовані, а екзотоксини класифікуються на основі їх механізму дії. До бактеріальних токсинів відносяться ендотоксин і екзотоксини. Ендотоксин - ліпідний компонент А ЛПС грамнегативної оболонки клітин. Екзотоксини - це білки, що виділяються в основному грампозитивними бактеріями, але також виділяються грамнегативними бактеріями. Бактеріальні патогени можуть ухилятися від імунної відповіді господаря, виробляючи капсули, щоб уникнути фагоцитозу, виживання внутрішньоклітинного середовища фагоцитів, деградуючих антитіл або через антигенні зміни. Вірусні збудники використовують адгезії для ініціювання інфекцій та антигенних варіацій, щоб уникнути імунного захисту. Віруси грипу використовують як антигенний дрейф, так і антигенний зсув, щоб уникнути розпізнавання імунною системою.
Виноски
- Мека В.В. «Пантон-Валентин Лейкоцидин». http://www.antimicrobe.org/h04c.file...L-S-aureus.asp
