15.2: Як хвороботворні мікроорганізми викликають захворювання
- Page ID
- 3922
Цілі навчання
- Узагальнити постулати Коха та молекулярні постулати Коха відповідно і пояснити їх значення та обмеження
- Поясніть поняття патогенності (вірулентності) з точки зору інфекційної та летальної дози
- Розрізняють первинні та умовно-патогенні мікроорганізми та виявляють конкретні приклади кожного
- Узагальнюємо етапи патогенезу
- Поясніть ролі порталів входу та виходу у передачі хвороби та виділіть конкретні приклади цих порталів
Для більшості інфекційних захворювань здатність точно ідентифікувати збудника є критичним кроком у пошуку або призначенні ефективних методів лікування. Сьогоднішні лікарі, пацієнти та дослідники зобов'язані значною заборгованістю перед лікарем Робертом Кохом (1843—1910), який розробив системний підхід для підтвердження причинних зв'язків між захворюваннями та конкретними збудниками.
Постулати Коха
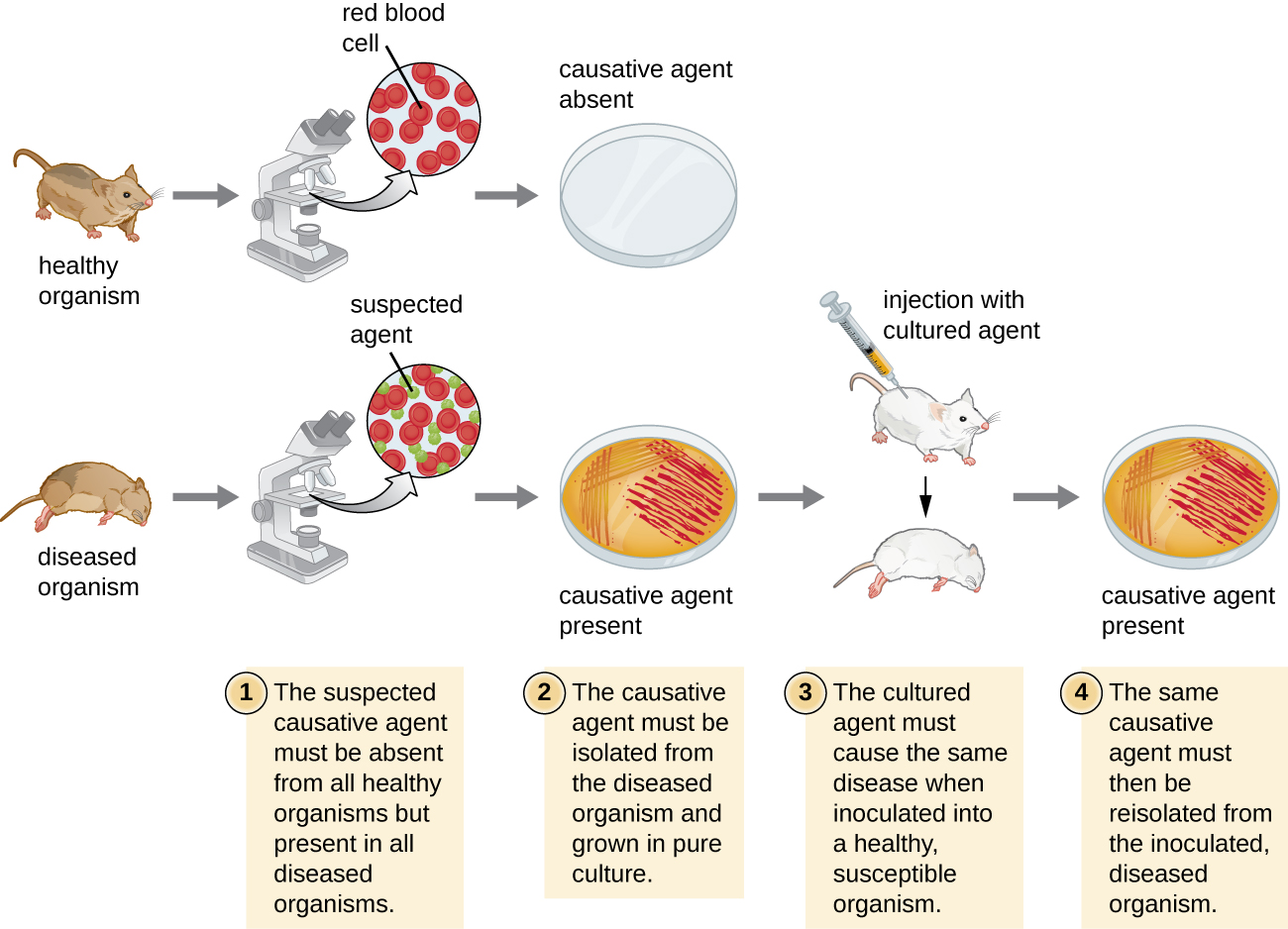
У 1884 році Кох опублікував чотири постулати, які узагальнили його метод визначення того чи іншого мікроорганізму причиною того чи іншого захворювання. Кожен з постулатів Коха являє собою критерій, який повинен бути дотриманий, перш ніж хвороба може бути позитивно пов'язана зі збудником. Для того щоб визначити, чи відповідають критерії, проводяться тести на лабораторних тварин і порівнюються культури здорових і хворих тварин (рис.\(\PageIndex{1}\)).
Постулати Коха
- Підозрюваний збудник повинен знаходитися в кожному випадку захворювання і не знаходитися у здорових осіб.
- Підозрюваний збудник можна виділити і вирощувати в чистій культурі.
- Здоровий випробуваний, інфікований підозрюваним збудником, повинен розвивати ті ж ознаки та симптоми захворювання, що і в постулаті.
- Збудник повинен бути повторно ізольований від нового господаря і повинен бути ідентичним збуднику з постулату 2.
Багато в чому постулати Коха все ще мають центральне місце в нашому нинішньому розумінні причин захворювання. Однак досягнення мікробіології виявили деякі важливі обмеження в критеріях Коха. Кох зробив кілька припущень, які, як ми зараз знаємо, не відповідають дійсності в багатьох випадках. Перший відноситься до постулату 1, який передбачає, що збудники виявляються тільки у хворих, не здорових, особин. Це невірно для багатьох хвороботворних мікроорганізмів. Наприклад, H. pylori, описаний раніше в цьому розділі як збудник, що викликає хронічний гастрит, також є частиною нормальної мікробіоти шлунка у багатьох здорових людей, у яких ніколи не розвивається гастрит. Підраховано, що понад 50% людської популяції набуває H. pylori на початку життя, причому більшість підтримують її як частину нормальної мікробіоти до кінця свого життя, не розвиваючи захворювання.
Друге помилкове припущення Коха полягало в тому, що всі здорові випробовувані однаково сприйнятливі до хвороб. Тепер ми знаємо, що люди не однаково сприйнятливі до хвороб. Особи унікальні з точки зору своєї мікробіоти та стану їх імунної системи в будь-який момент часу. Склад резидентної мікробіоти може впливати на сприйнятливість людини до інфекції. Члени нормальної мікробіоти відіграють важливу роль в імунітеті, пригнічуючи ріст транзиторних збудників. У деяких випадках мікробіота може перешкодити збуднику встановити інфекцію; в інших вона може не запобігти зараженню взагалі, але може впливати на тяжкість або тип ознак і симптомів. Як результат, дві особи з одним і тим же захворюванням не завжди можуть мати однакові ознаки та симптоми. Крім того, деякі особи мають більш сильну імунну систему, ніж інші. Особи з імунною системою, ослабленою віком або не пов'язаною хворобою, набагато більш сприйнятливі до певних інфекцій, ніж особи з сильною імунною системою.
Кох також припустив, що всі патогенні мікроорганізми - це мікроорганізми, які можна вирощувати в чистій культурі (постулат 2) і що тварини можуть служити надійними моделями для хвороб людини. Однак тепер ми знаємо, що не всі хвороботворні мікроорганізми можна вирощувати в чистій культурі, і багато хвороб людини не можуть бути надійно репліковані у господарів тварин. Віруси і деякі бактерії, включаючи рикетсію і хламідії, є облігатними внутрішньоклітинними збудниками, які можуть рости тільки при знаходженні всередині клітини-господаря. Якщо мікроба не можна культивувати, дослідник не може пройти повз постулат 2. Так само без відповідного нелюдського господаря дослідник не може оцінити постулат 2, не навмисно заражаючи людей, що представляє очевидні етичні проблеми. СНІД є прикладом такого захворювання, оскільки вірус імунодефіциту людини (ВІЛ) викликає захворювання лише у людини.
Вправа\(\PageIndex{1}\)
Коротко підсумуємо обмеження постулатів Коха.
Молекулярні постулати Коха
У 1988 році Стенлі Фалков (1934—) запропонував переглянуту форму постулатів Коха, відому як молекулярні постулати Коха. Вони наведені в лівій колонці таблиці\(\PageIndex{1}\). Передумова для молекулярних постулатів Коха полягає не в здатності ізолювати конкретного збудника, а скоріше ідентифікувати ген, який може спричинити патогенність організму.
Модифікації Фалкова до оригінальних постулатів Коха пояснюють не тільки інфекції, спричинені внутрішньоклітинними збудниками, але й існування патогенних штамів організмів, які зазвичай є непатогенними. Наприклад, переважна форма бактерії Escherichia coli входить до складу нормальної мікробіоти кишечника людини і взагалі вважається нешкідливою. Однак існують патогенні штами кишкової палички, такі як ентеротоксигенна кишкова паличка (ETEC) та ентерогеморагічна кишкова паличка (O157: H7) (EHEC). Тепер ми знаємо, що ETEC і EHEC існують через придбання нових генів колись нешкідливою кишковою паличкою, яка у вигляді цих патогенних штамів тепер здатна виробляти токсини і викликати хвороби. Патогенні форми стали наслідком незначних генетичних змін. У правій колонці таблиці\(\PageIndex{1}\) показано, як молекулярні постулати Коха можуть бути застосовані для ідентифікації EHEC як патогенної бактерії.
| Молекулярні постулати Коха | Заявка на EHEC |
|---|---|
| (1) Фенотип (ознака або симптом захворювання) повинен бути пов'язаний лише з патогенними штамами виду. | EHEC викликає запалення кишечника і діарею, тоді як непатогенні штами кишкової палички цього не роблять. |
| (2) Інактивація підозрюваного гена (ів), пов'язаного з патогенністю, повинна призвести до вимірюваної втрати патогенності. | Один з генів EHEC кодує для токсину Шига, бактеріального токсину (отрути), який пригнічує синтез білка. Інактивація цього гена знижує здатність бактерій викликати захворювання. |
| (3) Реверсія неактивного гена повинна відновити фенотип захворювання. | Додаючи ген, який кодує токсин назад в геном (наприклад, з фагом або плазмідою), здатність EHEC викликати захворювання відновлюється. |
Як і в оригінальних постулатах Коха, молекулярні постулати Коха мають обмеження. Наприклад, генетична маніпуляція деякими збудниками неможлива з використанням сучасних методів молекулярної генетики. У подібному ключі деякі захворювання не мають відповідних моделей тварин, що обмежує корисність як вихідного, так і молекулярного постулатів.
Вправа\(\PageIndex{2}\)
Поясніть відмінності між оригінальними постулатами Коха та молекулярними постулатами Коха.
Патогенність і вірулентність
Здатність мікробного агента викликати захворювання називається патогенністю, а ступінь, до якої організм патогенний, називається вірулентністю. Вірулентність - це континуум. На одному кінці спектра знаходяться організми, які є авірулентними (не шкідливими), а на іншому - організми, які відрізняються високою вірулентністю. Високо вірулентні патогени майже завжди призводять до стану захворювання при введенні в організм, а деякі можуть навіть спричинити збої поліорганної та системи організму у здорових людей. Менш вірулентні збудники можуть викликати початкову інфекцію, але не завжди можуть викликати важкі захворювання. Збудники з низькою вірулентністю, швидше за все, призведуть до легких ознак та симптомів захворювання, таких як субфебрильна лихоманка, головний біль або болі в м'язах. Деякі люди можуть бути навіть безсимптомними.
Прикладом високовірулентного мікроорганізму є Bacillus anthracis, збудник, відповідальний за сибірську виразку. B. anthracis може спричинити різні форми захворювання, залежно від шляху передачі (наприклад, шкірна ін'єкція, інгаляція, прийом всередину). Найсерйозніша форма сибірської виразки - інгаляція сибірської виразки. Після того як спори B. anthracis вдихаються, вони проростають. Розвивається активна інфекція, і бактерії виділяють потужні токсини, які викликають набряки (накопичення рідини в тканині), гіпоксію (стан, що перешкоджає потраплянню кисню в тканини) та некроз (загибель клітин і запалення). Ознаки та симптоми інгаляції сибірської виразки включають високу температуру, утруднене дихання, блювоту та кашель крові, а також сильні болі в грудях, що свідчать про серцевий напад. При інгаляції сибірської виразки токсини і бактерії потрапляють в кров, що може привести до поліорганної недостатності і смерті хворого. Якщо ген (або гени), що беруть участь в патогенезі, інактивується, бактерії стають менш вірулентними або непатогенними.
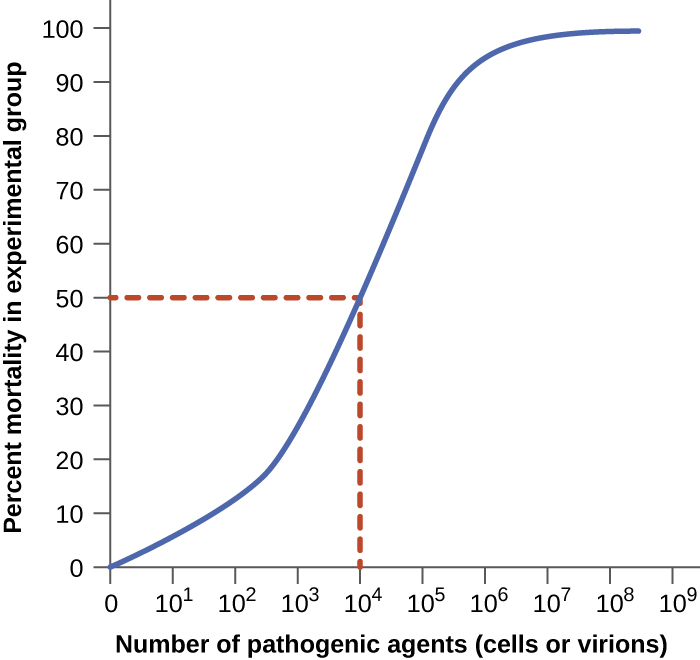
Вірулентність збудника може бути кількісно визначена за допомогою контрольованих експериментів з лабораторними тваринами. Двома важливими показниками вірулентності є медіана інфекційна доза (ID 50) та медіана летальна доза (LD 50), обидва з яких зазвичай визначаються експериментально за допомогою моделей тварин. ID 50 - це кількість клітин збудників або віріонів, необхідних для спричинення активної інфекції у 50% інокульованих тварин. LD 50 - це кількість патогенних клітин, віріонів або кількість токсину, необхідного для знищення 50% інфікованих тварин. Для обчислення цих значень кожна група тварин прищеплюється одним із діапазону відомих чисел клітин збудника або віріонів. На графіках, подібних до показаного на малюнку\(\PageIndex{2}\), відсоток тварин, які були заражені (для ID 50) або вбиті (для LD 50), наноситься на основі концентрації щепленого збудника. Рисунок\(\PageIndex{2}\) представляє дані, графічні з гіпотетичного експерименту, що вимірює LD 50 збудника. Інтерпретація даних з цього графіка вказує на те, що ЛД 50 збудника для досліджуваних тварин становить 10 4 клітини збудника або віріони (в залежності від досліджуваного збудника).
У таблиці\(\PageIndex{2}\) наведено вибрані патогени харчового походження та їх значення ID 50 у людини (як визначено за епідеміологічними даними та дослідженнями добровольців людини). Майте на увазі, що це серединні значення. Фактична інфекційна доза для людини може сильно варіюватися залежно від таких факторів, як шлях вступу; вік, здоров'я та імунний статус господаря; та екологічних та патогенних факторів, таких як сприйнятливість до кислого рН шлунка. Також важливо відзначити, що інфекційна доза збудника не обов'язково корелює з тяжкістю захворювання. Наприклад, лише одна клітина Salmonella enterica серотипу Typhimurium може призвести до активної інфекції. Виникаюче захворювання, сальмонельозний гастроентерит або сальмонельоз, може викликати нудоту, блювоту та діарею, але смертність становить менше 1% у здорових дорослих. На відміну від цього, S. enterica серотип Typhi має набагато вищий ідентифікатор 50, зазвичай вимагає до 1000 клітин для вироблення інфекції. Однак цей серотип викликає черевний тиф, набагато більш системне та важке захворювання, яке має смертність до 10% у нелікованих осіб.
| Збудник | ID 50 |
|---|---|
| Віруси | |
| Вірус гепатиту А | 10-100 |
| Норовірус | 1—10 |
| Ротавірус | 10-100 |
| Бактерії | |
| кишкова паличка, ентерогеморагічна (EHEC, серотип O157) | 10-100 |
| кишкова паличка, ентероінвазивна (ЕКЕ) | 200—5,000 |
| кишкова паличка, ентеропатогенна (EPEC) | 10 000 000—10 000 000 000 |
| кишкова паличка, ентеротоксигенна (ЕТЕК) | 10 000 000—10 000 000 000 |
| Сальмонела кишкова сероварна Тифі | <1,000> |
| S. кишкова сероварна тифімурій | ≥1 |
| дизентерії шигели | 10-200 |
| Холерний вібріон (серотипи O139, O1) | 1 000 000 |
| В. парагемолітичний | 100 000 000 |
| Найпростіші | |
| лямблії лямблії | 1 |
| Криптоспоридій парвум | 10-100 |
Вправа\(\PageIndex{3}\)
- У чому різниця між інфекційною дозою збудника і смертельною дозою?
- Що більш тісно пов'язане з тяжкістю захворювання?
Первинні патогени проти опортуністичних
Збудники можуть бути класифіковані як первинні збудники, так і умовно-патогенні. Первинний збудник може викликати захворювання у господаря незалежно від резидентної мікробіоти або імунної системи господаря. Опортуністичний збудник, навпаки, може викликати захворювання лише в ситуаціях, які порушують захисні сили господаря, таких як захисні бар'єри організму, імунна система або нормальна мікробіота. Особи, сприйнятливі до опортуністичних інфекцій, включають дуже молодих людей, людей похилого віку, жінок, які вагітні, пацієнти, які проходять хіміотерапію, люди з імунодефіцитом (наприклад, синдром набутого імунодефіциту [СНІД]), пацієнти, які одужують після операції, та ті, хто мав порушення захисні бар'єри (наприклад, сильна рана або опік).
Прикладом первинного збудника є ентерогеморагічна кишкова паличка (EHEC), яка виробляє фактор вірулентності, відомий як токсин Шига. Цей токсин пригнічує синтез білка, що призводить до важкої та кривавої діареї, запалення та ниркової недостатності навіть у пацієнтів зі здоровою імунною системою. Staphylococcus epidermidis, з іншого боку, є умовно-патогенним збудником, який є однією з найчастіших причин внутрішньолікарняного захворювання. 2 S. epidermidis є членом нормальної мікробіоти шкіри, де вона, як правило, авірулентна. Однак у лікарнях він також може рости в біоплівках, які утворюються на катетерах, імплантатах або інших пристроях, які вставляються в організм під час хірургічних процедур. Потрапивши всередину організму, S. epidermidis може спричинити серйозні інфекції, такі як ендокардит, і він виробляє фактори вірулентності, які сприяють персистенції таких інфекцій.
Інші члени нормальної мікробіоти також можуть викликати опортуністичні інфекції за певних умов. Це часто відбувається, коли мікроби, які нешкідливо проживають в одному місці тіла, потрапляють в іншу систему організму, де вони викликають захворювання. Наприклад, кишкова паличка, яка зазвичай міститься в товстій кишці, може викликати інфекцію сечовивідних шляхів, якщо вона потрапляє в сечовий міхур. Це провідна причина інфекцій сечовивідних шляхів серед жінок.
Члени нормальної мікробіоти також можуть викликати захворювання, коли зсув середовища організму призводить до заростання того чи іншого мікроорганізму. Наприклад, дріжджі Candida є частиною нормальної мікробіоти шкіри, рота, кишечника та піхви, але її популяція контролюється іншими організмами мікробіоти. Однак, якщо людина приймає антибактеріальні препарати, бактерії, які зазвичай пригнічують ріст Candida, можуть бути вбиті, що призведе до раптового зростання популяції Candida, на яку не впливають антибактеріальні препарати, оскільки це грибок. Заростання Candida може проявлятися у вигляді молочниці порожнини рота (зростання на рот, горло, і язик), вагінальна дріжджова інфекція, або шкірний кандидоз. Інші сценарії також можуть надати можливості для інфекцій Candida. Нелікований діабет може призвести до високої концентрації глюкози в слині, що забезпечує оптимальне середовище для росту Candida, що призводить до молочниці. Імунодефіцити, такі як ті, які спостерігаються у пацієнтів з ВІЛ, СНІДом та раком, також призводять до збільшення захворюваності молочницею. Вагінальні дріжджові інфекції можуть бути наслідком зниження рівня естрогену під час менструації або менопаузи. Кількість глікогену, доступного для лактобактерій у піхві, контролюється рівнями естрогену; коли рівень естрогену низький, лактобактерії виробляють менше молочної кислоти. Отримане в результаті підвищення рН піхви дозволяє заростання Кандиди в піхву.
Вправа\(\PageIndex{4}\)
- Поясніть різницю між первинним збудником і опортуністичним збудником.
- Опишіть деякі умови, при яких може статися опортуністична інфекція.
етапи патогенезу
Щоб викликати захворювання, збудник повинен успішно досягти чотирьох етапів або стадій патогенезу: вплив (контакт), адгезія (колонізація), інвазія та інфекція. Збудник повинен мати можливість отримати доступ до господаря, подорожувати до місця, де він може встановити інфекцію, ухилитися або подолати імунну відповідь господаря та завдати шкоди (тобто хвороби) господареві. У багатьох випадках цикл завершується, коли збудник виходить з господаря і передається новому господареві.
Експозиція
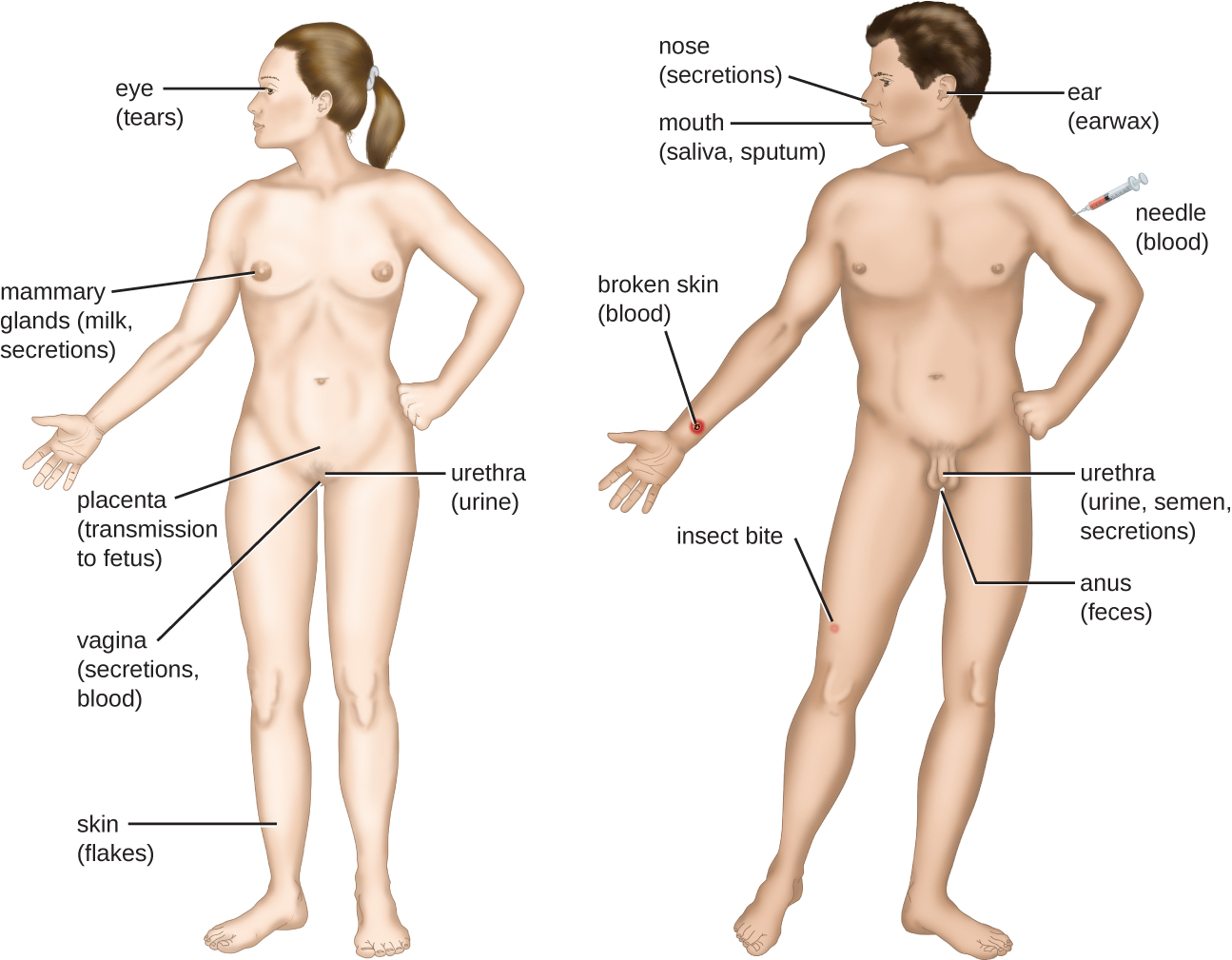
Зустріч з потенційним збудником відома як вплив або контакт. Їжа, яку ми їмо, та предмети, якими ми обробляємо, - це всі способи, якими ми можемо контактувати з потенційними патогенами. Тим не менш, не всі контакти призводять до зараження і хвороби. Щоб збудник викликав захворювання, він повинен мати можливість отримати доступ до тканини господаря. Анатомічний ділянку, через який хвороботворні мікроорганізми можуть пройти в тканину господаря, називається порталом входу. Це місця, де клітини господаря знаходяться в безпосередньому контакті із зовнішнім середовищем. Основні портали входу визначені на малюнку\(\PageIndex{3}\) і включають шкіру, слизові оболонки та парентеральні шляхи.
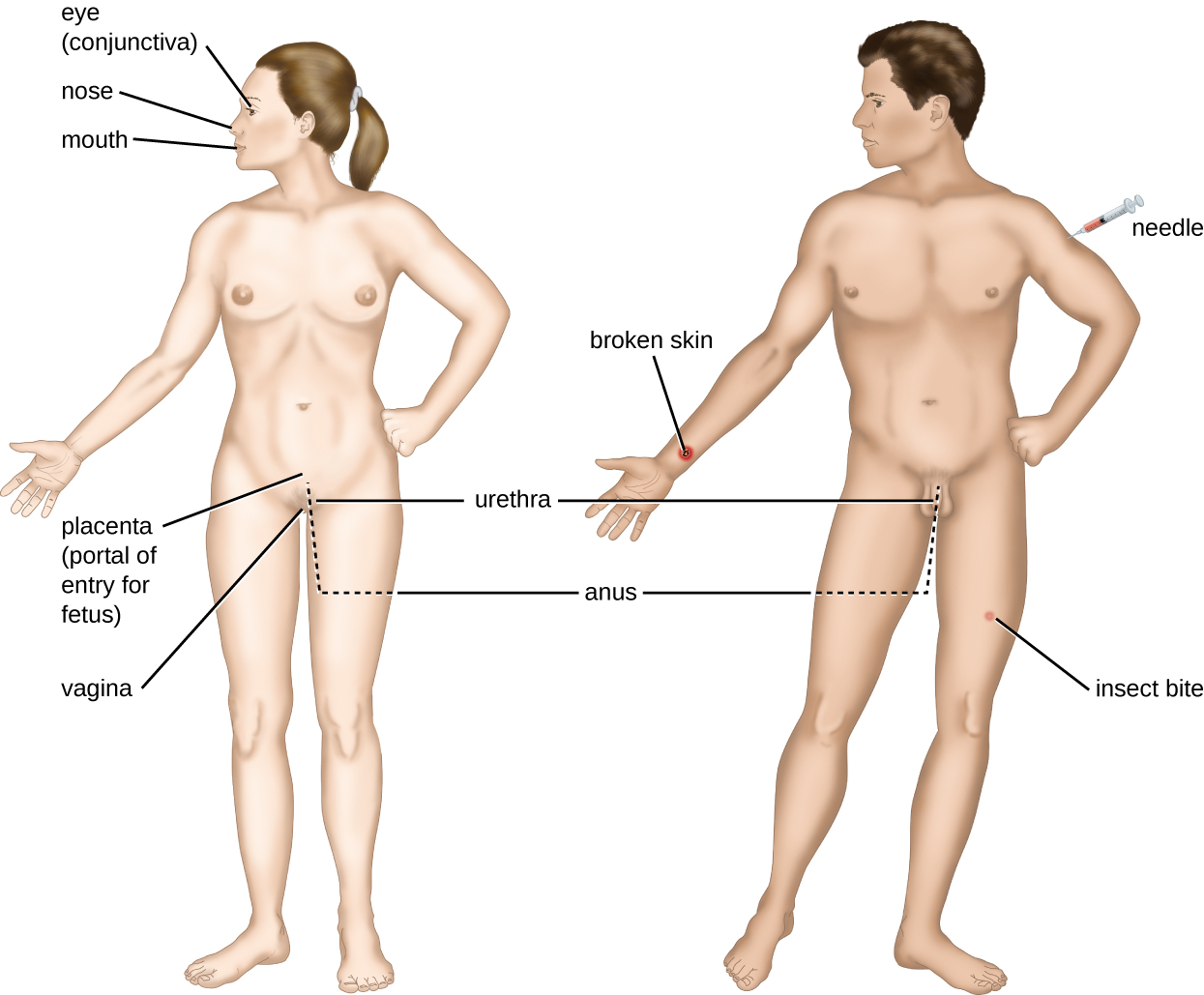
Слизові поверхні є найважливішими порталами проникнення мікробів; до них відносяться слизові оболонки дихальних шляхів, шлунково-кишкового тракту, сечостатевого тракту. Хоча більшість поверхонь слизової знаходяться у внутрішній частині тіла, деякі є суміжними із зовнішньою шкірою при різних отворах тіла, включаючи очі, ніс, рот, уретру та задній прохід.
Більшість хвороботворних мікроорганізмів підходять для конкретного порталу входу. Специфічність порталу збудника визначається екологічними адаптаціями організму та ферментами та токсинами, які вони виділяють. Дихальний та шлунково-кишковий тракти є особливо вразливими порталами входу, оскільки частинки, що включають мікроорганізми, постійно вдихаються або потрапляють в організм відповідно.
Збудники можуть потрапляти також через порушення захисних бар'єрів шкіри і слизових оболонок. Кажуть, що збудники, які потрапляють в організм таким чином, потрапляють парентеральним шляхом. Наприклад, шкіра є хорошим природним бар'єром для патогенів, але розриви шкіри (наприклад, рани, укуси комах, укуси тварин, уколи голки) можуть забезпечити парентеральний портал проникнення мікроорганізмів.
У вагітних жінок плацента в нормі перешкоджає переходу мікроорганізмів від матері до плоду. Однак деякі хвороботворні мікроорганізми здатні перетинати кров'яно-плацентарний бар'єр. Грампозитивна бактерія Listeria monocytogenes, яка викликає лістеріоз харчового захворювання, є одним із прикладів, який становить серйозний ризик для плода і іноді може призвести до мимовільного аборту. Інші збудники, які можуть пройти плацентарний бар'єр для інфікування плода, відомі колективно під абревіатурою TORCH (Таблиця\(\PageIndex{3}\)).
Передача інфекційних захворювань від матері до дитини також викликає занепокоєння в момент народження, коли дитина проходить по родових шляхах. Немовлята, матері яких мають активні інфекції хламідіозу або гонореї, можуть піддаватися впливу збудників у піхву, що може призвести до очних інфекцій, що призводять до сліпоти. Щоб запобігти цьому, стандартною практикою є введення антибіотичних крапель в очі немовлят незабаром після народження.
| Хвороба | Збудник | |
|---|---|---|
| Т | токсоплазмоз | Токсоплазма гондій (найпростіші) |
| О 3 |
сифіліс Вітрянка Гепатит В ВІЛ П'ята хвороба (інфекційна еритема) |
Трепонема паллідум (бактерія) Вірус вітряної віспи (вірус герпесу людини 3) Вірус гепатиту В (гепаднавірус) ретровірус Парвовірус В19 |
| R | Краснуха (німецький кір) | Тогавірус |
| C | цитомегаловірус | Вірус герпесу людини 5 |
| H | Герпес | Віруси простого герпесу (ВПГ) 1 і 2 |
Клінічна спрямованість: Частина 2
У клініці лікар знімає історію хвороби Майкла і запитує про його діяльність та дієту за останній тиждень. Дізнавшись, що Майкл захворів на наступний день після вечірки, лікар замовляє аналіз крові, щоб перевірити наявність патогенних мікроорганізмів, пов'язаних із захворюваннями харчового походження. Після того, як аналізи підтверджують наявність грампозитивного стрижня в крові Майкла, йому роблять ін'єкцію антибіотика широкого спектру дії і направляють в сусідню лікарню, де він госпіталізується як пацієнт. Там він повинен отримувати додаткову внутрішньовенну антибіотикотерапію і рідини.
Вправа\(\PageIndex{5}\)
- Чи є ця бактерія в крові Майкла частиною нормальної мікробіоти?
- Який портал входу використовували бактерії, щоб викликати цю інфекцію?
Адгезія
Після первинного опромінення збудник прилипає до порталу входу. Термін адгезія позначає здатність патогенних мікробів прикріплюватися до клітин організму за допомогою факторів адгезії, а різні патогени використовують різні механізми прилипання до клітин тканин господаря.
Молекули (або білки, або вуглеводи), звані адгезинами, знаходяться на поверхні певних патогенів і зв'язуються зі специфічними рецепторами (глікопротеїнами) на клітинах-господарях. Адгезії присутні на бахромах і джгутиках бактерій, віях найпростіших, капсидах або мембранах вірусів. Найпростіші також можуть використовувати гачки та колючки для адгезії; спайкові білки на вірусах також посилюють вірусну адгезію. Виробництво глікокаліцій (шари слизу та капсули) (рис.\(\PageIndex{4}\)), з їх високим вмістом цукру та білка, також може дозволити певним бактеріальним збудникам прикріпитися до клітин.
Зростання біоплівки також може виступати в ролі фактора адгезії. Біоплівка - це спільнота бактерій, які виробляють глікокалікс, відомий як екстраполімерна речовина (EPS), що дозволяє біоплівці прикріплюватися до поверхні. Стійкі інфекції синьогнійної палички поширені у пацієнтів, які страждають муковісцидозом, опіковими ранами та інфекціями середнього вуха (середній отит), оскільки P. aeruginosa виробляє біоплівку. EPS дозволяє бактеріям прилипати до клітин господаря і ускладнює фізичне видалення збудника. EPS не тільки дозволяє прикріплення, але забезпечує захист від імунної системи та лікування антибіотиками, запобігаючи потраплянню антибіотиків до бактеріальних клітин у біоплівці. Крім того, не всі бактерії в біоплівці швидко ростуть; деякі знаходяться в стаціонарній фазі. Оскільки антибіотики найбільш ефективні проти швидко зростаючих бактерій, порції бактерій в біоплівці захищені від антибіотиків. 4
Вторгнення
Як тільки адгезія буде успішною, інвазія може тривати. Інвазія передбачає поширення збудника по місцевих тканинам або організму. Патогени можуть виробляти екзоферменти або токсини, які служать факторами вірулентності, які дозволяють їм колонізувати та пошкоджувати тканини господаря, коли вони поширюються глибше в організм. Патогени можуть також виробляти фактори вірулентності, які захищають їх від захисних сил імунної системи. Специфічні фактори вірулентності збудника визначають ступінь ураження тканин, що відбувається. \(\PageIndex{5}\)На малюнку показано вторгнення H. pylori в тканини шлунка, викликаючи пошкодження в міру його прогресування.
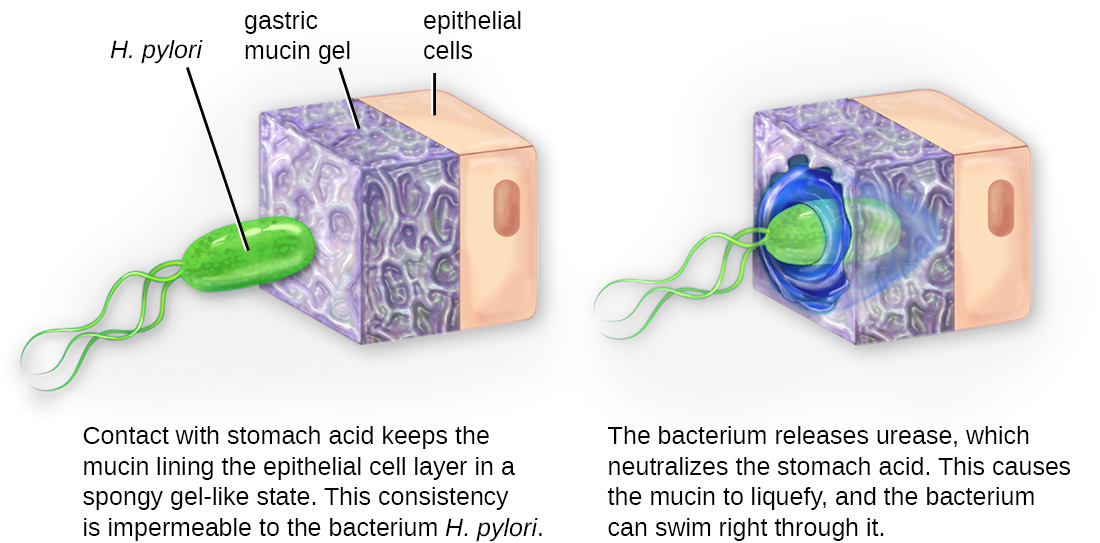
Внутрішньоклітинні збудники досягають інвазії, потрапляючи в клітини господаря і розмножуючись. Деякі з них є облігатними внутрішньоклітинними патогенами (тобто вони можуть розмножуватися лише всередині клітин господаря), а інші - факультативні внутрішньоклітинні патогени (тобто вони можуть розмножуватися як всередині, так і зовні клітин господаря). Потрапляючи в клітини господаря, внутрішньоклітинні патогени здатні ухилятися від деяких механізмів імунної системи, одночасно експлуатуючи поживні речовини в клітині-господаря.
Входження в клітину може відбуватися шляхом ендоцитозу. Для більшості видів клітин хазяїна патогени використовують один з двох різних механізмів ендоцитозу та введення. Один механізм спирається на ефекторні білки, що виділяються збудником; ці ефекторні білки запускають потрапляння в клітину-господаря. Це метод, який використовують сальмонела і шигелла при вторгненні епітеліальних клітин кишечника. Коли ці збудники контактують з епітеліальними клітинами в кишечнику, вони виділяють ефекторні молекули, які викликають випинання мембранних оборків, які приносять бактеріальну клітину. Цей процес називається мембранним рюшами. Другий механізм спирається на поверхневі білки, експресовані на збудника, які зв'язуються з рецепторами на клітині-господаря, в результаті чого відбувається надходження. Наприклад, псевдотуберкульоз Yersinia виробляє поверхневий білок, відомий як інвазин, який зв'язується з бета-1 інтегранами, вираженими на поверхні клітин господаря.
Деякі клітини-господаря, такі як білі кров'яні тільця та інші фагоцити імунної системи, активно ендоцитозують збудників у процесі, званому фагоцитозом. Хоча фагоцитоз дозволяє збуднику отримати потрапляння в клітину господаря, в більшості випадків клітина-господар вбиває і деградує збудника за допомогою травних ферментів. У нормі, коли збудник потрапляє в організм фагоцитом, він укладений у фагосому в цитоплазмі; фагосома зливається з лізосомою, утворюючи фаголізосому, де травні ферменти вбивають збудника (див. Розпізнавання патогенів та фагоцитоз). Однак деякі внутрішньоклітинні збудники мають здатність виживати і розмножуватися всередині фагоцитів. Приклади включають Listeria monocytogenes та Shigella; ці бактерії виробляють білки, які лізують фагосому, перш ніж вона зливається з лізосомою, дозволяючи бактеріям втекти в цитоплазму фагоцитів, де вони можуть розмножуватися. Такі бактерії, як Mycobacterium tuberculosis, Legionella pneumophila та Salmonella види використовують дещо інший механізм ухилення від перетравлення фагоцитом. Ці бактерії перешкоджають злиттю фагосоми з лізосомою, тим самим залишаючись живими і ділячись всередині фагосоми.
Інфекція
Після інвазії успішне розмноження збудника призводить до зараження. Інфекції можуть бути описані як місцеві, вогнищеві або системні, залежно від ступеня інфекції. Місцева інфекція обмежується невеликою ділянкою тіла, як правило, біля порталу входу. Наприклад, волосяний фолікул, заражений інфекцією Staphylococcus aureus, може призвести до фурункула навколо місця зараження, але бактерія значною мірою міститься в цьому невеликому місці. Інші приклади місцевих інфекцій, які включають більш широке ураження тканин, включають інфекції сечовивідних шляхів, обмежені сечовим міхуром, або пневмонію, обмежену легенями.
При осередковій інфекції локалізований збудник або токсини, які він виробляє, може поширитися на вторинне місце. Наприклад, стоматолог-гігієніст, прокушуючи ясна гострим інструментом, може привести до локальної інфекції в ясна бактеріями Streptococcus нормальної мікробіоти порожнини рота. Ці Streptococcus spp. можуть потім отримати доступ до кровотоку і пробитися в інші місця в організмі, що призводить до вторинної інфекції.
Коли інфекція стає дисемінованою по всьому організму, ми називаємо її системною інфекцією. Наприклад, зараження вірусом вітряної віспи зазвичай отримує потрапляння через слизову оболонку верхньої дихальної системи. Потім він поширюється по всьому тілу, в результаті чого з'являються класичні червоні ураження шкіри, пов'язані з вітрянкою. Оскільки ці ураження не є місцями первинного інфікування, вони є ознаками системної інфекції.
Іноді первинна інфекція, початкова інфекція, викликана одним збудником, може привести до вторинного зараження іншим збудником. Наприклад, імунна система пацієнта з первинною інфекцією ВІЛ стає порушеною, що робить пацієнта більш сприйнятливим до вторинних захворювань, таких як молочниця порожнини рота та інші, викликані умовно-патогенними мікроорганізмами. Аналогічно, первинна інфекція вірусом грипу пошкоджує та зменшує захисні механізми легенів, роблячи пацієнтів більш сприйнятливими до вторинної пневмонії бактеріальним збудником, таким як Haemophilus influenzae або Streptococcus pneumoniae. Деякі вторинні інфекції можуть навіть розвинутися в результаті лікування первинної інфекції. Антибіотикотерапія, спрямована на первинний збудник, може спричинити побічне пошкодження нормальної мікробіоти, створюючи отвір для умовно-патогенних мікроорганізмів (див. Справа в пункті: Вторинна дріжджова інфекція нижче).
Вторинна дріжджова інфекція
Аніта, 36-річна мати трьох років, звертається до центру невідкладної допомоги зі скаргами на тазовий тиск, часте і хворобливе сечовипускання, спазми в животі та випадкову сечу з відтінком крові. Підозрюючи інфекцію сечовивідних шляхів (ІМП), лікар запитує зразок сечі і відправляє його в лабораторію для аналізу сечі. Так як для отримання результатів культивування піде приблизно 24 години, лікар негайно запускає Аніту на антибіотик ципрофлоксацин. На наступний день мікробіологічна лабораторія підтверджує наявність кишкової палички в сечі Аніти, що узгоджується з передбачуваним діагнозом. Однак тест на чутливість до антимікробних препаратів вказує на те, що ципрофлоксацин не буде ефективно лікувати ІМП Аніти, тому лікар призначає інший антибіотик.
Після прийому антибіотиків протягом 1 тижня Аніта повертається в клініку зі скаргою на те, що рецепт не працює. Хоча хворобливе сечовипускання вщухло, зараз вона відчуває вагінальний свербіж, печіння та виділення. Після короткого обстеження лікар пояснює Аніті, що антибіотики, ймовірно, успішно вбили кишкову паличку, відповідальну за її ІМП; однак у процесі вони також знищили багато «хороших» бактерій у звичайній мікробіоті Аніти. Нові симптоми, про які повідомила Аніта, узгоджуються з вторинною дріжджовою інфекцією Candida albicans, умовно-патогенним грибком, який зазвичай мешкає у піхві, але гальмується бактеріями, які зазвичай проживають у тому ж середовищі.
Для підтвердження цього діагнозу з виділень готують слайд мікроскопа прямого вагінального мазка для перевірки на наявність дріжджів. Зразок розряду супроводжує цей слайд до мікробіологічної лабораторії, щоб визначити, чи відбулося збільшення популяції дріжджів, що викликають вагініт. Після того, як мікробіологічна лабораторія підтвердить діагноз, лікар призначає протигрибковий препарат Аніті для використання для усунення її вторинної дріжджової інфекції.
Вправа\(\PageIndex{6}\)
- Чому Кандида не була вбита антибіотиками, прописаними при ІМП?
- Перерахуйте три умови, які могли призвести до вторинної інфекції.
Передача хвороби
Щоб збудник персистувався, він повинен поставити себе в положення для передачі новому господареві, залишивши зараженого господаря через портал виходу (рис.\(\PageIndex{6}\)). Як і у випадку з порталами входу, багато хвороботворні мікроорганізми пристосовані для використання конкретного порталу виходу. Подібно до порталів входу, найпоширеніші портали виходу включають шкіру та дихальні, сечостатеві та шлунково-кишкові тракти. Кашель і чхання можуть вигнати хвороботворні мікроорганізми з дихальних шляхів. Одне чхання може відправити тисячі вірусних частинок в повітря. Виділення та виділення можуть транспортувати патогенні мікроорганізми з інших порталів виходу. Кал, сеча, сперма, вагінальні виділення, сльози, піт та пролиті клітини шкіри можуть служити транспортними засобами для того, щоб збудник покинув організм. Збудники, які покладаються на переносників комах для передачі, виходять з організму в крові, що видобувається кусаючим комахою. Аналогічно деякі хвороботворні мікроорганізми виходять з організму в крові, витягнутої голками.
Ключові поняття та резюме
- Постулати Коха використовуються для визначення того, чи є конкретний мікроорганізм збудником. Молекулярні постулати Коха використовуються для визначення того, які гени сприяють здатності збудника викликати захворювання.
- Вірулентність, ступінь, до якої збудник може викликати захворювання, можна кількісно визначити шляхом обчислення ID 50 або LD 50 збудника на даній популяції.
- Первинні збудники здатні викликати патологічні зміни, пов'язані із захворюванням у здорової людини, тоді як умовно-патогенні збудники можуть викликати захворювання лише тоді, коли індивід скомпрометований розривом захисних бар'єрів або імуносупресії.
- Інфекції та захворювання можуть бути викликані патогенами в навколишньому середовищі або мікробами в резидентній мікробіоті людини.
- Інфекції можна класифікувати як місцеві, вогнищеві або системні залежно від того, наскільки збудник поширюється в організмі.
- Вторинна інфекція іноді може виникнути після того, як захисні сили господаря або нормальна мікробіота порушені первинною інфекцією або лікуванням антибіотиками.
- Збудники потрапляють в організм через портали входу і йдуть через портали виходу. Етапи патогенезу включають опромінення, адгезію, інвазію, інфекцію та передачу.
Виноски
- 1 Управління з контролю за продуктами та ліками. «Книга поганих помилок, патогенні мікроорганізми харчового походження та природні токсини». 2-е видання. Срібна весна, доктор медичних наук: Управління з контролю за продуктами та ліками США; 2012.
- 2 М. Отто. «Staphylococcus epidermidis - «Випадковий» Збудник». Відгуки про природу Мікробіологія 7 № 8 (2009) :555—567.
- 3 O в TORCH розшифровується як «інше».
- 4 Девіс. «Розуміння стійкості біоплівки до антибактеріальних засобів». Природа огляди наркотиків Відкриття 2 (2003) :114—122.
