12.4: Генна інженерія - ризики, переваги та сприйняття
- Page ID
- 4061
Цілі навчання
- Узагальнити механізми, ризики та потенційні переваги генної терапії
- Визначте етичні проблеми, пов'язані з генною терапією та регулюючими органами, які забезпечують нагляд за клінічними випробуваннями
- Порівняйте соматично-клітинну та генну терапію зародкової лінії
Багато видів генної інженерії дали явні переваги з невеликою кількістю очевидних ризиків. Мало хто ставить під сумнів, наприклад, цінність нашого зараз рясного запасу людського інсуліну, виробленого генетично інженерними бактеріями. Однак багато нових застосувань генної інженерії є набагато більш суперечливими, часто тому, що їх потенційні переваги позбавлені значних ризиків, реальних або сприйнятих. Це, безумовно, стосується генної терапії, клінічного застосування генної інженерії, яка може одного разу забезпечити лікування від багатьох захворювань, але все ще в значній мірі є експериментальним підходом до лікування.
Механізми та ризики генної терапії
Захворювання людини, що виникають внаслідок генетичних мутацій, часто важко лікувати препаратами або іншими традиційними формами терапії, оскільки ознаки та симптоми захворювання виникають внаслідок відхилень у геномі пацієнта. Наприклад, у пацієнта може бути генетична мутація, яка перешкоджає експресії конкретного білка, необхідного для нормальної функції певного типу клітин. Це стосується пацієнтів із важким комбінованим імунодефіцитом (SCID), генетичним захворюванням, яке погіршує функцію певних лейкоцитів, необхідних для імунної системи.
Генна терапія намагається виправити генетичні відхилення шляхом введення немутованого функціонального гена в геном пацієнта. Немутований ген кодує функціональний білок, який пацієнт інакше не зміг би виробити. Для введення функціонального гена іноді використовуються вірусні вектори, такі як аденовірус; частина вірусного генома видаляється і замінюється потрібним геном (рис.\(\PageIndex{1}\)). Більш просунуті форми генної терапії намагаються виправити мутацію на вихідному місці в геному, як це відбувається при лікуванні SCID.
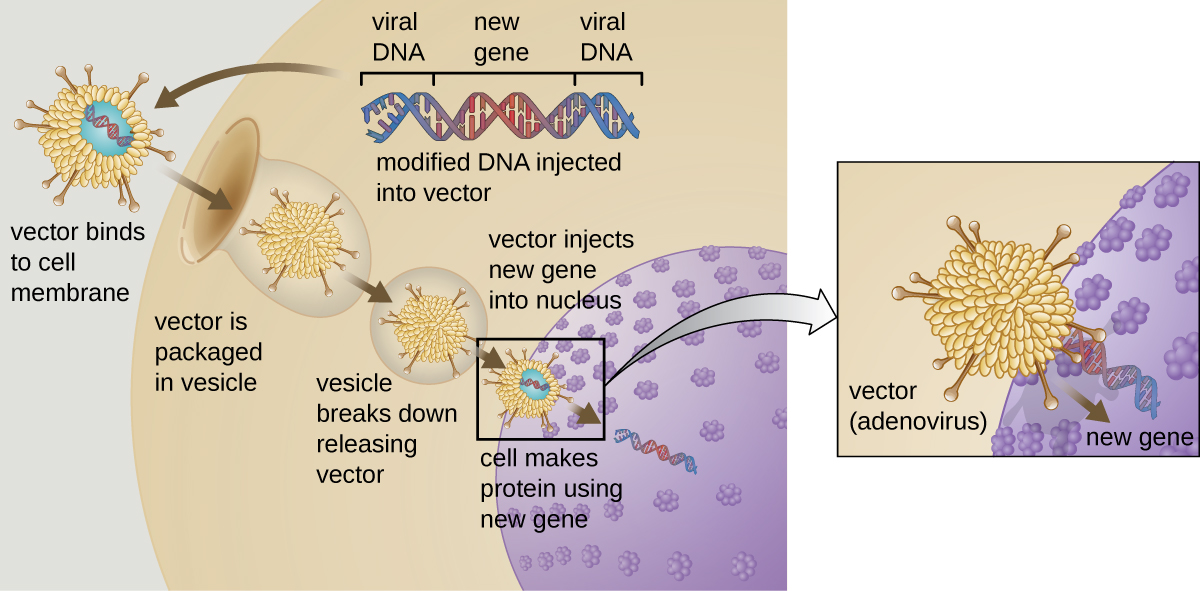
Поки генна терапія виявилася відносно неефективною, за можливими винятками лікування муковісцидозу та дефіциту аденозиндеамінази, типу SCID. Інші випробування показали явну небезпеку спроб генетичних маніпуляцій у складних багатоклітинних організмах, таких як люди. У деяких пацієнтів застосування аденовірусного вектора може спровокувати непередбачувану запальну відповідь з боку імунної системи, що може привести до органної недостатності. Більше того, оскільки віруси часто можуть націлюватися на кілька типів клітин, вектор вірусу може інфікувати клітини, не призначені для терапії, пошкоджуючи ці інші клітини і, можливо, призводячи до таких захворювань, як рак. Ще один потенційний ризик полягає в тому, що модифікований вірус може повернутися до заразності та спричинити захворювання у пацієнта. Нарешті, існує ризик того, що вставлений ген може ненавмисно інактивувати інший важливий ген в геному пацієнта, порушуючи нормальну циклічність клітин і, можливо, призведе до утворення пухлини та раку. Оскільки генна терапія пов'язана з такою кількістю ризиків, кандидати на генну терапію повинні бути повністю поінформовані про ці ризики, перш ніж надавати інформовану згоду на проходження терапії.
Ризики генної терапії були реалізовані в 1999 році випадку Джессі Гелсінджера, 18-річного пацієнта, який отримав генну терапію в рамках клінічного випробування в Університеті Пенсільванії. Джессі отримав генну терапію для стану, який називається дефіцитом орнітинтранскарбамілази (OTC), що призводить до накопичення аміаку в крові через дефіцит переробки аміаку. Через чотири дні після лікування Джессі помер після масової імунної відповіді на вектор аденовірусу. 1
До цього моменту дослідники насправді не вважали імунну відповідь на вектор законним ризиком, але під час дослідження, схоже, дослідники мали деякі докази, що свідчать про те, що це можливий результат. До лікування Джессі кілька інших пацієнтів страждали побічними ефектами лікування, а три мавпи, які використовувались у дослідженні, померли внаслідок запалення та порушення згортання крові. Незважаючи на цю інформацію, схоже, ні Джессі, ні його сім'я не знали про ці результати, коли вони погодилися на терапію. Смерть Джессі була першою смертю пацієнта через лікування генної терапії і призвела до негайного припинення клінічного випробування, в якому він брав участь, подальше припинення всіх інших випробувань генної терапії в Університеті Пенсільванії та розслідування всіх інших випробувань генної терапії в Сполучені Штати Америки. В результаті регуляція та нагляд за генною терапією в цілому були переглянуті, що призвело до нових регуляторних протоколів, які діють і сьогодні.
Вправа\(\PageIndex{1}\)
- Поясніть, як генна терапія працює в теорії.
- Визначте деякі ризики генної терапії.
Нагляд за генною терапією
В даний час існує значний нагляд за клінічними випробуваннями генної терапії. На федеральному рівні три агентства паралельно регулюють генну терапію: Управління з контролю за продуктами та ліками (FDA), Управління захисту досліджень людини (OHRP) та Консультативний комітет з рекомбінантної ДНК (RAC) при Національних інститутах охорони здоров'я (NIH). Поряд з декількома місцевими установами, ці федеральні установи взаємодіють з інституційною оглядовою радою, щоб забезпечити наявність протоколів для захисту безпеки пацієнтів під час клінічних випробувань. Дотримання цих протоколів здійснюється здебільшого на місцевому рівні у співпраці з федеральними відомствами. Генна терапія в даний час перебуває під найширшим федеральним та місцевим оглядом порівняно з іншими видами терапії, які, як правило, лише під оглядом FDA. Деякі дослідники вважають, що ці великі правила насправді гальмують прогрес у дослідженнях генної терапії. У 2013 році Інститут медицини (нині Національна академія медицини) закликав NIH розслабити огляд випробувань генної терапії в більшості випадків. 2 Однак забезпечення безпеки пацієнтів продовжує викликати першорядне занепокоєння.
Етичні проблеми
Крім ризиків для здоров'я генної терапії, здатність генетично модифікувати людей створює ряд етичних питань, пов'язаних з межами такої «терапії». Хоча поточні дослідження зосереджені на генній терапії генетичних захворювань, вчені можуть одного разу застосувати ці методи для маніпулювання іншими генетичними ознаками, які не сприймаються як бажані. Це викликає такі питання, як:
Вправа\(\PageIndex{2}\)
- Які генетичні риси гідні того, щоб їх «виправляли»?
- Чи слід використовувати генну терапію з косметичних причин або для підвищення людських здібностей?
- Чи слід використовувати генетичні маніпуляції для надання бажаних рис ненародженому?
- Чи кожен має право на генну терапію, чи вартість генної терапії може створити нові форми соціальної нерівності?
- Хто повинен нести відповідальність за регулювання та охорону неналежного використання генної терапії?
Здатність змінювати репродуктивні клітини за допомогою генної терапії також може породжувати нові етичні дилеми. На сьогоднішній день різні види генної терапії були спрямовані на соматичні клітини, нерепродуктивні клітини в організмі. Оскільки риси соматичних клітин не успадковуються, будь-які генетичні зміни, здійснені соматично-клітинною генною терапією, не передаватимуться потомству. Однак, якщо вчені успішно впроваджують нові гени в статеві клітини (яйцеклітини або сперматозоїди), отримані риси можуть бути передані потомству. Цей підхід, який називається генною терапією зародкової лінії, потенційно може бути використаний для боротьби з спадковими захворюваннями, але він також може призвести до ненавмисних наслідків для майбутніх поколінь. Більше того, існує питання інформованої згоди, оскільки ті, на кого впливає генна терапія зародкової лінії, є ненародженими і тому не можуть вибрати, чи отримують вони терапію. З цих причин уряд США в даний час не фінансує дослідницькі проекти, що досліджують генну терапію зародкової лінії у людей.
Ризиковані генні терапії
Хоча в даний час у Сполучених Штатах немає генної терапії, багато хто знаходиться в розробці, і цілком ймовірно, що деякі з них в кінцевому підсумку будуть схвалені. З останніми досягненнями генної терапії, орієнтованої на p53, ген, мутації соматичних клітин якого були залучені до понад 50% раку людини, 3 лікування раку за допомогою генної терапії може стати набагато більш поширеним, як тільки вони вийдуть на комерційний ринок.
Виведення будь-якої нової терапії на ринок ставить етичні питання, які несуть очікувані вигоди від ризиків. Як швидко нові методи лікування повинні бути виведені на ринок? Як ми можемо гарантувати, що нові методи лікування були достатньо перевірені на безпеку та ефективність, перш ніж вони будуть продані громадськості? Процес, за допомогою якого розробляються та затверджуються нові методи лікування, ускладнює такі питання, оскільки ті, хто бере участь у процесі затвердження, часто знаходяться під значним тиском, щоб отримати нову терапію, затверджену навіть перед обличчям значних ризиків.
Щоб отримати схвалення FDA на нову терапію, дослідники повинні зібрати значні лабораторні дані з випробувань на тварині та подати заявку на розслідування нового препарату (IND) до Центру оцінки та досліджень лікарських засобів FDA (CDER). Після 30-денного періоду очікування, протягом якого FDA розглядає IND, можуть початися клінічні випробування за участю людей. Якщо FDA сприймає проблему до або під час клінічного випробування, FDA може замовити «клінічне утримання», поки будь-які проблеми не будуть вирішені. Під час клінічних випробувань дослідники збирають та аналізують дані про ефективність та безпеку терапії, включаючи будь-які побічні ефекти, що спостерігаються. Після того, як терапія відповідає стандартам FDA щодо ефективності та безпеки, розробники можуть представити нову заяву на ліки (NDA), яка детально описує, як терапія буде виготовлена, упакована, контрольована та введена.
Оскільки нові генні терапії часто є результатом багаторічних (навіть десятиліть) лабораторних та клінічних досліджень, вони вимагають значних фінансових інвестицій. На той час, коли терапія досягла стадії клінічних випробувань, фінансові частки є високими для фармацевтичних компаній та їх акціонерів. Це створює потенційні конфлікти інтересів, які іноді можуть вплинути на об'єктивне судження дослідників, їх спонсорів і навіть учасників судового процесу. Випадок Джессі Гельсінгера (див. Справа в пункті: Генна терапія пішла не так) - класичний приклад. Зіткнувшись із небезпечним для життя захворюванням та відсутністю розумних методів лікування, легко зрозуміти, чому пацієнт може прагнути взяти участь у клінічному дослідженні незалежно від ризиків. Також легко побачити, як дослідник може розглядати короткострокові ризики для невеликої групи учасників дослідження як невелику ціну, щоб заплатити за потенційні переваги нового лікування, що змінює гру.
Смерть Гельсінгера призвела до посиленого вивчення генної терапії, а наступні негативні результати генної терапії призвели до тимчасового припинення клінічних випробувань до подальшого дослідження. Наприклад, коли діти у Франції, які лікувалися генною терапією SCID, почали розвиватися лейкемія через кілька років після лікування, FDA тимчасово припинила клінічні випробування аналогічних видів генної терапії, що відбуваються в США. 4 Подібні випадки підкреслюють необхідність дослідників та медичних працівників не тільки цінувати добробут людини та права пацієнтів над прибутковістю, але й підтримувати наукову об'єктивність при оцінці ризиків та переваг нових методів лікування.
Вправа\(\PageIndex{3}\)
- Чому дослідження генної терапії так жорстко регламентовані?
- Яке основне етичне занепокоєння пов'язане з генною терапією зародкової лінії?
Ключові поняття та резюме
- Хоча генна терапія показує великі перспективи для лікування генетичних захворювань, існують також значні ризики.
- Існує значне федеральне та місцеве регулювання розвитку генної терапії фармацевтичними компаніями для використання у людей.
- Перш ніж використання генної терапії може різко зрости, існує багато етичних питань, які повинні бути вирішені медичними та дослідницькими спільнотами, політиками та суспільством в цілому.
Виноски
- 1 Барбара Сіббальд. «Смерть, але один ненавмисний наслідок дослідження генної терапії». Журнал Канадської медичної асоціації 164 № 11 (2001): 1612—1612.
- 2 Керрі Грін. «Звіт: Ease Відгуки генної терапії». Вчений, 9 грудня 2013 р. http://www.the-scientist.com/?articl...erapy-Reviews/. Доступ до 27 травня 2016 р.
- 3 Чжень Ван і І Сунь. «Націлювання p53 для нової протипухлинної терапії». Трансляційна онкологія 3, №1 (2010): 1—12.
- 4 Перевірка Еріка. «Генна терапія: трагічна невдача». Природа 420 № 6912 (2002): 116—118.
