13.1: Старіння
- Page ID
- 5930
Що таке старіння?
Старіння - це прогресуюча втрата фізіологічних функцій, що збільшує ймовірність смерті. Ця таблиця дає деякі дані.
| вага мозку | 56% |
| Кровопостачання мозку | 80 |
| Вихід серця в спокої | 70 |
| Кількість клубочків у нирках | 56 |
| Швидкість клубочкової фільтрації | 69 |
| Швидкість повернення до нормального рН крові після зсуву | 17 |
| Кількість смакових рецепторів | 36 |
| Життєва ємність | 56 |
| Міцність рукоятки | 55 |
| Максимальне поглинання O 2 під час фізичних вправ | 40 |
| Кількість аксонів в спинномозковому нерві | 63 |
| Швидкість нервового імпульсу | 90 |
| Маса тіла | 88 |
Зниження функції, безумовно, відбувається всередині клітин. Особливо це стосується клітин, яких більше немає в клітинному циклі:
- нейрони в головному мозку;
- скелетний і серцевий м'яз;
- клітини нирок.
Тканина і органи складаються з клітин, які поповнюються мітозом протягом усього життя. Кров і кишковий епітелій виявляють набагато менше ознак старіння.
У природному світі дуже мало тварин живуть досить довго, щоб проявити ознаки старіння. Випадкова смертність від голоду, хижацтва, інфекційних захворювань та суворого середовища (наприклад, холоду) вбиває більшість тварин задовго до того, як вони починають проявляти ознаки старіння. Навіть для людини старіння стало звичайним явищем лише в останні десятиліття.
На початку 20 століття інфекційні захворювання, такі як пневмонія та грип, спричинили більше смертей у Сполучених Штатах, ніж «органічні» захворювання, такі як рак. Зараз ситуація зворотна. Наявність ефективної зброї проти інфекційних захворювань (наприклад, санітарія, антибіотики та імунізація) значно збільшила середній термін життя (але не максимальну тривалість життя) і призвела до того, що «органічні» захворювання, такі як серцево-судинні захворювання та рак, стають найпоширенішою причиною смерті.
У 1900 році новонароджена дитина в США могла розраховувати на середню тривалість життя всього 47 років. Інфекційні захворювання були основними причинами смерті, вбиваючи більшість людей, перш ніж вони досягли віку, коли старіння встановилося. Через три чверті століття тривалість життя зросла до 73 років, а «органічні» хвороби, включаючи всі хвороби старіння, замінили інфекційні захворювання як основну причину смерті. Сьогодні тривалість життя зросла до 80 для жінок (74 для чоловіків), і подолання старіння населення стало головним економічним та соціальним викликом у США.

Наведений вище графік показує чотири репрезентативні криві виживання. Вертикальна вісь представляє частку вижили в кожному віці (на горизонтальній осі).
- Крива А характерна для організмів, які до пізнього життя мають низьку смертність. Тоді смертність все частіше стає кінцевою точкою процесу старіння.
- Крива В характерна для популяцій, в яких такі фактори навколишнього середовища, як голодування і хвороби, затьмарюють наслідки старіння (а дитяча смертність у високій).
- Крива С - теоретична крива для організмів, для яких шанс смерті дорівнює в будь-якому віці. Це може бути так для організмів, які виявляють мало, якщо такі є, ознак старіння (деякі риби) або тих (наприклад, співочих птахів у дикій природі), які зазнають серйозної випадкової смертності від екологічних причин протягом усього життя.
- Крива D характерна для організмів, наприклад, устриць, які виробляють величезну кількість потомства, що супроводжується високими показниками дитячої смертності.
Організми з кривими виживання між C і D не мають можливості проявити ознаки старіння.
Старіння у безхребетних
Безхребетні тварини надали деякі важливі підказки про процес старіння.
- Колоніальні безхребетні, такі як губки та корали, не виявляють ознак старіння. Навіть окремі кнідарії, як морська анемона, яка жила 78 років, мало або зовсім не виявляють ознак старіння. У всіх цих випадках це, ймовірно, тому, що відбувається постійна заміна старих клітин новими з плином років.
- Лобстери також можуть дожити до глибокої старості без явних ознак зниження плодючості або будь-якого іншого фізіологічного процесу. Але омари ніколи не припиняють рости, тому в черговий раз це може бути безперервне утворення нових клітин, яке утримує тварину.
- У культуральних судах дрозофіла має обмежений термін життя і проявляє ознаки старіння, перш ніж вона помре. Виявлено, що два фактори впливають на процес старіння і, отже, тривалість життя:
- Обмеження калорій, тобто напівголодна дієта. Насправді, було показано, що обмеження споживання їжі збільшує тривалість життя (і повільне старіння) у всіх тварин - включаючи ссавців - які були перевірені.
- Виявлено поодинокі гени, які продовжують тривалість життя дрозофіли (а також у безхребетних Caenorhabditis elegans).
Старіння у хребетних
Деякі холоднокровні хребетні риби, амфібії, плазуни мають тривалий термін життя, якщо вони можуть вижити екологічні небезпеки (гігантські черепахи, як відомо, досягли 177 років). Ці тварини холоднокровні і ростуть настільки повільно, що, ймовірно, піддадуться екологічним небезпекам, перш ніж вони перестануть рости і почнуть проявляти ознаки старіння. Інша ситуація для птахів і ссавців. Вони теплокровні, швидко розростаються до дорослих розмірів і при захисті від екологічних небезпек виявлять ознаки старіння.
Чому ми старіємо?
Запрограмований в наших генах
плюси
- Були виявлені поодинокі гени, які збільшують тривалість життя у Drosophila, C. elegans та мишей. Гени, які пригнічують сигналізацію інсуліном і інсуліноподібний фактор росту-1 (Igf-1) збільшують тривалість життя у цих тварин. Приклади:
- Миші з одним із своїх генів рецепторів IGF-1 «вибили» живуть на 25% довше, ніж звичайні миші.
- Клото. Клітини в нирках і мозку виділяють позаклітинну частину трансмембранного білка поверхні клітини в кров. Цей «гормон», званий Клото, зв'язується з рецепторами на багатьох клітини-мішенях, зменшуючи їх здатність реагувати на інсулін і сигналізації IGF-1.
- Миші, гомозиготні для мутантного гена клото, виявляють багато ознак передчасного старіння при
- миші, що експресують надвисокі рівні білка Клото, живуть на 20— 30% довше, ніж зазвичай.
- Довгі терміни життя явно проходять в людських сім'ях.
- Старіння часто з'являється раніше у тварин, які страждають високим рівнем смертності від зовнішніх причин (наприклад, хижацтва) на початку життя.
Чому це повинно бути? Три (взаємопов'язані) можливості:
- Накопичення шкідливих мутацій (в зародку). Мало хто виживає досить довго, щоб їх було відібрано проти.
- Антагоністична плейотропія. Будуть підібрані гени, що сприяють виживанню на ранньому етапі життя за рахунок підтримки організму.
Деякі приклади:- п53. Змушуючи клітини з пошкодженою ДНК припинити ділення і стати старінням або навіть померти від апоптозу, він захищає організм від загрози того, що ці клітини стають раковими, але за рахунок зменшення оновлення клітин (наприклад, зменшуючи розмір пулів стовбурових клітин). Миші, які змушені виробляти більш високий, ніж нормальний рівень білка p53, демонструють багато ознак передчасного старіння, тоді як самки мишей, які мають дефіцит р53, зменшили плодючість (бластоцисти не імплантуються). Отже, ось компроміс гена, який сприяє еволюційному успіху в ранньому віці, але за рахунок прискореного старіння.
- Як у Drosophila, так і C. elegans деякі мутації, що збільшують тривалість життя, роблять це ціною зниження плодючості і навпаки.
- Одноразова сома. Рання смерть від зовнішніх причин вибере гени, які збільшують шанси на передачу зародкової плазми (тобто розмноження) за рахунок генів, які можуть затримати старіння.
- Немає ніякого способу, що природний відбір зможе підібрати для генів, єдиний сприятливий ефект яких проявляється після закінчення віку розмноження. Але
- будь-які гени, які продовжують репродуктивний період або
- будь-які гени, що сприяють фітнесу в молодості, а також довголіття
мінуси
Висока рання смертність від зовнішніх причин (наприклад, хижаків) була пов'язана з раннім старінням (у тих, хто вижив) у деяких тварин, але зворотне було виявлено у інших. Ці суперечливі результати не скасовують ролі генів у старінні, але вказують на те, що інші фактори навколишнього середовища (наприклад, більше їжі, що залишилося для тих, хто вижив) можуть перекосити результат.
Неминуче наслідок активного життя
плюси
- Багато холоднокровні хребетні (наприклад, багато риб і плазунів) не виявляють ознак старіння.
- Трансгенні миші, «термостат» яких у гіпоталамусі був скинутий, щоб дати нижчу температуру тіла (знижену на 0,3 - 0,5° C), живуть на 12% (самці) до 20% (самки) довше, ніж їхні нетрансгенні посліди. Це означає додавання приблизно 3 місяців до середньої тривалості життя 27 місяців для цих мишей. (Див. Конті, Б., та ін. Наука, 3 листопада 2006 р.).
- Ефекти обмеження калорій (CR). Тривалість життя дріжджів, C. elegans, Drosophila, птахів і ссавців (мишей, щурів і, ймовірно, мавп) може бути продовжена, а ознаки старіння затримуються, якщо вони підтримуються на напівголодній дієті. Обмеження калорій у мишей причини
- крапля в
- рівень циркулюючого інсуліну і інсуліноподібний фактор росту-1 (Igf-1);
- рівень глюкози і тригліцеридів в крові;
- рівень НАДГ (виробляється клітинним диханням) всередині клітин;
- збільшення вироблення сіртуїнів — деацетилаз, які виводять ацетильні групи з білків.
- апоптоз клітин, що підлягають гальмуванню;
- формування жирової тканини, що підлягає придушенню;
- збільшення виробництва оксиду азоту (NO), що має важливе значення для того, щоб переваги CR вступили в силу.
- сильно підвищена фізична активність і
- зниження маси тіла.
Тривалість життя та інші ефекти CR на щурів та мишей можуть бути не настільки значними, як здається. Всі дослідження були проведені на лабораторних щурах і мишах. Контрольних тварин зазвичай годують ad libitum, а це означає, що у них є їжа доступна весь час. Але це, швидше за все, не буде так в дикій природі, тому може бути, що фізіологія та тривалість життя цих тварин вже порушені і що наслідки CR в основному відновлюють нормальні умови для цих видів.
Проблема правильного контролю може також пояснити розбіжні результати в дослідженнях ЦР у резус-мавп.
- У випуску Science за 10 липня 2009 року дослідники Національного дослідницького центру приматів Вісконсіна повідомили про стан мавп-резусів, які перебували на CR протягом 20 років порівняно з контрольною групою, дозволеною годувати ad libitum на тій же дієті протягом цього часу. Результати: тварини CR виявили помітно менше ознак старіння (жоден не виявляв жодних ознак діабету), і нечисленні, хто загинув від вікових причин, зробили це лише на третину швидкості контролю.
- Однак 25-річне дослідження CR у резус-мавп, проведене в Національному інституті старіння (NIA) (і повідомлялося в Nature в серпні 2012 року), не показало збільшення довголіття у мавп CR.
Різниця, можливо, виникла через те, що контрольних мавп у Вісконсині годували ad libitum, тоді як контролі в NIA годували фіксованою кількістю. Крім того, дієта, яка використовується в дослідженні Вісконсіна, була набагато вищою в цукрі, ніж дієта в NIA, а дієти NIA також включали омега-3 жирні кислоти та інші здорові компоненти, відсутні в дієті Вісконсіна. Тож, можливо, позитивний ефект, помічений у дослідженні у Вісконсині, був результатом того, що тварини CR просто отримували менше нездорової дієти, ніж контрольні.
- крапля в
Ресвератрол
Ресвератрол - це невелика молекула, знайдена в червоному вині, яка, як видається, активує сиртуїни, що імітують наслідки обмеження калорій. Миші, які отримують щоденні дози ресвератролу, віддаючись дієті з високим вмістом жиру, товстіють, але уникають дегенеративних змін та скороченого терміну життя, які зазвичай супроводжують дієту з високим вмістом жиру. Але перш ніж поспішати купувати червоне вино, зрозумійте, що дози ресвератролу, що даються мишам, були набагато вищими, ніж можна було б забезпечити, випиваючи його. Дослідження впливу ресвератролу на продовження терміну життя дріжджів, дрозофіли та C. elegans дали змішані результати.
Ніхто точно не знає, чому обмеження калорій затримує старіння, але деякі механізми можуть бути тому, що це знижує рівень глюкози в крові і, таким чином, швидкість, з якою ліпіди і білки страждають від глікації. Розширений г лікації е і продукти (AGE) - це молекули, які мають знижену функцію через випадкове додавання до них цукрів. Для білків, таких як колаген і еластин, це призводить до збільшення жорсткості позаклітинного матриксу (ЕКМ) судин, суглобів, серця, нирок і т.д. зниження споживання калорій знижує плодючість жінок (принаймні у C. elegans, Drosophila, щурів і мишей). Енергія, яка була б присвячена виробництву потомства, може бути присвячена замість ремонту та обслуговування тканин. Обмеження калорій підвищує рівень сиртуїнів:
- Білок SIRT1 CR у мишей, які не мають SIRT1, не збільшують тривалість життя.
- відіграє ключову роль у відновленні пошкодження ДНК і тому допомагає захистити цілісність геному, який, здається, має важливе значення для довголіття.
- Він також пригнічує датчик поживних речовин TOR («мішень рапаміцину»), який прискорює старіння у мишей.
- SIRT1 також пригнічує активацію p53, захищаючи, таким чином, від пошкодження мітохондрій.
- Білок SIRT3 міститься в мітохондріях, де він пригнічує вироблення вільних радикалів.
Теорія вільних радикалів старіння
Основним аспектом обміну речовин є окислення харчових продуктів мітохондріями. Електронний транспорт в мітохондріях генерує активні форми кисню (» ROS «), такі як аніон супероксиду (O 2 −), який генерує пероксид водню (H 2 O 2). Хоча клітини містять ферменти для детоксикації цих реактивних речовин (наприклад, каталаза, яка розщеплює H 2 O 2), вони з часом і неминуче пошкоджують макромолекули в клітині: білки; ліпіди; і, мабуть, найважливіше з усіх, ДНК.
Пошкоджені білки і ліпіди накопичуються в клітині, особливо не діляться клітини, такі як нейрони і м'язи, виробляючи агрегати денатурованих білків і «старіння пігменту» під назвою ліпофусцин (основний компонент вушного воску). Накопичення білкових агрегатів в поперечно-смугастих м'язах знижує м'язову силу. Білкові агрегати повільніше накопичуються в клітині тварин на дієті з обмеженою калорійністю - можливо, внаслідок більш ефективної аутофагії. Однак це може бути пошкодження ДНК, що є вирішальним фактором зниження функції клітин з віком.
ДНК мітохондрій (мтДНК) може перебувати в групі особливого ризику. ROS виробляються як неминучий побічний продукт електронного транспорту в мітохондріях і, таким чином, генеруються близько до мтДНК. Але продукти цих генів необхідні для електронного транспорту. Тож, можливо, генерується позитивний контур зворотного зв'язку: ROS -> мутації в генах транспорту електронів, що знижують їх ефективність -> більше виробництва ROS.
Підтверджуючі докази:
- МтДНК накопичує мутації швидше, ніж ядерна ДНК, і вони показують хімічні характеристики пошкодження ROS.
- Трансгенні миші, що містять людський ген для каталази (але з цільовим сигналом, який зазвичай надсилає білок пероксисомам, заміненим для мітохондрій) живуть на 20% довше, ніж зазвичай для свого штаму. [Див. Шрінер, С.Е. та ін., Наука, 24 червня 2005 року.]
- Трансгенні миші, у яких ДНК-полімераза для копіювання генів мтДНК (ДНК-полімераза гамма) є дефектною, і вводить підвищену кількість мутацій в мтДНК, виявляють багато ознак передчасного старіння - як клітинного, так і в різних системах органів - і рано вмирають.
мінуси
- Ні миші, генетично сконструйовані для надмірного виробництва вільних радикалів, ні ті, що розроблені для виробництва меншої кількості вільних радикалів, не мають жодних змін у тривалості їх життя.
- Кажани і миші схожі за розмірами і швидкістю обміну речовин, але кажани можуть жити в десять разів довше.
- Хоча дріжджі, що голодують глюкозою, живуть довше, вони мають підвищену - не знижується - швидкість клітинного дихання.
- Швидкість метаболізму мишей на дієті CR не нижче, ніж у мишей на звичайному харчуванні.
- Сприятливий вплив ЦР приживається в будь-який час, принаймні у дрозофіл. Навіть після трьох тижнів на насиченому харчуванні (у другій половині нормальної тривалості життя дорослих мух) перехід на дієту CR знижує смертність в тій же мірі, що і мухи, які підтримуються на ЧР протягом усього свого дорослого життя. Вірно і зворотне - перехід з дієти CR на багату дієту швидко скасовує хорошу роботу перших. Ці результати свідчать про те, що якщо багата дієта спричиняє незворотні та накопичують шкоду, її шкідливий вплив на тривалість життя може бути притуплений у будь-який час.
Накопичення старіння клітин
Хронологічне старіння
Після формування деякі клітини миші або людини ніколи не замінюються. Нейрон, що утворився під час ембріонального розвитку, все ще може функціонувати в кінці життя. Однак протягом терміну його життя може накопичуватися пошкодження його органел і ДНК, що призводить до втрати функції. Це називається хронологічним старінням. В інших тканині, наприклад, крові та епітелії, нові клітини замінюють старі протягом усього життя. Але навіть незважаючи на нові, вони можуть мати знижену функцію через реплікативного старіння.
Реплікативне старіння
Можна очікувати, що клітини, видалені з миші або людини і поміщені в тканинну культуру, можуть культивуватися нескінченно довго, але це не так. Наприклад, коли фібробласти людини поміщаються в культуру, вони спочатку розмножуються, але врешті-решт настає час, коли швидкість мітозу сповільнюється і, нарешті, припиняється. Клітини продовжують жити деякий час, але не можуть перейти від G 1 до S-фази клітинного циклу. Це явище називається реплікативним старінням. Фібробласти, взяті з молодої людини, проходять через деякі 60-80 подвоєння, перш ніж вони досягають реплікативного старіння.
Чому це повинно бути? Клітини - якщо вони не зберігають фермент теломеразу - втрачають ДНК з кінчиків своїх хромосом (теломерів) при кожному поділі клітин. Взагалі, теломери в клітині старих тварин набагато коротше, ніж у молодняка. Недавнє дослідження короткочасних проти довгоживучих птахів показало, що укорочення теломерів було швидшим у короткоживучих видів. І один вид, буревісник, який живе в чотири рази довше, ніж інші птахи свого розміру, насправді має теломери, які зростали довше з віком. Більшість соматичних клітин організму перестають експресувати теломеразу. Однак клітини генетично маніпулювали для експресії теломерази довго після того, як вони повинні були припинитися, уникати реплікативного старіння. Зародкові клітини, наприклад, сперматогонія, і деякі стовбурові клітини продовжують експресувати фермент. Близько 95% ракових клітин експресують теломеразу. Якщо теломери стають занадто короткими (менше 13 повторень у клітині людини), виникають хромосомні аномалії - відмітна ознака раку. Раку можна уникнути, якщо клітина відчує це небезпечний стан і перестане ділитися. Таким чином, укорочення теломер може захистити від раку ціною старіння клітин.
Два білки, закодовані генами супресорів пухлини p53 та p16 Ink4a, відіграють ключову роль у зупинці клітинного циклу. Результат: реплікативне старіння. Тож реплікативне старіння може бути ціною, яку ми платимо за видалення клітин з клітинного циклу, перш ніж вони зможуть накопичити мутації, які перетворять їх на ракові клітини.
Роль білків-супресорів пухлини в реплікативному старінні відображається у інтактної тварини, принаймні у мишей.
- Миші, розроблені для вираження аномально високого рівня активності p53, демонструють багато ознак передчасного старіння, включаючи передчасне зменшення довжини їх теломерів.
- Миші
- які виражають аномально високі рівні p16 Ink4a, мають знижену здатність до регенерації тканин при
- миші, чия активність p16 Ink4a пригнічується, продовжують відновлювати пошкоджені тканини так само ефективно, як це роблять молоді тварини.
- У мишей усунення старіння клітин (вони мають високий вміст p16 Ink4a) запобігає (у молодих мишей) та частково повертає (у старших мишей) деякі ознаки старіння, такі як катаракта та втрата жирової тканини та скелетної м'язової маси.
- Миші генетично розроблені для вираження високого рівня
- теломерази і
- гени супресорів пухлини (наприклад, p53 і p16 Ink4a)
Роль дефіциту теломерази у старінні ссавців
Миші, гени теломерази яких були «вибиті» (або Tert −/− або Terc −/−), показують багато дегенеративних змін, пов'язаних зі старінням.
- Кількість мітохондрій в їх клітині зменшується, як і функція тих, що залишаються.
- Споживання кисню і виробництво АТФ знижується.
- Ефективність ланцюга транспорту електронів зменшується.
- Це призводить до підвищеної генерації активних форм кисню (РОС).
- Підвищується рівень активності р53.
- мітоз знижується
- апоптоз клітин збільшується
- реплікативне старіння збільшується
- Анатомія та функція таких органів, як печінка та серце, показують дегенеративні зміни віку.
У випуску Nature від 6 січня 2011 року Маріела Яскеліофф та її колеги (багато з тієї ж команди, яка знайшла результати, описані в попередньому розділі) повідомляють, що реактивація теломерази у старих мишей змінює багато ознак старіння.
Їх експериментальні тварини були ще одним штамом мишей з дефіцитом теломерази; тобто мишами, які не могли виробляти теломеразу навіть у тих клітині - «дорослих» стовбурових клітині та клітині зародкової лінії - які зазвичай зберігають активність теломерази. Миші були зроблені шляхом «збивання» гена, який запобігає будь-якій експресії теломерної зворотної транскриптази (TERT), якщо тварині не дається активуючий препарат. Без препарату ці миші живуть вдвічі менше, ніж зазвичай, і в міру дорослішання вони проявляють безліч ознак старіння:
- їх теломери стають коротшими, що призводить до хромосомних аберацій;
- їх клітини піддаються ранньому реплікативному старінню;
- майже всі їхні органи — яєчка, селезінка, кишечник, мозок — демонструють дегенеративні зміни, характерні для старіння.
АЛЕ, якщо давати активуючий препарат протягом чотирьохтижневого періоду в той час, коли дегенеративні зміни вже були очевидними (25-30 тижнів), їх погіршення припинилося і навіть частково змінилося.
- збільшилася довжина їх теломерів;
- реплікативне старіння затримувалося;
- їх тривалість життя була істотно збільшена;
- їх мозок, яєчка, печінка, селезінка та кишечник уникли дегенеративних змін, що спостерігаються у мишей з дефіцитом теломерази;
- вони видавали більш великі посліди, ніж необроблені миші;
- була знижена активація p53, що вказує
- зменшене пошкодження їх генома і
- зниження апоптозу в їх тканині
Як реплікативне старіння клітин призведе до погіршення структури та функції старіючих тканин (наприклад, шкіри), в яких вони проживають? У тканині, наприклад, шкірі та інших епітеліях, де мітоз повинен тривати протягом усього життя, щоб замінити втрачені клітини, накопичення старіння клітин - нездатних до подальшого мітозу - може призвести до характерних змін старіння в цій тканині.
- Одним з механізмів може бути просто нездатність старіючих клітин відновлювати тканину мітозом.
- Однак старіння клітини залишаються активними, хоча гени, які вони виражають, змінюються. Можливо, білки, які вони виділяють (наприклад, ферменти, що перетравлюють колаген) викликають зміни старіння в тканині, де вони мешкають.
- Можливо, саме старіння дорослих стовбурових клітин надає найбільший вплив на старіння тканин. У мишей з нокаутом, які не можуть виробляти білок Клото, стовбурові клітини та клітини-попередники в різних тканині піддаються старінню та зменшенню чисельності.
Неминучий компроміс?
Деякі дані досі свідчать про те, що зусилля, спрямовані на уникнення дегенеративних змін, які настають з віком (наприклад, шляхом збільшення оновлення клітин за допомогою підвищеної активності теломерази) в надії на збільшення довголіття можуть замість цього прискорити смерть від раку, намагаючись запобігти раку (наприклад, шляхом збільшення активності генів-супресорів пухлини) може прискорити старіння. Однак інші докази малюють менш похмуру картину. Миші гетерозиготні для гена супресора пухлини p53 (p53 +/−) розвивають багато видів раку під впливом іонізуючого випромінювання. Маючи лише одну копію цього супресора пухлини, одна клітина має великий ризик втратити залишилася копію («втрата гетерозиготності») і почати зростання злоякісного клону. Однак, якщо перед опроміненням мишам дають ресвератрол - щоб стимулювати вироблення антивікового білка SIRT1 - частота деяких видів раку знижується, і миші живуть довше, перш ніж піддатися своїм пухлинам.
Накопичення генетичних помилок
плюси
- Миші отримують іонізуюче випромінювання, яке пошкоджує ДНК, показують раннє старіння.
- Трансгенні миші з дефектом «коректурної» функції ДНК-полімерази, відповідальної за копіювання мітохондріальної ДНК
- накопичують багато мутацій в своїх мітохондріальних генах;
- виявляють виражені ознаки передчасного старіння.
- Клітини, взяті у старих мишей (і старих людей), показують трохи підвищений рівень соматичних мутацій та хромосомних аномалій, таких як транслокації та анеуплоїдія. Багато з цих змін також викликають рак, тому не випадково захворюваність на рак зростає з настанням віку (графік).
- Кровотворні стовбурові клітини «нокаутуючих» мишей з дефіцитом будь-якого з цих ферментів, необхідних для підтримки геному
- XPD для відновлення видалення нуклеотидів (NER)
- Ku80 для негомологічного торцевого з'єднання (NHEJ)
- TR (РНК теломерази), необхідний для обслуговування теломерів
- Більшість гемопоетичних стовбурових клітин у літніх мишей свідчать про дволанцюгові розриви (DSBs) у своєму хроматіні.
- У міру формування DSBs білки SIRT1 переміщаються зі своїх вихідних місць (у промоторів генів) до місць розташування DSBs (де вони набирають протеїни відновлення ДНК). Це зміщує схему експресії генів до однієї типової для старіючих клітин.
- Клітини, взяті у людей похилого віку (і людей з синдромами передчасного старіння), показують помітні скорочення транскрипції одних генів, збільшення в інших.
Підказки з транскриптом старіння мозку
Група дослідників Гарварду повідомила (у випуску Nature від 26 червня 2004 року) про результати свого дослідження експресії генів в мозку людини. Вони витягли РНК з аутопсірованої тканини мозку 30 людей, які померли у віці від 26 до 106 років. Вони аналізували РНК за допомогою чіпів ДНК, шукаючи рівень активності приблизно 11 000 різних генів (транскриптом). Виникла чітка закономірність.
Рівень активності близько 400 генів змінювався з плином часу.
- Експресія генів знизилася в старості для багатьох генів. Деякі приклади:
- гени, що кодують білки, що беруть участь у синаптичній активності в мозку (наприклад, навчання, пам'ять)
- NMDA, AMPA, ГАМК А рецептори
- кальцій-кальмодулінзалежна кіназа II (CamKII)
- гени, що беруть участь у мітохондріальних функціях, такі як
- виробництво АТФ (необхідний для відновлення ДНК)
- вироблення вражаючих активних форм кисню (ROS)
- гени, що кодують білки, що беруть участь у синаптичній активності в мозку (наприклад, навчання, пам'ять)
- Експресія генів збільшилася в старості для інших генів. Деякі приклади:
- гени, що беруть участь в запаленні та інших імунних захисних силах;
- гени, що кодують білки, що беруть участь в захисті від активних форм кисню (РОС)
- гени, що кодують білки, що беруть участь у відновленні
Перехід від юнацького транскриптом до транскриптом старшого мозку відбувався в різний час від 42 років до 73 років.
Дослідження окремих клітин серцевого м'яза у молодих та старих мишей (Bahar, R. et al., Nature, 22 червня 2006) показало, що транскриптом молодих клітин був досить рівномірним від клітини до клітини, але у віці клітин був дуже мінливим від однієї клітини до іншої. Змінна експресія генів від однієї клітини до іншої в одній тканині цілком може призвести до дефектів у функціонуванні цієї тканини.
Підказки від синдромів передчасного старіння
Люди страждають від ряду рідкісних генетичних захворювань, які, серед іншого, викликають ознаки передчасного старіння, наприклад, сиве волосся, зморшкувата шкіра та скорочений термін життя. У кількох випадках мутовані гени - це ті, які відіграють роль у підтримці цілісності генома, тобто у відновленні ДНК.
- Синдром Вернера. Волосся хворих сивіють в 20 років і більшість гинуть в кінці 40-х років з такими ознаками віку, як остеопороз, катаракта, атеросклероз. Навіть будучи молодими, їх клітини зазнають реплікативного старіння лише після ~ 20 подвоєнь замість нормальних 70 або більше. Викликаний мутаціями в WRN, який кодує спіраль, необхідну для відновлення ДНК та підтримки теломерів.
- Синдром Кокайна (КС). Викликані мутаціями в генах, необхідних для відновлення ДНК, особливо репарації ДНК, пов'язаної з транскрипцією. Хоча ці люди показують лише деякі ознаки старіння, вони мають різко скорочений термін життя.
- Атаксія телеангіектазія (АТ). У таких пацієнтів проявляються ознаки передчасного старіння. Їм не вистачає функціонуючого генного продукту (ATM), необхідного для виявлення пошкодження ДНК та ініціювання реакції на відновлення.
- Прогерійний синдром Хатчінсона-Гілфорда. Діти з цим рідкісним розладом виявляють багато ознак важкого старіння до свого другого дня народження і вмирають у ранньому підлітковому віці. Викликається мутаціями в гені (LMNA) для ламіну проміжного білка нитки, який стабілізує внутрішню мембрану ядерної оболонки. Машини для реплікації, транскрипції та відновлення ДНК розташовані на внутрішній поверхні ядерної оболонки, а клітини цих пацієнтів мають збільшене пошкодження ДНК та інші дефекти експресії генів.
Отже, ці синдроми припускають, що старіння може бути наслідком не стільки мутацій загалом, скільки мутацій у тих генах, продукти яких необхідні для безпомилкової реплікації, відновлення та транскрипції всіх генів.
Чому миша в 2 роки, як людина в 70 років
Якщо старіння є неминучим наслідком збою відновлення ДНК, чому воно відбувається набагато швидше у деяких ссавців (наприклад, мишей), ніж у інших (наприклад, у слонів та людей)?
Відповідь, ймовірно, полягає в ризику смерті від зовнішніх факторів (наприклад, хижацтва, голоду, холоду) у цього виду.
Як зазначалося вище, мало дрібних ссавців коли-небудь старіють, оскільки вони рано вмирають від зовнішніх причин. Ці тварини - r-стратеги, вкладають свою енергію в швидко
- досягнення статевої зрілості
- виробляючи велику кількість потомства, яке незабаром може жити самостійно
Для них немає вибіркової переваги інвестувати в механізми ефективного відновлення ДНК, оскільки вони помруть, перш ніж мутації стануть проблемою.
Люди, навпаки, є K-стратегами. Їм потрібно багато часу, щоб досягти статевої зрілості. Вони також виробляють невелику кількість молодняка, за якими потрібно доглядати протягом тривалого періоду. Тож не дивно, що еволюція у людей (та інших довгоживучих ссавців) вибрала гени, що сприяють ефективному відновленню ДНК.
З таблиці видно, що ефективність репарації ДНК безпосередньо корелює з тривалістю життя у різних ссавців.
| Кореляція між тривалістю життя та відносною ефективністю репарації ДНК у клітині деяких ссавців. У кожному випадку клітини, що ростуть в культурі тканин, опромінювалися ультрафіолетовим світлом, а потім визначалася ефективність, з якою вони відремонтували свою ДНК. (З творчості Р.В. Харта та Р.Б. Сетлоу, 1974 р.) | ||
|---|---|---|
| види | Середня тривалість життя, рік | Відносна ефективність репарації ДНК |
| Людський | 70 | 50 |
| Слон | 60 | 47 |
| Корова | 30 | 43 |
| Хом'як | 4 | 26 |
| Щур | 3 | 13 |
| Миша | 2 | 9 |
| норовлива | 1 | 8 |
Взаємозв'язки
Вивчення різних факторів, які були залучені до процесу старіння, свідчить про те, що більшість - можливо, всі - взаємопов'язані.
- Дисфункція мітохондрій з виробленням
- активні форми кисню (РОС) з їх шкідливою дією на
- ДНК та інші клітинні складові в поєднанні з
- початок реплікативного старіння, так що пошкоджені клітини більше не можуть бути замінені
всі можуть грати важливі ролі. Так що описані вище фактори аж ніяк не є взаємовиключними.
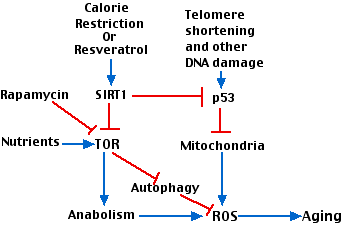
Наведена вище цифра намагається показати, як взаємодіють різні фактори, що беруть участь у старінні. Ключовими гравцями є
- Поступове вкорочення теломерів з повторними поділами клітин.
- п53.
- фермент позначив TOR («target o f r апаміцин»). ТОР - кіназа, яка бере участь у багатьох метаболічних шляхах в клітині. (Пригнічується антибіотиком рапаміцин, який використовується як імунодепресант).
Стимулюючі взаємодії показані синіми стрілками; інгібуючі взаємодії показані червоним кольором.
Взаємодії:
- Вкорочення теломер активізує р53, що призводить до пошкоджених мітохондрій.
- Неефективний ланцюг транспорту електронів в пошкоджених мітохондріях виробляє РОС.
- Рясні поживні речовини (наприклад, амінокислоти), а також інші стимулятори росту активують TOR, який сприяє анаболізму (синтезу білка та ліпідів) з супутнім виробленням активних форм кисню (ROS) та старінням.
- Обмеження калорій, робота через SIRT1 гальмує TOR і його ефекти нижче за течією.
- Інгібування ТОР знімає його гальмування аутофагії, дозволяючи клітинам поглинати, наприклад, пошкоджені мітохондрії.
- SIRT1 пригнічує активацію p53, захищаючи, таким чином, від пошкодження мітохондрій.
Через зв'язок між укороченням теломер та старінням дві компанії почали (у 2011 році) пропонувати теломери довжини. Як такі тести можуть бути корисними для людей, які просять їх, ще належить побачити.
Відмінні риси старіння
У випуску Cell від 6 червня 2013 року міжнародна група вчених розробила список з 9 ознак, що характеризують старіння у тварин. (Ця спроба навести порядок у такій складній темі нагадує більш ранні статті в тому ж журналі, The Hallmarks of Cancer.)
Вони очікували, що кожна ознака буде відповідати принаймні двом з трьох критеріїв.
- Вона повинна бути характерною для нормального старіння.
- Підвищена вираженість відмітної ознаки повинна призвести до більш швидкого старіння.
- Зусилля щодо зменшення вираженості відмітної ознаки повинні продовжити здоровий термін життя («healthspan»).
9 ознак.
1. Геномна нестабільність, що
відповідає критеріям:
- У віці клітини містять більше пошкоджень ДНК, ніж молоді.
- Агенти, що збільшують невідновлені пошкодження ДНК, включаючи хромосомні пошкодження (наприклад, анеуплоїдія), прискорюють старіння.
- Обмежені докази того, що методи лікування, які зменшують, наприклад, хромосомну міссегрегацію, продовжують тривалість здоров'я.
2. Теломерне виснаження, що
відповідає критеріям:
- Хромосоми вікових клітин мають коротші теломери, ніж у молодих клітин.
- Миші з дефіцитом теломерази показують передчасне старіння.
- Лікування, що реактивують теломеразу у звичайних мишей, затримують старіння.
3. Епігенетичні зміни, що
відповідають критеріям:
- Шаблони метилювання ДНК та модифікації гістонів змінюються у міру старіння ссавців.
- Миші, які мають дефіцит сиртуїну SIRT6, ферменту, який деацетилює гістони, старіють швидше, ніж зазвичай.
- Лікування, що підвищують активність сиртуїнів, збільшують тривалість здоров'я у мишей.
Коли ми, люди, старіємо, ДНК в наших клітині накопичує постійно зростаючу кількість епігенетичних змін, виміряних метилуванням КПГ. Це справедливо для найрізноманітніших типів клітин навіть тих, які утворилися недавно; тобто кількість епігенетичних змін відображає вік донора, а не вік клітини. Кореляція настільки хороша, що аналіз цих змін в клітині може передбачити вік донора іноді протягом декількох місяців.
4. Втрата протеостазу
протеостазу — це гомеостаз протеома — правильний баланс синтезу та деградації білків у клітині.
Відповідність критеріям:
- Кліренс денатурованих (розгорнутих) білків аутофагією і протеасомами, а також здатність перегортати їх шаперонами все з віком знижується. Результат: токсичні агрегати білка, які накопичуються в старих клітині.
- Миші-мутанти з дефектною активністю шаперону старіють швидше.
- Трансгенні дрозофіли та C. elegans, які надмірно виражають шаперони, збільшили тривалість життя.
5. Знерегульоване зондування поживних речовин
Відповідність критеріям:
- Датчик поживних речовин TOR («мішень рапаміцину»), який сприяє анаболізму, збільшується під час нормального старіння (і виробляє ожиріння, принаймні у мишей).
- Підвищена активність ТОР прискорює старіння у мишей.
- Приклади:
- Генетичне придушення сигналізації TOR продовжує тривалість життя у Drosophila та C. elegans.
- Обмеження калорій (CR), яке пригнічує TOR, збільшує тривалість здоров'я у всіх тварин, у яких воно було випробувано.
- Рапаміцин, який інгібує ТОР, продовжує тривалість життя у Drosophila, C. elegans та мишей.
6. Дисфункція мітохондрій, що
відповідає критеріям:
- Вироблення і ефективність мітохондрій знижується при старінні, інакше нормальних, мишей.
- Згубні мутації в ДНК мітохондрій та інші дефекти функції мітохондрій прискорюють старіння у мишей.
- Ще немає переконливих доказів того, що методи лікування для поліпшення функції мітохондрій збільшують тривалість життя.
7. Клітинне старіння Відповідність
критеріям:
- Реплікативне старіння (клітини вже не здатні увійти в клітинний цикл) настає набагато швидше в клітині старих тварин, ніж у молодих тварин.
- Миші, розроблені для вираження аномально високого рівня p53, білка, який блокує вхід в клітинний цикл, виявляють багато ознак передчасного старіння.
- У мишей усунення старіння клітин запобігає (у молодих мишей) і частково реверсує (у старших мишей) деякі ознаки старіння, такі як катаракта та втрата жирової тканини та скелетної м'язової маси.
8. Виснаження стовбурових клітин, що
відповідають критеріям:
- Проліферативна здатність стовбурових клітин дорослих знижується з віком в досліджуваних тканинях.
- Навмисне виснаження пулу стовбурових клітин в кишечнику дрозофіли призводить до передчасного старіння.
- Трансплантація стовбурових клітин молодих мишей у старих мишей покращує дегенеративні зміни старіння та продовжує їхнє життя.
9. Змінений міжклітинний зв'язок
Всі клітини реагують на хімічні сигнали в своєму середовищі. До них відносяться цитокіни, що виділяються сусідніми клітинами (паракринна стимуляція).
Відповідність критеріям:
- Запалення в різних тканині — опосередковане секрецією різноманітних цитокінів — збільшується у віці.
- Генноінженерні миші, які не в змозі знизити регулювання мРНК, що синтезують прозапальні цитокіни, показують прискорене старіння.
- Інгібування прозапального цитокіну NF-αB затримує старіння у мишей. Навіть таке просте протизапальний засіб, як аспірин, здається, продовжує життя мишам.
Відносини ознак
- Перші 4 ознаки, здається, представляють ініціюючі події, що призводять до старіння.
- Клейми 5, 6 та 7, здається, відображають пошкодження, спричинені, коли клітина намагається реагувати на шкоду, заподіяну першими 4 ознаками.
- Разом узяті ознаки 1 по 7 виробляють фенотип старіння, помічений у клеймах 8 і 9, які в кінцевому підсумку відповідають за зниження з віком функції клітин і організму, частиною якого вони є.
Еліксир молодості?
Незважаючи на багаторічні дослідження, було виявлено лише три втручання, які уповільнюють процес старіння та/або продовжують життя.
- Обмеження калорій (CR). Працює у всіх тварин перевірено.
- Рапаміцин. Продовжує тривалість життя мишей, дрозофіли та C. elegans, але, схоже, не змінює або навіть не зупиняє дегенеративні зміни старіння.
- Парабіоз. Коли кровоносна система молодої миші приєднується до системи старої миші (техніка називається парабіозом), різні тканини старої миші, наприклад, її скелетні м'язи, серцевий м'яз, печінка та центральна нервова система, омолоджуються. Перспективним кандидатом для опосередкування цього ефекту є білок під назвою GDF11 («Фактор диференціації росту 11"). (GDF11 також відомий як БМП-11). Ін'єкції рекомбінантного GDF11 майже так само ефективні, як і парабіоз. GDF11 ймовірно діє, стимулюючи активність стовбурових клітин. Однак поки немає доказів того, що це збільшує тривалість життя мишей.
Старіння в одноклітинних організмах
Раніше вважалося, що багато одноклітинних організмів, таких як дріжджі та бактерії, безсмертні; тобто вони
- ніколи не старіли, а просто продовжували ділитися, щоб створити нових особистостей;
- не мав різниці між зародковим (безсмертним) і сомою (смертним), які мають багатоклітинні організми.
Якщо true, кожен раз, коли клітинка ділиться, дві дочірні клітини будуть ідентичні за всіма параметрами батьківській (симетричний поділ).
Але принаймні для дріжджів і кишкової палички це не так.
Дріжджові клітини дійсно старіють і, як обговорювалося вище, виявилися корисними для вивчення процесу старіння. Помістивши одну дріжджову клітину на тверде середовище і видаляючи її дочку (бруньку) кожного разу, коли одна виробляється, виявляється, що кількість разів материнська клітина може утворити новий бутон шляхом мітозу обмежена. Після утворення бутона приблизно 20-30 разів материнська клітина виявляє ряд шкідливих клітинних змін (наприклад, дефектні мітохондрії) і гине.
Але, принаймні на початку її життя, бутони народжуються з потенціалом повноцінного терміну життя. Так мітотичний поділ повинен бути асиметричним з властивостями бутона, відмінними від властивостей його батька. Зараз продемонстровано кілька механізмів, за допомогою яких це відбувається.
- На шийці між материнською клітиною і її бутоном утворюється дифузійний бар'єр. Цей бар'єр перешкоджає проходженню від матері в зародок пошкоджених ядерних компонентів, наприклад, плазмоподібних фрагментів ДНК, що виробляються протягом життя матері. На відміну від ситуації у більшості еукаріотів, у дріжджів не відбувається розщеплення ядерної оболонки при мітозі. Під час анафази ядерна оболонка розростається і частина, що охоплює дочірні хромосоми, потрапляє в бутон. Однак бар'єр на шиї зберігає всі раніше існуючі ядерні порні комплекси (NPC) всередині материнської клітини, і вони зберігають фрагменти ДНК та, можливо, інші пошкоджені ядерні компоненти.
- Більшість будь-яких пошкоджених цитоплазматичних компонентів, таких як білки, денатуровані активними формами кисню (ROS), що призводять до утворення нефункціональних агрегатів, приєднуються до старих мітохондрій та ендоплазматичного ретикулуму, обидва з яких зберігаються в материнській клітині. Будь-які білкові агрегати, які потрапляють через, або розчиняються шаперонами в бруньці, або, якщо це не вдається, актинові нитки в бруньці переміщують агрегати назад у материнську клітину. Цей останній механізм вимагає наявності ряду білків, включаючи сиртуїн, знайдений в дріжджах під назвою Sir2 («Безшумний інформаційний регулятор 2»).
Стовбурові клітини - це клітини, які ділять асиметрично, утворюючи дочірню клітину, яка продовжує диференціюватися, і дочірню клітину, яка залишається стовбуровою клітиною. Було знайдено ряд прикладів - у дрозофіл та ссавців - де старіючі стовбурові клітини переважно відкладають свої пошкоджені клітинні компоненти, наприклад, агреговані білки, у дочки, які продовжуватимуть диференціюватися, зберігаючи неушкоджені компоненти у дочки, які залишаться стовбуром. осередок. Так само, як дріжджі, ці стовбурові клітини мають механізм, який переважно захищає «безсмертну» клітину від неминучих наслідків старіння.
Старіння кишкової палички

Подібне явище старіння було виявлено у кишкової палички. Коли кишкова паличка ділиться, в середині ділильної клітини утворюється перегородка, а потім дві дочірні клітини розщеплюються. Коли клітинна стінка ущільнює розрив, дві дочірні клітини закінчуються одним «старим» кінцем і одним новоутвореним кінцем. Коли дві дочки продовжують ділитися, процес повторюється. Оригінальні старі кінці передаються з покоління в покоління (скоріше, як безсмертні нитки ДНК).
На діаграмі показано, як під час поділу клітин утворюються два нових полюса, по одному в кожній з клітин потомства (нові полюси показані зеленим кольором для першого покоління; пурпурний для другого). Інші кінці цих клітин утворилися під час попереднього поділу.
Було показано (Stewart EJ, Madden R, Paul G, Taddei F (2005) Старіння та смерть в організмі, який відтворюється морфологічно симетричним поділом. PLoS Biol 3 (2): e45 doi: 10.1371/journal.pbio.0030045), що клітини, які успадковують все більш старий полюс, демонструють зменшену швидкість росту, зниження виробництва потомства та збільшення частоти смерті.
Отже, виявляється, що явище - характерне для всіх багатоклітинних організмів - старіючої і смертної соми, що виробляє зародкову плазму (сперму та яйцеклітини), яка починає нове молоде покоління, може мати свого аналога в одноклітинних організмах. Мабуть, жодна клітина не зможе уникнути руйнувань часу на цілісність її органел і молекул.
Старіння в рослині
Однорічні та дворічні
Однорічні рослини, такі як багато трав і «бур'янів»
- інтенсивно ростуть протягом певного періоду;
- потім формують квіти, а потім плоди.
- Плодоношення супроводжується уповільненням росту, що супроводжується фізіологічними і морфологічними змінами, такими як
- збільшення частоти дихання (катаболізм)
- втрата хлорофілу
- Ці зміни становлять старіння і закінчуються загибеллю рослини. Дворічні роки слідують тій же схемі, але на це потрібно два роки.
Ця закономірність в чітко запрограмована в генах. Навіть при рясній вологості, мінералах грунту, сонячному світлі та теплих температурах рослини старіють і гинуть.
Багаторічники
Зовсім інша справа йде в багаторічниках. Протягом усього життя деревні багаторічники (дерева) щороку виробляють нові судинні тканини, листя та квіти. Вони не виявляють помітних ознак старіння, хоча темпи їх зростання з роками можуть знижуватися. Нарешті, хвороба або нездатність підтримувати свої постійно зростаючі розміри проти вітру або снігового навантаження призводять до їх загибелі.

Ця картина (люб'язно люб'язно Walter Gierasch) - це щетинисті сосни (Pinus longaeva), що ростуть у Білих горах східної Каліфорнії. Аналіз деревних кілець показує, що деяким з цих дерев майже 5000 років. Але врахуйте, що ніякі живі клітини в дереві не більше кількох років.
Незважаючи на це, як такі довгожителі рослини уникали накопичення - протягом багатьох років реплікації ДНК у міру поділу їх клітин - шкідливих мутацій, які зменшили б придатність та тривалість життя? Можливо, це тому, що клітини в рослинних меристемах, де починається весь ріст, - це стовбурові клітини, які діляться повільно і, як і всі стовбурові клітини, асиметрично; тобто виробляють одну дочку, яка залишиться стовбуровою клітиною, і ту, яка почне фазу швидкого мітозу і з часом диференціюються в зрілі тканини рослини. Якщо (і це поки лише спекуляція) поділ меристематичної стовбурової клітини є асиметричним щодо сегрегації ниток ДНК; тобто стовбурова клітина зберігає безсмертні нитки ДНК, тоді як клітина, призначена для виробництва більшої кількості тканин, отримує щойно репліковані нитки, це забезпечить додатковий механізм захисту геному з плином років.
