6.2: Кінетика ферментів
- Page ID
- 7419
Ферменти є білковими каталізаторами, вони впливають на кінетику, але не на термодинаміку реакції
- Збільшення швидкості хімічної реакції
- Чи не змінюйте рівновагу
.png)
Малюнок 6.2.1: Активність каталізатора
- Вони збільшують швидкість за рахунок стабілізації перехідного стану (тобто зниження енергетичного бар'єру для формування перехідного стану) (вони не впливають на енергетику ні реагенту (реагентів), ні продукту (продуктів).
Похідне Міхаеліса-Ментена для простої стійкої кінетики
Рівняння Міхаеліса-Ментена - математична модель, яка використовується для аналізу простих кінетичних даних. Модель має певні припущення, і поки ці припущення є правильними, вона точно змоделює ваші експериментальні дані. Виведення моделі дозволить виділити ці припущення.
У реакції, що каталізується ферментом, субстрат спочатку утворює оборотний комплекс з ферментом (тобто фермент і субстрат повинні взаємодіяти, щоб фермент міг виконувати свою каталітичну функцію). Стандартний вираз, щоб показати це, є наступним:
ПРИПУЩЕННЯ #1:
- На початку кінетичного аналізу продукту немає
- Тому, поки ми відстежуємо початкові швидкості реакції, ми можемо ігнорувати зворотну реакцію E+P, що йде до ES
ПРИПУЩЕННЯ #2:
- Під час реакції встановлено рівноважну умову зв'язування та дисоціації ферменту та субстрату (припущення Бріггса-Халдана)
- Таким чином, швидкість утворення комплексу ЕС дорівнює швидкості дисоціації плюс розпад.
ПРИПУЩЕННЯ #3:
- [E] << [S]
- Фермент є каталізатором, він не руйнується і може бути перероблений, таким чином, потрібні лише невеликі кількості
- Сума S, прив'язана до E в будь-який момент, невелика в порівнянні з кількістю вільних S
- Звідси випливає, що [ES] << [S] і тому [S] є постійним під час аналізу (ПРИМІТКА: це припущення вимагає, щоб реакція контролювалася протягом короткого періоду, щоб споживалося не багато S і [S] не змінювалося ефективно - див. Наступне припущення)
ПРИПУЩЕННЯ #4:
- Вимірюється тільки початкова швидкість реакції.
- [P] = 0 (зворотну реакцію E + P можна ігнорувати)
- [S]» [S] початковий
ПРИПУЩЕННЯ #5:
- Фермент присутній або у вигляді вільного ферменту, або як комплекс ES
- [E] всього = [Е] + [ES]
Похідне Міхаеліса-Ментена з використанням вищевказаних припущень:
Швидкість утворення ЕС = k 1 [E] [S] + k -2 [E] [P]
Припущення #1 говорить, що ми можемо ігнорувати реакцію k -2, тому:
Швидкість утворення ЕС = k 1 [E] [S]
Припущення #5 говорить [E] = [E] загальний - [ES], отже:
Швидкість утворення ЕС = k 1 ([E] загальна - [ES]) [S]
Швидкість розбиття ЕС являє собою поєднання дисоціації і перетворення в продукт:
Швидкість пробою ЕС = k -1 [ES] + k 2 [ES]
Швидкість пробою ЕС = (k -1 + k 2) [ES]
Припущення #2 говорить, що швидкість утворення ЕС дорівнює швидкості пробою:
k 1 ([E] всього - [ES]) [S] = (k -1 + k 2) [ES]
Перевпорядкувати для визначення з точки зору констант швидкості:
([Е] всього - [ES]) [S]/[ES] = (k -1 + k 2) /k 1
([Е] всього [S]/[ES]) - [S] = (k -1 + k 2) /k 1
Визначити нову константу, K m = (k -1 + k 2)/k 1
([Е] всього [S]/[ES]) - [S] = K м
Вирішіть термін [ES] (з причин, які будуть наведені на наступному кроці):
[ES] = [E] загальна [S]/(K м + [S])
Фактична швидкість реакції, виміряна в будь-який момент, задається:
V = k 2 [ES]
Кратний обидві сторони вищевказаного рівняння на k 2:
k 2 [ES] = k 2 [E] загальна [S]/(K m + [S])
таким чином
V = k 2 [E] загальна [S]/(K м + [S])
Максимально можлива швидкість (Vmax) виникає, коли всі молекули ферменту пов'язані з субстратом [ES] = [E] загальна, таким чином:
V макс = k 2 [E] загальна
Підстановка цього в попередній вираз дає:
V = V макс [S]/(K м + [S])
Це математичний вираз, який використовується для моделювання експериментальних кінетичних даних
Він відомий як рівняння Міхаеліса-Ментена
Експериментальний підхід
Загальний підхід полягає в додаванні відомої концентрації субстрату до ферменту і визначенні початкової швидкості реакції для цієї концентрації субстрату.
- Швидкість реакції зазвичай задається як молі (або мікромоль) продукту, виробленого за одиницю часу (сек або хв) на моль (або мікромоль) ферменту
- Експеримент повторюється для широкого діапазону концентрацій субстрату
- Збирається таблиця точок даних [S] проти V
- Ці точки даних побудовані (V проти S) і повинні відповідати кривій, яка узгоджується з рівнянням Міхаеліса-Ментена
Терміни V max і K m є власними властивостями конкретної комбінації фермент/субстрат, яку ви вивчаєте
- Вони будуть визначатися з особливостей сюжету V проти S.
V макс
Існує обмежена кількість молекул ферменту, і вони можуть виконувати лише одну реакцію за один раз. Таким чином, при високих [S] ферменти можуть бути насичені
- В умовах насичення реакція йде так швидко, як може, а додаткові збільшення [S] не збільшують швидкість реакції.
- Максимальна спостережувана швидкість дорівнює V max, і дані будуть асимптотично до цього значення при високому [S]
- При низькому [S] швидкість реакції, як правило, лінійно пропорційна [S] (тобто при низькому [S] якщо ви подвоїте [S], V подвоїться)
К м
K m = (k -1 + k 2)/k 1 = (швидкість пробою ЕС)/(швидкість утворення ЕС)
- K m схожа, але не зовсім дорівнює, константа дисоціації (K d) для комплексу ЕС
- Якщо k -1 >> k 2, то K m» K d
- Завдяки такій схожості з виразом для K d, низьке значення K m часто інтерпретується як висока спорідненість ферменту до субстрату, а велике значення для K m часто інтерпретується як слабка спорідненість ферменту до субстрату.
- K m має одиниці молярної концентрації (так само, як і одиниці для [S])
Існує математична обробка, яка дозволяє визначити Км за експериментальними V проти [S] даних
- Розглянемо ситуацію, коли оцінюється [S] призводить до значення V, що дорівнює рівно 1/2 максимальної швидкості реакції:
V = V макс [S]/(K м + [S])
1/2 В макс = V макс [S]/(K м + [S])
1/2 = [С]/(К м + [С])
К м + [S] = 2 [S]
К м = [S]
Таким чином, K m дорівнює концентрації субстрату, що призводить рівно до половини максимально можливої швидкості реакції.
.png)
Малюнок 6.2.2: К м
Лінвівер-Берк («подвійний взаємний» сюжет)
- Рівняння Міхаеліса-Ментена можна переставити, взявши взаємні, щоб отримати:
.png)
- Якщо X = 1/ [S] і Y=1/V, то це лінійне рівняння з нахилом K м/V max і перехопленням Y 1/ V max
.png)
Малюнок 6.2.3: 1/S і1/V
- Так як графік даних 1/ [S] проти 1/v повинен бути прямою лінією, то простіше пристосувати лінійну функцію до даних у такому вигляді, а Vmax і K m можна легко визначити за графіком
оборотне гальмування
Існує дві основні категорії оборотних інгібіторів: конкурентні оборотні інгібітори та неконкурентні оборотні інгібітори:
конкурентні інгібітори
Інгібітор (I) конкурує з субстратом (S) за активну ділянку ферменту (також відомий як сайт S-зв'язування). Зв'язування будь-якої з цих молекул в активній ділянці є взаємовиключним подією.
- Субстрат і інгібітор мають високий ступінь структурної схожості. Однак інгібітор не може протікати через реакцію на отримання продукту.
- Збільшення концентрації субстрату перевершить інгібітор по зв'язуванню з активною ділянкою ферменту.
- Конкурентний оборотний інгібітор може бути ідентифікований за його характерним впливом на кінетичні дані
Вираз для експресії Міхаеліса-Ментена в присутності оборотного конкурентного інгібітора є:
V = V макс [S]/(K м (1+ [I] /K i) + [S])
Де K i - фактична константа дисоціації комплексу EI
Вплив оборотного конкурентного інгібітора на кінетику полягає в наступному:
- Якщо немає інгібітора (тобто якщо [I] = 0), то рівняння однакові
- Як інгібітор додається, ефект полягає в зміні видимого значення K m. Зокрема, видимий K m буде збільшений на величину, рівну (1 + [I] /K I). Якщо K m збільшити, швидкість реакції v зменшиться.
- Зауважте, що коли [S] стає дуже великим, значення знаменника по суті дорівнює [S] і v @ v max. Таким чином, швидкість реакції може бути приведена до vmax з досить високою концентрацією субстрату
Діагностичними критеріями оборотного конкурентного інгібування є те, що, хоча на очевидний Км впливає додавання інгібітора, значення v max не змінюється
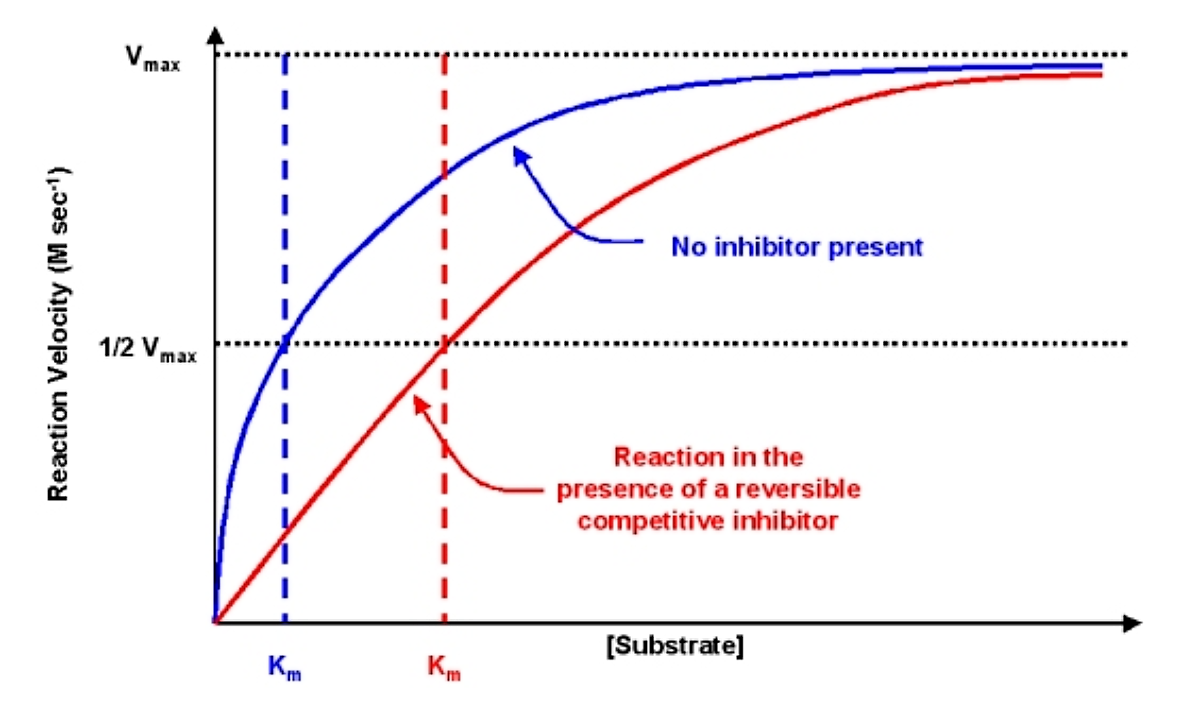.png)
Малюнок 6.2.4: Вплив оборотного конкурентного інгібітора
Як впливає подвійний зворотний сюжет Лайнвівер-Берка від наявності оборотного конкурентного інгібітора?
.png)
Малюнок 6.2.5: Подвійний зворотний графік з оборотним конкурентним інгібітором
неконкурентні інгібітори
Неконкурентні інгібітори реагують як з Е, так і з ЕС (це пов'язано з тим, що неконкурентний інгібітор не зв'язується на тому ж місці в ферменті, що і субстрат)
- Інгібування неможливо подолати шляхом збільшення концентрації S
- Вплив на кінетику полягає в тому, ніби фермент був менш активним (v max знижується), але що спорідненість до субстрату не впливає (K m залишається незмінним), оскільки місце зв'язування субстрату не зайнято неконкурентним інгібітором.
.png)
Малюнок 6.2.6: Вплив оборотного неконкурентного інгібітора
.png)
Малюнок 6.2.7: Подвійний зворотний сюжет з неконкурентним інгібітором
