5.2: Спектрофотометрія
- Page ID
- 7492
Людське око реагує на електромагнітне випромінювання в діапазоні довжин хвиль між 400-750 нм (тобто «видимим спектром»). Зразки світла, які містять безперервний спектр всіх довжин хвиль між 400-750 нм, будуть сприйняті мозком як «біле світло» (наприклад, сонце). Світло, що містить певну довжину хвилі в цьому діапазоні, сприймається мозком як «кольорове»:
|
|
|
|
|
|
Часто об'єкти виглядають кольоровими через їх поглинання світла в межах вибіркових областей видимого спектра. Світло від таких предметів, що кидається в очі (колір якого ми сприймаємо) складається з тих довжин хвиль, які об'єкт НЕ поглинав.
Наприклад, листя рослини містять два фотосинтетичних пігменту: хлорофіл А і хлорофіл Б. Молекула хлорофілу А має здатність поглинати світло з довжиною хвилі в діапазоні 430 і 660 нм; молекула хлорофілу В поглинає світло з довжиною хвилі в діапазоні 450 і 640 нм. Таким чином, ці два пігменти в листі поглинають фіолетовий/синій і оранжевий/червоний довжини хвиль світла (енергія, яку представляють ці фотони, передається молекулам хлорофілу). Світло з довжинами хвиль в діапазоні 500-600 нм не поглинається жодною молекулою. Таким чином, після того, як сонячне світло взаємодіє з листям довжини хвиль, які залишаються (і які наше око може сприймати), зелено-жовті. Тому рослини «зелені», оскільки не поглинають зелене світло.
- Як би виглядав об'єкт, якби він містив пігмент, який поглинав усі довжини хвиль від 400-750 нм? Було б «чорним»
- Це та ж ситуація, що і перебування в закритому приміщенні з вимкненим світлом. Без світла немає кольору.
Якби у нас був зразок соку листя, що містить хлорофіл А і В, ми могли б кількісно оцінити концентрацію хлорофілу за кількістю фіолетового/синього та оранжевого/червоного світла, яке він поглинав. Ми НЕ МОГЛИ кількісно його за кількістю переданого зеленого світла (це було б по суті однакова кількість незалежно від кількості хлорофілу:
.png)
Малюнок 5.1.1: Світлопропускання хлорофілу
Незважаючи на те, що зразок «зеленіший» з більш високими концентраціями хлорофілу, це не пов'язано зі збільшенням інтенсивності зеленої довжини хвилі світла; це пов'язано зі зменшенням фіолетових/синіх та помаранчевих/червоних довжин хвиль світла. Саме це скорочення ми можемо використовувати для кількісного визначення концентрації хлорофілу. Хоча зразок виглядає зеленим, ми не можемо його кількісно контролювати, контролюючи зелену довжину хвилі світла.
Світло, енергія та молекулярна структура
Світло - це дивна річ, це випромінювальна форма передачі енергії, і для того, щоб зрозуміти його властивості, ми повинні вважати, що він має як хвильові, так і частинкові властивості. Різні довжини хвиль світла відрізняються енергією, яку вони несуть; енергія прямо пропорційна частоті світла (чим вище частота, тим вище енергія):
Е α н
Енергетична одиниця - ерг (1Joule = 10 7 ергів), а одиниця частоти - Герц (тобто циклів в секунду, або просто одиниці сек -1). Константа пропорційності - постійна Планка, h, зі значенням і одиницями 6,6 х 10 -27 ерг сек
Е = ч п
ерг = (ерг сек) (сек -1)
Частота (n) світла обернено пропорційна довжині хвилі (l):
n α 1/λ
Частота має одиниці секунди -1, а довжина хвилі має одиниці метрів. Константа пропорційності - c (швидкість світла) зі значенням і одиницями 3 х 10 8 м/сек:
п = с (1/λ) = с/λ
Цей зв'язок вірний у вакуумі; однак «оптично щільні» матеріали можуть уповільнити швидкість світла, що вимагає наступної корекції до вищевказаного рівняння:
п = с/ н л
де n - «показник заломлення» матеріалу і має значення > 1
Тому енергія світла обернено пропорційна довжині хвилі:
Е = (ч с)/(п л)
«Фотон» - це корпускулярний (частинковий) опис світла, який є носієм «квантів» енергії, визначених у вищезгаданому рівнянні. Коли світло поглинається молекулою, він передає свої кванти енергії, і фотон припиняє своє існування. Куди пішла енергія?
- Атомні зв'язки, хімічна структура і електрони даної молекули мають специфічні збуджені стани і коливальні режими.
- Ці збуджені стани та коливальні режими визначали рівні енергії над землею.
- Молекула може змінюватися з основного стану в збуджений стан (або коливальний режим) при поглинанні квантів енергії, рівно рівних різниці між наземним і збудженим станами.
- Таким чином, молекули можуть поглинати енергію, пов'язану з конкретними довжинами хвиль світла, і світло споживається в процесі.
.png)
Малюнок 5.1.2: Масштаб світла
Атомні зв'язки, хімічна та електронна структура молекул мають унікальні властивості і відрізняються від одного типу молекул до іншого.
- Таким чином, енергетичні відмінності між наземним і збудженим станами відрізняються від одного типу молекули до іншого.
- Тому здатність взаємодіяти і поглинати світло, а конкретні довжини хвиль поглинається світла відрізняються від одного типу молекули до іншого
Характерна картина поглинання різних довжин хвиль світла є унікальною для кожного типу молекул і є типом молекулярного «відбитка пальця», який можна використовувати для ідентифікації та кількісного визначення молекул
У прикладі хлорофілу, наведеному вище, інтенсивність світла, що проходить через зразок, називається «світлопроникністю» зразка:
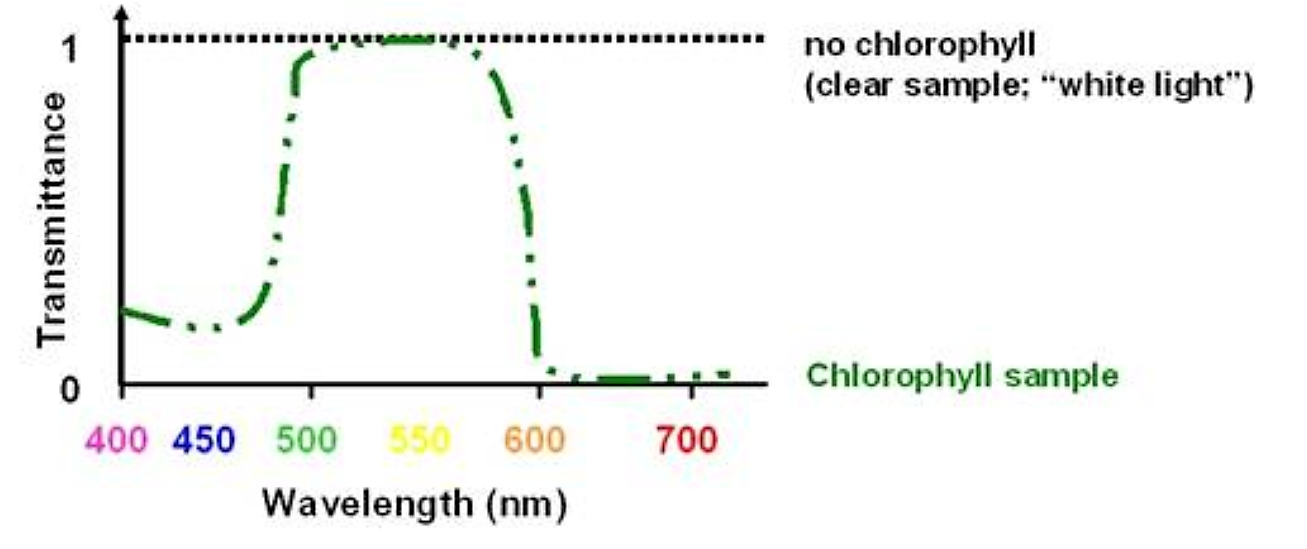.png)
Малюнок 5.1.3: Коефіцієнт пропускання світла хлорофілу
- Коефіцієнт пропускання - це безрозмірне число, яке варіюється від 1 (повний коефіцієнт пропускання) до 0 (відсутність пропускання - повне поглинання)
Важливо відзначити відмінність між коефіцієнтом пропускання і поглинанням: вони обернено пропорційні
- Зразок з високою поглинанням має низьку пропускну здатність світла
.png)
Малюнок 5.1.4: Поглинання хлорофілу
Як кількісно оцінюються коефіцієнт пропускання (T) та поглинання (A)?
- Інтенсивність світла, що світиться на зразку, називається падаючим світлом, I 0
- Інтенсивність світла, виміряна після проходження через зразок, - це прохідне світло, I
- Коефіцієнт пропускання, T, визначається як співвідношення I/I 0 і буде варіюватися в межах від 0 до 1:
.png)
Малюнок 5.1.5: Коефіцієнт пропускання
Як на коефіцієнт пропускання впливає концентрація зразка та фізичний розмір (тобто довжина шляху)?
- Якщо коефіцієнт пропускання зменшується через поглинання зразком, то чим вище концентрація (с), тим нижче коефіцієнт пропускання. Іншими словами, коефіцієнт пропускання обернено пропорційний концентрації: (Закон Пива)
Т α 1/ с
- Аналогічно, чим товщі зразок (тобто чим більше довжина шляху світла через зразок), тим нижче коефіцієнт пропускання. Таким чином, коефіцієнт пропускання також обернено пропорційний довжині шляху (l): (закон Ламберта)
Т α 1/ л
Таким чином, ми очікуємо, що рівняння, що відноситься T до c і l, прийме загальний вигляд:
Т α 1/ сл
Коефіцієнт пропускання виявляється зменшуватися експоненціально зі збільшенням концентрації та довжини шляху, таким чином рівняння має вигляд:
ЛоГТ α 1/сл
-LogT α сл
Константа пропорційності - коефіцієнт екстинкції e:
-LogT = ε сл
Оскільки значення журналу є безрозмірними, одиниці e здаються оберненою концентрацією та зворотною відстанню (наприклад, M -1 см -1)
Термін -logT зліва може бути записаний як журнал (1/T) і визначає зворотну залежність між коефіцієнтом пропускання T та терміном e cl. Оскільки поглинання та коефіцієнт пропускання обернено пов'язані, термін e cl здавалося б зручним визначенням поглинання (A):
журнал (1/T) = ε cl = A
(Закон Пива-Ламберта)
Значення для ε і l
- Довжина шляху l зазвичай в одиницях см
- Молярний коефіцієнт екстинкції ε має одиниці М -1 см -1 і є константою пропорційності, яка пов'язує поглинання молярних розчинів
- Коефіцієнт масового зникнення ε 1% відноситься до поглинання 1% по масі розчину. Як правило, це стосується водного розчину, який ми можемо прийняти, щоб мати щільність 1000 г/л. 1% за масою водного розчину, отже, буде стосуватися розчинення 10 г/л, або 10 мг/мл розчину молекули, що цікавить.
- Оскільки поглинання молекули є функцією довжини хвилі (тобто поглинання не дорівнює для кожної довжини хвилі), коефіцієнт екстинкції також повинен посилатися на довжину хвилі. Зазвичай це робиться за допомогою нижнього індексу:
ε 1% 280нм = 14,5 г -1 л см -1
· У цьому випадку розчин молекули 10 мг/мл матиме показання поглинання 14,5 (безрозмірні одиниці) при l = 280nm (поглинання на інших довжині хвиль може бути невідомим). Одиницями концентрації є г/л, при цьому e матиме розміри g -1 L см -1.
Взаємозв'язок між змінами в A, T і c
· Пряма залежність між A і c означає, що існує лінійна залежність між поглинанням і концентрацією. Якщо подвоїти концентрацію, поглинання подвоїться тощо.
· Зворотний зв'язок журналу між коефіцієнтом пропускання та поглинанням можна вказати як:
Т = 1/10 А
- Таким чином, подвоєння концентрації призведе до 10-кратного зменшення коефіцієнта пропускання. Прилади для вимірювання поглинання (спектрофотометри) фактично вимірюють коефіцієнт пропускання і, природно, стають менш точними при низьких значеннях коефіцієнта пропускання. Таким чином, чим вище показання поглинання, тим менш точним воно є. Більшість таких приладів є неточними при показаннях поглинання> 1.5 (це працює, щоб бути при коефіцієнті пропускання < 3% від повного пропускання)
Проектування спектрофотометрів
Спектрофотометри є прецизійними приладами, однак концептуально вони включають порівняно небагато частин. Проста конструкція виглядала б приблизно так:
.png)
Малюнок 5.1.6: Спектрофотометр
- Вольфрамова лампа використовується для отримання довжин хвиль світла, що охоплюють видимий діапазон, в той час як дейтерієва лампа використовується для отримання світла, що охоплює ультрафіолетовий діапазон.
- Рухома призма або дифракційна решітка регулюється, щоб направити хвилю інтересу до зразка
- Це спектрофотометр «одного променя», а еталонні та зразкові дані збираються окремо (еталонний зразок використовується для визначення максимального значення пропускання (ефективно I 0)
Модифікація цієї конструкції, спектрофотометр «подвійний промінь», може дозволити одночасне вимірювання I і I 0:
.png)
Малюнок 5.1.7: Двопроменевий спектрометр
Як одиночні, так і подвійні променеві детектори дозволяють досліднику контролювати властивості поглинання для однієї довжини хвилі світла (довжина хвилі, обраної налаштуваннями призми/щілини. Модифікація, яка включає масив детекторів, може дозволити одночасне вимірювання спектру довжин хвиль:
.png)
Малюнок 5.1.8: Одночасне вимірювання спектра
Спектри поглинання біологічних молекул
Білки
Білки не поглинаються на видимій довжині хвилі, якщо вони не мають протезної групи (наприклад, Fe 2+) або неприродної амінокислоти. Однак амінокислоти триптофан, тирозин і цистеїн поглинають світло на довжині хвилі УФ:
.png)
Малюнок 5.1.9: Поглинання триптофану
- Триптофан має пік поглинання при 280 нм в УФ-діапазоні
- Це корисна довжина хвилі для кількісного поглинання триптофану
- Оскільки абсорбція пропорційна концентрації, це корисний спосіб кількісного визначення концентрації білка (для білків, що містять Trp)
Нуклеїнові кислоти
Ароматичні кільця в основах нуклеїнових кислот також поглинають в УФ-діапазоні:
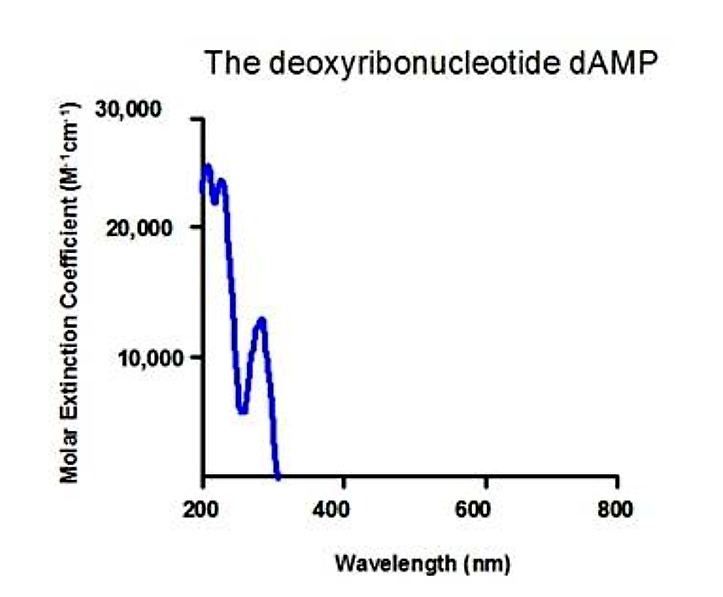.png)
Малюнок 5.1.10: Поглинання нуклеїнової кислоти
- Кожна основа ДНК та РНК має дещо інший спектр поглинання
- 260 або 280 нм - це зазвичай корисна довжина хвилі для моніторингу концентрації нуклеїнових кислот
Зверніть увагу, що зразки нуклеїнових кислот і білків можуть як поглинати при 280 нм, тому зразки біологічних молекул повинні бути чистими, щоб кількісно використовувати УФ-абсорбційну спектроскопію.
