4.1: Очищення білка
- Page ID
- 7536
Аналізи, специфічна активність, початкове фракціонування
Успішна процедура очищення білка може бути не що інше, як дивовижна. Якщо ви починаєте з рекомбінантного білка, який виробляється в кишковій паличці, або намагаєтеся виділити білок з деякої тканини ссавців, ви, як правило, починаєте з грамової кількості складної суміші білка, нуклеїнових кислот, полісахариду тощо, з яких вам, можливо, доведеться витягти міліграм (або мікрограм!) кількості бажаного білка при високій чистоті, і, сподіваюся, з високим урожаєм.
Першим кроком будь-якого очищення є розробка специфічного аналізу на цікавить білок. Специфічний аналіз може базуватися на деякій унікальній характеристиці білка, що цікавить
- ферментативна активність
- імунологічна активність
- Фізичні характеристики (наприклад, молекулярна маса, спектроскопічні властивості тощо)
- Біологічна активність
- В ідеалі аналіз повинен бути
- Конкретні (ви не хочете помилкового позитиву)
- швидке (ви не хочете чекати тиждень на результати)
- чутливий (ви не хочете споживати весь ваш зразок, щоб проаналізувати його)
- кількісний (потрібен точний спосіб вимірювання кількості вашого білка на кожному етапі очищення)
Вестерн Блоттінг
Антитіла можуть бути використані в методі під назвою Вестерн блоттинг, який корисний для визначення рівнів експресії білка і для аналізу білків під час очищення. Цей спосіб зазвичай передбачає наступні етапи:
- Пробу білка піддають електрофорезу поліакриламідного гелю.
- Після цього гель поміщають поверх листа нітроцелюлози і білок в гелі електрофоретично переносять в нітроцелюлозу.
- Потім нітроцелюлозу замочують в желатині, щоб «блокувати» його здатність неспецифічно зв'язувати білки.
- Потім нітроцелюлоза інкубується зі специфічним антитілом до білка, що цікавить.
- Потім нітроцелюлозу інкубують другим антитілом, яке є специфічним для першого антитіла. Наприклад, якщо перше антитіло було піднято у кроликів, друге антитіло можна назвати «козячим імуноглобуліном проти кролика». Це означає, що імуноглобуліни кролика були використані для виклику відповіді антитіл у кіз. Антитіла кози (поліклональні) включатимуть ті, які розпізнають збережену область в кролячих антитілах. Оскільки область Fc збережена, вона зв'язується з будь-якими і всіма кролячими антитілами, включаючи ті, що знаходяться на нітроцелюлозному папері.
- Друге антитіло, як правило, має ковалентно прикріплений фермент, який при забезпеченні хромогенним субстратом спричинить кольорову реакцію.
- Таким чином, молекулярну масу і кількість потрібного білка можна охарактеризувати з складної суміші (наприклад, сирого клітинного екстракту) інших білків.
У варіанті вищесказаного зразок білка може бути промазаний безпосередньо на нітроцелюлозному папері (називається точковою плямою) без попереднього запуску гелю. Це може бути бажаним, якщо, наприклад, антитіло є моноклональним і розпізнає епітоп, який залежить від нативної структури (яка буде знищена при запуску SDS PAGE).
Окрім різноманітного їх використання, антитіла також можуть використовуватися для очищення білків.
- Якщо можна отримати відносно велику кількість антитіл, їх можна ковалентно прикріпити до хроматографічної смоли (наприклад, кульки сефадексу).
- Якщо по такій колонці пробігти сирої клітинний екстракт, зв'язуватися повинен тільки цікавить білок, а все інше буде протікати.
- Зв'язаний білок потім можна елюювати. Зазвичай це досягається помірно низьким рівнем рН (з використанням оцтової кислоти). Поки цікавить білок не буде необоротно денатурований такими умовами, метод буде працювати досить добре.
- Одним з потенційних підводних каменів є моноклональні антитіла, які використовуються для очищення мутантних білків. Області білка, що містять епітоп, не можуть бути модифіковані, не руйнуючи здатність антитіла зв'язуватися. Таким чином, застосування моноклональних антитіл в схемі очищення може виключити його використання при очищенні певних мутантів.
Очищення білка можна розглядати як ряд етапів фракціонування, розроблених таким чином, щоб:
- Цікавий білок міститься майже виключно в одній фракції (причому з хорошим врожаєм)
- Значна кількість забруднень можна знайти в різній фракції.
Під час очищення потрібно буде стежити за декількома параметрами, серед яких:
- Загальний обсяг вибірки
- Загальний білок зразка (можна оцінити по А 280; 1,4 ~ 1,0 мг/мл)
- Одиниці активності потрібного білка (на основі специфічного аналізу)
Ця основна інформація дозволить вам відстежувати наступну інформацію під час кожного етапу очищення:
- % виходу для кожного етапу очищення
- Питома активність потрібного білка (одиниць/мг загального білка)
- Покращення очищення кожного етапу (наприклад, «3.5x очищення)
При розробці схеми очищення, як правило, доводиться збалансувати очищення з врожайністю.
- Наприклад, отримати 90% чистого матеріалу з хорошим урожаєм може бути відносно просто.
- Однак, це може бути важко поліпшити цю чистоту додаткові кілька процентиль з хорошою врожайністю.
- Планове застосування очищеного білка визначає цільову чистоту.
- Якщо білок буде використовуватися для визначення інформації про послідовність амінокислот, можливо, 90% є прийнятним. Однак, якщо матеріал буде використовуватися в клінічних випробуваннях, 99,99+% може бути цільовою чистотою.
Початкові етапи очищення
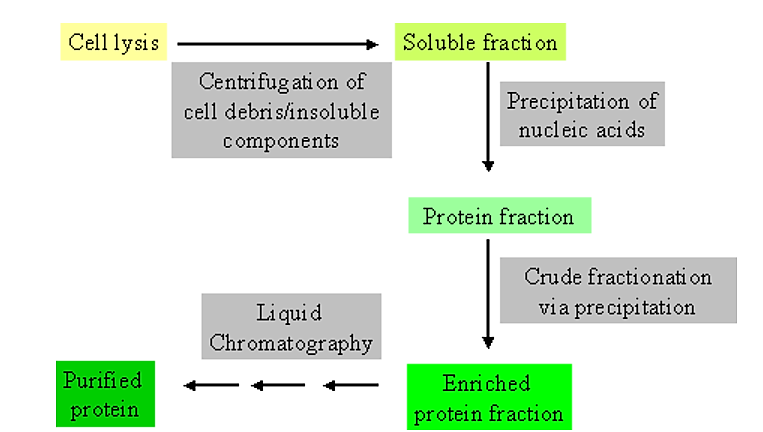.png)
Малюнок 4.1.1: Етапи очищення
- Надзвичайно корисно мати деяку інформацію не тільки про загальні фізико-хімічні характеристики білка, який ви намагаєтеся очистити, але і про забруднюючих компонентах.
- Наприклад, багато білків кишкової палички, як правило, мають низьку молекулярну масу (<50 000 Да) і дещо кислі в ізоелектричній точці
Зазвичай на початкових етапах очищення використовуються загальні фізичні та/або хімічні відмінності між розчинними білками та іншими компонентами клітин.
- Наприклад, розчинні білки можна відокремити від загального клітинного сміття та інтактних клітин шляхом центрифугування.
- Таким чином, клітини фізично порушуються (за допомогою гомогенізації або клітинного преса), щоб дозволити звільнення вмісту клітин. Потім слід центрифугування, щоб відокремити загальнорозчинні компоненти від нерозчинних.
- Саме в цей момент починається збір даних для того, щоб стежити за очищенням.
Нуклеїнові кислоти іноді можуть бути легко видалені із зразка шляхом додавання великих катіонних сполук, таких як поліетиленімін або сульфат стрептоміцину.
- Нуклеїнові кислоти зв'язуються з цими сполуками за допомогою електростатичних взаємодій, і комплекс випадає в осад і може бути видалений за допомогою центрифугування.
- Такий же загальний результат можна отримати шляхом змішування в іонообмінних смолах, які є аніонообмінниками (тобто смоли містять катіонні групи), а потім фільтрування або центрифугування для видалення. Як і в будь-якому методі, слід підтвердити, що бажаний білок також не пов'язаний.
Сирі фракції білків можуть бути досягнуті шляхом додавання різних кількостей опадів, таких як сульфат амонію або поліетиленгліколь (ПЕГ).
- Для цього типу етапу очищення проводиться початковий експеримент для контролю частки загального білка, а також бажаного білка, що залишається в розчині (і гранулі) в залежності від концентрації осадителя.
|
Сульфат амонію (% насиченого) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
Зразок А 280 |
1000 |
900 |
600 |
200 |
100 |
75 |
50 |
40 |
25 |
20 |
|
Аналіз активності (одиниці) |
200 |
200 |
200 |
190 |
170 |
100 |
30 |
5 |
0 |
0 |
.png)
Малюнок 4.1.2: Активність білка як функція концентрації осадника
- У цьому конкретному прикладі нам пощастило: приблизно на 30% сульфату амонію ми можемо осаджувати близько 80% від загальної концентрації білка в нашому зразку, але наш аналіз активності для бажаного білка вказує на те, що близько 95% нашого бажаного білка все ще розчинні.
- При 80% сульфату амонію весь наш бажаний білок випав в осад. Таким чином, з цих результатів ми зробили б наступне:
- Додайте сульфат амонію в наш зразок до концентрації 30% насичення
- Центрифуга і викинути гранули
- Додайте сульфат амонію до 80% насичення
- Центрифугуйте і зберігайте гранули. Ресуспендувати гранули в буфері для солюбілізації білка.
- Ми очікуємо приблизно 5-кратного очищення з врожайністю близько 95%.
Колонна хроматографія - іонний обмін; Діаліз та концентрація
Колонна хроматографія
Після початкових етапів фракціонування типовою процедурою є перехід до колонкової хроматографії.
- У колонковій хроматографії ми маємо скляну трубку (колонку), яка заповнена матеріалом («смолою»), який має певні фізичні/хімічні характеристики.
- Ці характеристики дозволяють йому по-різному взаємодіяти з різними білками.
- Деякі поширені типи хроматографічних смол включають:
- іонний обмін
- гідрофобні
- Гелева фільтрація
- спорідненість
іонний обмін
Іонообмінні смоли містять заряджені групи.
- Вони можуть мати кислотну природу (в цьому випадку смола є катіонообмінником)
- або базовий (в такому випадку це аніонний обмінник).
- Катіонообмінники і аніонообмінники можуть бути розбиті далі на слабкі і сильні обмінники (відображають спорідненість зв'язування).
|
Тип теплообмінника |
Функціональна група |
Загальна назва |
|---|---|---|
|
Слабкий катіоніт |
карбоксиметил |
ЦМ целюлоза/сефадекс |
|
Сильний катіонний обмінник |
сульфопропіл |
SP сефадекс |
|
Слабкий аніонообмінник |
діетиламіноетил |
DE целюлоза/сефадекс |
|
Міцний аніонообмінник |
четвертинний амін |
Сефадекс QAE |
- Зазвичай зразки завантажуються в умовах низької іонної міцності, а зв'язаний матеріал елююється за допомогою ступеневого або градієнтного елюювання буфера з більш високою іонною силою.
- Взагалі кажучи, білок зв'яжеться з катіонообмінною смолою, якщо буферний рН нижчий, ніж ізоелектрична точка (pI) білка, і зв'яжеться з аніонообмінною смолою, якщо рН вище pI.
.png)
Малюнок 4.1.3: Зв'язування білка зі смолами
- Знання pI білка, отже, корисно при розробці протоколу очищення з використанням іонообмінних смол (однак, ви завжди можете просто спробувати різні смоли, щоб побачити, яка працює найкраще).
Взагалі кажучи, іонообмінні колонки короткі і жирні за розмірами.
Елюція білків з іонообмінних смол
- Білки, пов'язані з іонообмінними смолами, зв'язуються за допомогою нековалентних іонних (соляно-місткових) взаємодій. Ми можемо конкурувати за ці іонні місця зв'язування на смолі з іншими іонними групами, а саме солями
- Існує два загальних типи методів при елююванні сольовим розчином: 1. Градієнтне елюювання і 2. Елюція кроку
- Градієнтне елюювання відноситься до плавного переходу концентрації солі (від низької до високої) в буфері елюції. Слабко зв'язуючі білки елітуть першими, а сильніші зв'язуючі білки елутують останніми (тобто вони вимагають більш високих концентрацій солі в буфері, щоб конкурувати з ними з колони)
- Градієнтну концентрацію солі можна зробити за допомогою градієнтного виробника. У найпростішому вигляді це складається з двох ємностей (повинні бути однакової форми), з'єднаних сифоном (або трубкою внизу). Один контейнер містить буфер з низьким вмістом солі, а інший містить буфер з високим вмістом солі. Буфер вилучається з ємності з низьким вмістом солі:
.png)
Малюнок 4.1.4: Виробник градієнтів
- Це дасть лінійний градієнт від низької до високої концентрації солі над загальним об'ємом градієнта
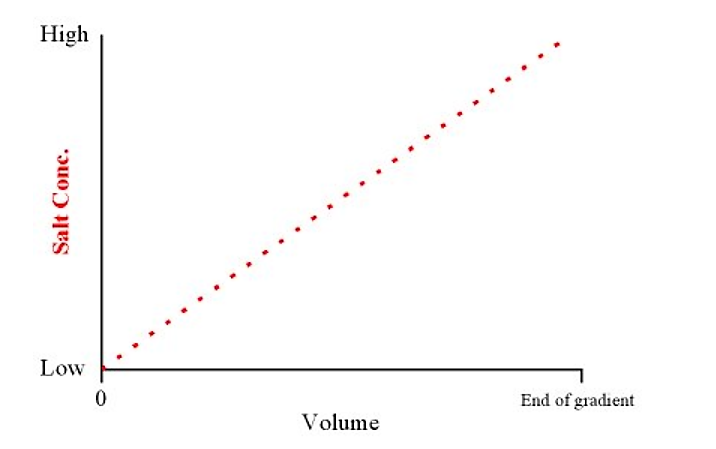.png)
Малюнок 4.1.5: Концентрація і об'єм солі
- Якщо ми знаємо діапазон концентрацій солі, над яким буде виділятися цікавий білок, ми можемо просто елітувати буфером, що містить цю концентрацію солі. Це відоме як крок елюції.
- Ступінчасті елюції, як правило, швидше запускаються, і елітують білок в меншому загальному обсязі, ніж при градієнтних елюціях. Вони, як правило, найкраще працюють, коли забруднюючі речовини виділяють при значно іншій концентрації солі, ніж цікавить білок.
.png)
Малюнок 4.1.6: Ступінчаста елюція
Зверніть увагу, що після іонообмінної хроматографії цікавий білок буде знаходитися в буфері з потенційно високою концентрацією солі. Це необхідно враховувати, перш ніж приступити до наступного етапу в схемі очищення.
Діаліз
- Після етапу осадження сульфату амонію або етапу іонообмінної хроматографії білок, що цікавить, може перебувати в буфері з високим вмістом солі. Це може бути небажано з кількох причин. Як ми позбавляємося від солі в нашому зразку?
- Одним з найпоширеніших методів є діаліз.
- Метод діалізу передбачає використання напівпроникних мембран. У найпростішому прикладі ця мембрана виготовляється у вигляді трубок (зовні дуже нагадує кожух ковбаси)
- Головна особливість цієї мембрани полягає в тому, що вона пориста. Однак розмір пор такий, що хоча невеликі іони солі можуть вільно проходити через мембрану, більші білкові молекули не можуть (тобто вони утримуються). Таким чином, діалізні мембрани характеризуються молекулярною масою найменшого типового кулястого білка, який він буде утримувати.
- Це зазвичай називають відсіченням трубки (наприклад, Spectrapore #6 діалізної трубки має відсічення 1,000 Дальтон, що означає, що 1,000 Dalton білок буде утримуватися трубкою, але що менші молекулярні маси розчинів будуть проходити через трубки).
- Діаліз триває шляхом розміщення зразка високої солі в діалізну трубку (тобто діалізний «мішок») і введення його в бажаний буфер з низьким вмістом солі:
.png)
Малюнок 4.1.7: Діаліз
- З часом концентрація низькомолекулярних розчинених речовин всередині мішка та в буфері з низьким вмістом солі досягне рівноваги. У практичному плані (для вищезазначеного випадку) молекули солі будуть дифундувати з мішка в буфер з низьким вмістом солі:
.png)
Малюнок 4.1.8: Дифузія солі
- При рівновазі концентрацію солі проби можна розрахувати наступним чином:
$\ frac {(зразок\: обсяг)\ раз (зразок\: сіль\: концентрація) + (буфер\: об'єм)\ раз (буфер\: сіль\: концентрація)} {загальний\: обсяг} = кінцевий\ :сіль\: концентрація$
Примітка
Часто концентрація буферної солі становить 0 М.
- Буферний об'єм для діалізу є функцією необхідної кінцевої концентрації солі в зразку
Приклад 4.1.1:
Приклад діалізу
У нас є зразок протеїну 10 мл з басейну елюції іонообмінної колонки, який містить 1,0 М NaCl. Для нашого наступного етапу очищення ми можемо мати не більше 1 мм NaCl у зразку.
.png)
Отже, необхідний обсяг буфера буде (загальний обсяг - обсяг зразка) = 9,990 л (або ~ 10 л)
- Таким чином, якби ми діалізували 10 мл зразка (з 1,0 М NaCl conc) у 10 л води після рівноваги, концентрація NaCl у зразку становила б 1,0 мМ.
- Зверніть увагу, що у наведеному вище прикладі це зазвичай називають діалізом «1:1 000».
- Припустимо, що ми не хочемо, щоб зробити 10 л буфера? Ми можемо досягти однакових результатів за допомогою двох послідовних діалізів «1:32» (тобто квадратний корінь діалізу 1:1 000 - іншими словами, два послідовних 1:32 діалізу еквівалентні одному діалізу 1:1 000):
Перший діаліз проти 310 мл буфера: зразок NaCl conc буде (10* 1,0)/(320) = 31 мМ
Другий діаліз проти 310 мл буфера: зразок NaCl conc буде (10* 0,031)/(320) = 0,97 мМ
Таким чином, замість того, щоб робити 10 л буфера, ми могли б зробити лише 620 мл і досягти таких же результатів за допомогою двох етапів діалізу
- У цьому випадку видалення солі займе вдвічі більше часу, тобто нам потрібно виконати два етапи діалізу. Скільки часу займає діаліз?
Корисним правилом є те, що для більшості типів діалізних трубок діаліз становить 80% змагаються через чотири години.
- Одним із наслідків діалізу, на який слід стежити, є те, що, поки іони солі рухаються з мішка, молекули води рухаються в мішок. Таким чином, обсяг зразка може фактично збільшитися (мішок розбухне) і, отже, концентрація білка зменшиться
- В крайньому випадку сумка може насправді набрякнути до місця розриву. Тому непогано не заповнювати мішок повністю, а залишити порожнечу, щоб дозволити потенційний набряк.
Концентрація
- Що робити, якщо наш зразок білка занадто розбавлений для наших потреб? Як ми можемо сконцентрувати наші зразки?
- Одним з поширених методів є, знову ж таки, використовувати для цієї мети напівпроникну мембрану.
- Дуже простий метод полягає в тому, щоб помістити наш зразок в діалізний мішок і покрити його високомолекулярним розчиненою речовиною, яка може бути легко розчинена буфером.
- Наприклад, поліетиленгліколі і полівінілпіролідони можуть мати дуже великі молекулярні маси (тобто 20 000 Да). Ці сполуки також легко розчиняються у воді. Якщо наш зразок в діалізному мішку покритий сухими формами вищезазначених полімерів, вода покине діалізний мішок (він може пройти через пори) і гідратувати полімери. Результатом є зменшення обсягу буфера в діалізному мішку (білок буде концентрований).
- В іншій варіації напівпроникна мембрана виготовляється в плоский диск і розміщується на дні контейнера, який утримує наш зразок. В одному способі контейнер під тиском і змушує буфер вийти з контейнера (білок зберігається і концентрується). В іншому методі посудину центрифугують, і доцентрова сила досягає тієї ж мети, що і тиск у попередньому прикладі.
Як для діалізу, так і для концентрації важливо, щоб мембрана не взаємодіяла з білком (тобто не мала спорідненості до білка і не зв'язувала його)
- За допомогою концентраторів типу тиску діаліз та концентрація можуть бути досягнуті в тандемі. Наприклад, зразок можна концентрувати, а потім додати буфер до зразка. Потім зразок знову концентрується. Кожен раз, коли додається буфер, концентрація солі зменшується. Після повторних циклів цього концентрація солі знаходиться на потрібному рівні і зразок концентрується до потрібного кінцевого обсягу.
Гелева фільтрація, спорідненість та гідрофобні смоли; Підготовка смоли, сантехніка
Гелева фільтрація
Гелева фільтрація не спирається на будь-яку хімічну взаємодію з білком, скоріше вона заснована на фізичній властивості білка - це ефективний молекулярний радіус (який відноситься до маси для більшості типових кульових білків).
- Гелеву фільтраційну смолу можна розглядати як кульки, які містять пори певного діапазону розмірів.
- Великі білки, які не можуть потрапити в ці пори, проходять навколо зовнішньої сторони намистин.
- Менші білки, які можуть потрапити в пори намистин, мають довший звивистий шлях, перш ніж вони вийдуть з кульки.
- Таким чином, зразок білків, що проходять через колонку гелевої фільтрації, буде відокремлюватися залежно від розміру молекули: перші виділятимуться великі, а найменші елутуватимуться останніми (а білки «середнього» розміру будуть елітувати посередині).
.png)
Малюнок 4.1.9: Гелева фільтрація
- Якщо ваш білок незвично «маленький» або «великий» в порівнянні з забруднюючими білками, то гелева фільтрація може працювати досить добре.
Де буде виділятися білок в експерименті з фільтрації гелю?
- У профілі розділення гелевої фільтраційної колони є дві крайності.
- Існує критична молекулярна маса (велика маса), яка буде повністю виключена з фільтруючих гранул гелю. Всі розчинені речовини в зразку, які рівні або більше цього критичного розміру, будуть вести себе однаково: всі вони будуть елююватися в виключеному обсязі колони
- Існує критична молекулярна маса (мала маса), яка буде повністю включена в пори фільтруючих кульок гелю. Всі розчинені речовини в зразку, які дорівнюють або менші, ніж цей критичний розмір, будуть вести себе однаково: всі вони будуть елююватися в включеному обсязі колони
- Розчинені речовини між цими двома діапазонами молекулярної маси будуть виділятися між виключеними та включеними обсягами
.png)
Малюнок 4.1.10: Виключений проти включений обсяг
Як правило, виключений обсяг (Vo) приблизно дорівнює третині обсягу колонки, включений обсяг приблизно дорівнює двом третинам обсягу колонки
- У гелевій фільтрації роздільна здатність залежить від довжини колонки (чим довше, тим краще)
- Однак один недолік пов'язаний з максимальним обсягом зразка, який можна завантажити. Чим більше обсяг завантаженого зразка, тим більше перекриття між відокремленими вершинами. Взагалі кажучи, розмір вибірки, який можна завантажити, обмежений приблизно 3-5% від загального обсягу стовпця.
- Таким чином, гелева фільтрація найкраще зберігається для кінцевих етапів очищення, коли зразок може бути легко сконцентрований до невеликого обсягу.
- Гелева фільтрація може використовуватися і для видалення солей з зразка, завдяки своїй здатності відокремлювати «дрібні» від «великих» компонентів.
- Нарешті, гелева фільтрація може бути одним з найбільш «щадних» методів очищення через відсутність хімічної взаємодії зі смолою.
Афінна хроматографія
Аффінна хроматографія - це загальний термін, який застосовується до широкого спектру хроматографічних носіїв. Це можна в основному розглядати як якусь інертну смолу, до якої була приєднана якась сполука, яка має специфічну спорідненість до вашого білка, що представляє інтерес.
- Таким чином, специфічне антитіло, прикріплене до інертної смоли, було б типом афінної хроматографії.
- Інші приклади можуть включати: інгібітор протеази, прикріплений до деякої матриці, призначений для зв'язування певної протеази
- кофактор, пов'язаний з деякою матрицею, призначений для зв'язування з певним ферментом
- іон металу, пов'язаний з матрицею, призначений для хелатування білка з місцем зв'язування металу, і так далі.
У кожному конкретному випадку тип використовуваних смол і спосіб кріплення можуть відрізнятися, як і метод елюації. Одне узагальнення щодо методу елюції полягає в тому, що зв'язаний ліганд може бути зрівнятий з функціональної групи колони шляхом включення в буфер елюції високої концентрації вільної функціональної групи. Наприклад, якщо функціональна група колонки є кофактором, то зв'язаний білок можна змагатися з колони, пропустивши через колонку буфер, що містить високу концентрацію кофактора (або кофакторного аналога).
Інші методи елюції включають зміну буферних умов таким чином, що білок більше не перебуває в нативному стані (оскільки саме нативний стан надає структуру, необхідну для специфічної зв'язуючої взаємодії). Цього можна досягти, змінивши рН або додаючи денатуруючі агенти, такі як сечовина або гуанідин.
За допомогою афінної хроматографії, як правило, очищення, досягнуте за один крок, може бути драматичним - близько декількох тисяч разів. Одноступінчасті очищення зі специфічними стовпцями спорідненості не є нечуваними - насправді це ідеальна мета очищення - матриця, яка розпізнає тільки цікавить білок і ніхто інший.
Гідрофобні смоли
Гідрофобні смоли містять неполярну функціональну групу, таку як алкан або ароматична група.
- Багато білків здатні секвеструвати такі групи на своїй поверхні і це виключення з розчинника забезпечує основу енергії зв'язування (тобто «гідрофобний ефект»).
- Ця взаємодія посилюється за рахунок збільшення іонної сили, так що білки можуть зв'язуватися в умовах високої солі і виділятися в умовах низької солі.
- Як такі колонки можуть використовуватися не тільки для забезпечення очищення, але і для знесолення зразків (наприклад, після початкового осадження сульфату амонію).
- Зазвичай неможливо заздалегідь передбачити, яка саме смола зв'яже даний білок, це зазвичай визначається емпіричним шляхом. Однак чим довше алкан, або чим більше ароматична сполука, тим сильніше зв'язування, як правило, буде.
Завдяки природі гідрофобних взаємодій та іонної міцності гідрофобна хроматографія та іонообмінна хроматографія можуть бути зручно використані послідовно. Наприклад, після іонного обміну білок знаходиться в умовах високої солі, тому його можна завантажувати безпосередньо на гідрофобну колону. І навпаки, гідрофобна колона елююється в низькій солі, що є вимогою для зв'язування з іонообмінною смолою.
Слід зазначити різницю між гідрофобною взаємодією, хроматографією та зворотною фазовою хроматографією.
- Хроматографія гідрофобної взаємодії проводиться в умовах водного розчинника і зміни іонної міцності використовуються для елюції колони. Білок зазвичай зв'язується в нативному стані за допомогою гідрофобних груп, розташованих на поверхні білка. Рідний стан зберігається в умовах елюції.
- Хроматографія зворотної фази використовує гідрофобний розчинник (зазвичай ацетонітрил), а зв'язування ліганду є функцією фазового розподілу між гідрофобною природою розчинника та функціональною групою колони. Білки зазвичай денатуруються в таких розчинниках і зв'язуються завдяки гідрофобному характеру всієї поліпептидної послідовності. Оскільки більшість гідрофобних груп розташовані в ядрі кулястих білків, зв'язування пов'язане з денатурацією білка і доступністю цих груп до функціональних груп колони. Білки можуть бути очищені за допомогою зворотної фазової хроматографії, але, як правило, їх потрібно певним чином перекласти, щоб відновити функціональність (тобто нативний стан)
приготування смол
Етапи приготування хроматографічної смоли зазвичай включають:
- гідратація смоли
- Декантування дрібної фракції
- Врівноваження смоли і приготування суспензії
- Дегазація суспензії
- Смоли бувають або сухими, або попередньо набряклими. Якщо вони сухі, їх потрібно зволожити. Зазвичай це досягається шляхом змішування сухої смоли з буфером і даючи їй повільно гідратувати протягом ночі (або швидше) при більш високих температурах.
- Після того, як смола гідратується і осіде, дуже дрібні частинки осідуть у верхній частині. Ці «дрібниці» уповільнюють швидкість потоку упакованої смоли. Тому осіла смола ретельно зціджують, щоб відкинути ці штрафи.
- Потім смола врівноважується в буфері, який буде використовуватися для аналізу. Еквілібрація зазвичай включає Ph'ing смоли, або буферні обміни. Ніколи не використовуйте смугу перемішування, коли Ph'ing смоли (вона може механічно зсунути смолу і виробляти дрібну фракцію), а перемішуйте смоляну суспензію стрижнем перемішування.
- Після того, як вирівняна смола осідає, рівний обсяг буфера додається для отримання 50% суспензії смоли. Зазвичай це досить «тонке», щоб бульбашки повітря виходили при упаковці колони.
- Нарешті, суспензія дегазується перед упаковкою колони. Це допоможе мінімізувати утворення бульбашок повітря.
упаковка колони
Колони низького тиску, як правило, упаковуються з використанням сили тяжіння.
- Додайте невелику кількість буфера в нижню частину колонки.
- Помістіть пакувальний резервуар на верхній частині колони. Оскільки ми будемо використовувати 50% суспензії, ми матимемо об'єм, який в 2 рази перевищує обсяг колони, і найкраще заливати смолу в усі за один раз. Таким чином, набивний резервуар повинен мати обсяг, рівний, або більший, ніж обсяг колони.
- Обережно вилийте смоляну суспензію в пакувальний резервуар/колону, уникаючи якомога більшого введення бульбашок повітря
- Дайте колонці сидіти близько 5 хвилин, щоб великі бульбашки повітря витекли
- Відкрийте клапан колонки внизу і дайте колоні упакувати під самопливом
- Зверніть увагу на верхню частину смоляного ложа. Він буде рухатися вниз, як колонка пакує. Коли колона упакована, верхня частина смоляного шару більше не буде рухатися вниз.
Сантехніка
Системи хроматографії можна запускати, використовуючи лише гравітацію та склянку для збору відповідної фракції. Найбільш поширені системи, однак, будуть включати в себе наступне:
- Насос. Зазвичай перистальтичний насос зі змінною витратою і комунікаційним портом для контролера. Насос, як правило, налаштований на проштовхування буфера через колону, а не всмоктування буфера з колони (що може спричинити стан низького тиску з утворенням бульбашок повітря)
- Детектор. Зазвичай це УФ-детектор (A 280). Більшість детекторів мають двоклітинний тип - це означає, що ви можете мати звичайний буфер як порожній у детекторі під час аналізу фракцій стовпців. Детектор надсилає інформацію про поглинання на реєстратор діаграм, який буде відображатися (надруковано)
- Колектор фракцій. Це дозволяє збирати фракції або за кількістю крапель (~30 на мл), або за часом. У поєднанні з керованим насосом збір часу перетворюється на обсяг. Колектор фракцій, як правило, має комунікаційний порт для виведення сигналу, коли він змінює фракції, і для отримання команд від детектора/контролера на деяких складних системах.
- Диктофон. Це надрукує безперервний слід виходу детектора та маркер події колектора фракцій (сигналізація при зміні дробу). Дроби також можна зчитувати окремо на УФ-спектрофотометрі, якщо реєстратор діаграм недоступний.
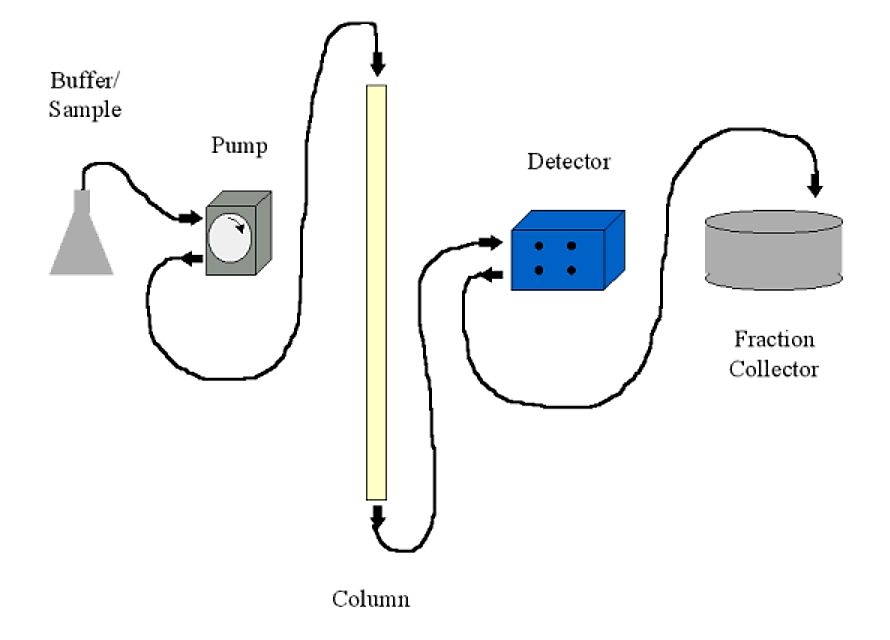.png)
Малюнок 4.1.11: Налаштування хроматографії
- Якщо використовується гравітаційна система, слід встановити запобіжний контур, щоб запобігти висиханню колони, якщо буфер витрачається, коли колона знаходиться без нагляду
.png)
Малюнок 4.1.12: Запобіжна петля
Зверніть увагу, що нижня частина запобіжного контуру знаходиться нижче вихідного отвору до колектора фракцій.
Запуск експерименту, вирішення піків
Нижче наведено приклад експерименту з рідинної хроматографії низького тиску (іонообмінна смола).
Зразок:
- Обсяг = 90 мл
- А 280 = 1.8
- Всього А 280 = 162
Колонка:
- ДЕ-52 (діетиламіноетилцелюлоза; аніонний обмін)
- Розмір = 1,0 х 12,7 см
- Обсяг
.png) = 40 мл
= 40 мл
Колектор фракцій:
- 10 мл/дріб (~ 300 крапель/дріб)
Хроматограма для цього експерименту виглядала так:
.png)
Малюнок 4.1.13: Хроматограма
Під час цього запуску хроматографії відбулися наступні події:
1. Зверніть увагу на галочки на хроматограмі.
- Маркер «події» від колектора дробів повідомляє реєстратор діаграми, коли відбувається зміна трубки.
- Експеримент починається з галочки поруч з «0» на осі x («галочка 0»); це вказує на початок дробу (трубки) номер 1.
- Наступна галочка («галочка 1") вказує на кінець дробу № 1, а початок дробу №2.
- Таким чином, фракції охоплюють проміжок між галочками.
2. Завантаження зразка починається з галочки 0.
3. Десь під час фракції 5 починаємо помічати збільшення поглинання стоків колони.
- Він взяв близько (5 фракцій х 10mls на фракцію) або 50 мл від початку завантаження, поки детектор не зазначає будь-яке поглинання.
- Це добре порівнюється з тим, що обсяг колони становить близько 40 мл і є певний обсяг, пов'язаний з трубкою, що йде і виходить з колони.
- Таким чином, ця «затримка» від завантаження зразка до виявлення зразка є мертвим об'ємом системи
4. Очевидно, що якийсь матеріал не зв'язується зі смолою на етапі завантаження. Це і є проточні. Це якийсь компонент зразка, який не має спорідненості до смоли, або це означає, що ми перевищили ємність смоли?
- Якщо ми перевищили ємність смоли, то проточний буде мати A 280, подібний до завантажуваного зразка
- Крім того, до перевищення потужності, потік матиме деяку характеристику A 280, яка потім перейде на інший A 280 (завантажений зразок), що призведе до подвійної плато хроматограми.
- У наведеному вище експерименті проточні плато навколо А 280 = 0,5 або близько 25% поглинання навантаження. Це, здавалося б, вказує на те, що компонент або компонент (и), що представляє одну чверть нашого зразка, не має спорідненості до смоли в колонці
5. Навколо фракції 9 починаємо промивати колонку.
- Це має сенс, оскільки завантажено 9 дробів x 10mls на дріб = 90 мл, і це еквівалентно нашому вихідному об'єму вибірки (тобто весь зразок завантажений)
- Колонку, як правило, промивають, використовуючи ті ж буферні умови в зразку білка.
6. Навколо дробу 14 відзначимо, що А 280 починає зменшуватися.
- Це має сенс, враховуючи, що ми визначили мертвий об'єм системи приблизно 50 млс або 5 фракцій. Таким чином, спостерігається промивка, яка була розпочата на фракції 9 для зменшення поглинання навколо фракції 14.
- Продовжуємо промивання колонки до наближення А 280 0 (базова лінія). Іншими словами, весь необов'язковий матеріал в зразку був змитий
7. Після того, як A 280 повертається до базової лінії, ми починаємо наш протокол елюції. У цьому конкретному експерименті ми будемо використовувати лінійний градієнт збільшення концентрації солі (NaCl) (в промивному буфері), щоб конкурувати з матеріалом, пов'язаним з іонообмінною смолою.
8. Наша елюція дала два піки: невеликий пік, зосереджений навколо фракції 42, і більший пік, зосереджений навколо фракції 50.
- Нам доведеться проаналізувати кожен пік (і потік), щоб з'ясувати, куди подівся наш цікавий білок
- Два піки елюції досить добре вирішені. Ми могли б об'єднати дроби 40-44 і назвати, що «пік 1", і об'єднати дроби 46-55 і назвати, що «пік 2".
9. Чи залишився матеріал на колонці? Інтегровані області (тобто підсумовування A 280 кожної фракції в пулі) потоку, пік 1 і пік 2 такі
- Витрата через: 4
- Пік 1:2
- Пік 2:10
- Це дає загальну інтегровану площу 16. Кожна фракція становить 10 млс, тому це дає загальну A 280 = 16 x 10 = 160, що досить близько до загальної A 280 нашого завантаженого зразка.
- Іншими словами, схоже, наша хроматограма враховує всі компоненти нашого оригінального зразка.
10. Якщо наш інтерес протеїн був насправді пік 1 (а якщо наш вихід був 100%), то ця колонка забезпечила восьмикратне очищення (2 х 10/162).
Вирішення піків
- Забруднюючі піки не обов'язково будуть повністю відокремлені від піку, який містить наш цікавий білок.
- На наступному малюнку є два компоненти, які вирішуються, і вони присутні в еквівалентних кількостях (таким чином, початкова чистота становить 50%). Вихід і чистота перераховані для ситуації, коли ми повинні були об'єднати кожен пік шляхом розщеплення в середній точці між ними (в цьому конкретному прикладі врожайність і чистота однакові в кожному випадку)
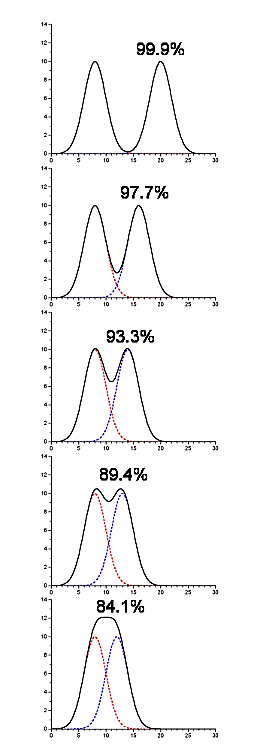.png)
Малюнок 4.1.14: Забруднення піків
- Це дає вам деяке уявлення про кількість перехресного забруднення в кожному піку як функція їх відокремлення один від одного.
- Програмне забезпечення для підгонки гаусів до хроматограми може надати цей тип інформації
Об'єднання для чистоти віршів дають
Зазвичай ви, ймовірно, об'єднаєте фракції таким чином, щоб максимізувати відновлення вашого білка, що цікавить. Однак у вас завжди є можливість об'єднання для підвищення чистоти, і якщо у вас є багато білка для роботи з цим може дозволити вам досягти бажаної чистоти з меншою кількістю кроків. Ось приклад того, як це робиться:
.png)
Малюнок 4.1.15: Вихід проти чистоти
- Це все та ж хроматограма, однак, ми можемо об'єднати їх по-різному, щоб отримати кращу чистоту (за рахунок врожайності)
- Синій пік - це пік інтересу, і він не вирішується від забруднюючого піку (червоним кольором).
- Вертикальна лінія представляє крайню ліву фракцію, яку ми використовуємо для об'єднання піку (ми об'єднуємо всі дроби праворуч від вертикальної лінії, щоб отримати наш білок, що цікавить)
- На останній панелі ми бачимо, що ми можемо досягти чистоти близько 98,8%, якщо ми готові розлучитися з половиною нашого білка!
Моніторинг очищення
Є кілька критеріїв. Одним з критеріїв є те, що ми не можемо покращити конкретну діяльність нашої вибірки. Ця величина відноситься до функціональної активності нашого зразка по відношенню до загальної концентрації білка зразка.
- На початкових етапах очищення це значення буде низьким (не велика активність по відношенню до загальної кількості білка).
- Ця величина буде збільшуватися після кожного етапу очищення, оскільки ми видаляємо інші білки з проби.
- У якийсь момент конкретна діяльність буде плато, і за визначенням, якщо вона чиста, ми не можемо збільшити конкретну активність.
- Може бути опубліковане значення для конкретної діяльності, з якою ми можемо порівняти нашу.
Також кожен етап очищення повинен контролюватися гелевим електрофорезом.
- На початкових етапах очищення ми, ймовірно, побачимо різноманітні смуги, різної молекулярної маси, на нашому гелі.
- Після різних етапів очищення ми повинні побачити зникнення певних смуг, що супроводжуються збільшенням концентрації певної смуги (або смуг), що представляють наш білок.
- Якщо ми успішно очистили наш білок (і якщо це єдиний поліпептид), ми повинні прийти до постійної питомої активності та єдиної смуги на гелі.
- Аналітичні методи, такі як ВЕРХ або денситометричне сканування вітражного гелю, можуть дати нам кількісне уявлення про чистоту нашого кінцевого зразка.
Наступна діаграма представляє типові дані, які можна контролювати під час очищення:
|
|
|
|
|
|
|
|---|---|---|---|---|---|
| Сирий клітинний лізат |
|
|
|
||
| 30-70% Сульфат амонію вирізати |
|
|
|
|
|
| ПУЛ СЕФАДЕКС DEAE |
|
|
|
|
|
| CM Сефадекс басейн |
|
|
|
|
|
| Феніл сефароз басейн |
|
|
|
|
|
| Гель для фільтрації басейну |
|
|
|
|
|
| Спорідненість смоли типу #1 басейн |
|
|
|
|
|
| Спорідненість смоли типу #2 басейн |
|
|
|
|
|
| Повне очищення |
|
||||
| Загальна прибутковість (%) |
|
||||
