3.6: кДНК та геномні бібліотеки
- Page ID
- 7470
Виділення відповідної генетичної інформації
Замість того, щоб синтезувати потрібний ген, чи можемо ми використовувати інформацію про амінокислоти для безпосередньої ізоляції відповідної генетичної інформації?
- Існує два загальних джерела генетичної інформації:
- Геномна ДНК
- мРНК
Якщо ми розглядаємо геномну ДНК з еукаріотів, то слід врахувати кілька речей:
- Область кодування для цікавить гена може бути перервана однією або декількома інтронними областями, і, таким чином, повна область кодування може бути досить довгою.
- До першого наближення не має значення, яку тканину ми використовуємо для виділення геномної інформації, тобто вміст генома однаковий у всіх тканині.
Якщо розглядати мРНК від еукаріотів, ми можемо усвідомити наступні переваги:
- Інтрони будуть зрощені, а мРНК міститиме суміжну область кодування.
- Тканинна специфічна експресія цікавить білка може дозволити нам ізолювати відповідну мРНК на підвищених рівнях, тобто в тканині, де виражений білок, рівні мРНК значно вищі, ніж відповідні геномні рівні (молекул мРНК набагато більше, ніж копії ген).
Бібліотеки
«Бібліотека» - це зручний механізм зберігання генетичної інформації.
- Вони, як правило, або «геномна», або «кДНК» (тобто мРНК у формі ДНК) генетична інформація.
- Виведені генетичні послідовності з відповідної поліпептидної інформації можуть бути використані для ідентифікації специфічної генетичної інформації в бібліотеці.
Побудова бібліотеки кДНК
Фермент, відповідальний за це, є РНК-залежна ДНК-полімераза, яка називається зворотною транскриптазою.
- Зворотні транскриптази традиційно виділяються з вірусів, геном яких насправді знаходиться у формі РНК і повинен бути перетворений в дуплексну ДНК.
- Ці віруси, як правило, несуть функціональну зворотну транскриптазу разом із їх генетичним компонентом мРНК, коли вони заражають клітини.
- Однією з найбільш поширених комерційно доступних зворотних транскриптаз є вірус лейкемії мишей Молоні (MMLV).
- Ця РНК-залежна ДНК-полімераза (як і всі полімерази) додають нуклеотиди до нацентного полінуклеотиду в напрямку від 5 до 3', використовуючи РНК як шаблон. Він не містить жодної активності 3'->5' екзонуклеази (коректури).
MMLV використовуватиме мРНК як шаблон, але вимагає ґрунтовки (він може розширити праймер ДНК, але не може синтезувати його).
- Однією з дійсно акуратних речей про еукаріотичної мРНК є наявність треків 3 'полі А.
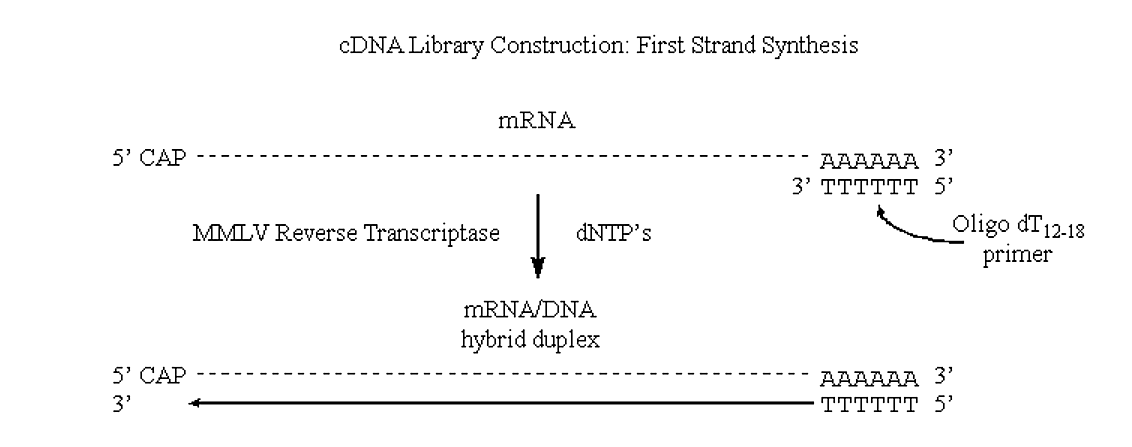.png)
Якщо ми зможемо ввести «нікс» в РНК половину цього дуплексу ДНК/РНК, то ситуація буде дуже схожа на ситуацію, яка спостерігається при синтезі «відстаючої нитки» геномної ДНК прокаріотів.
- Ніки в РНК половини молекули можуть бути введені за допомогою дії ферменту РНАзи H.
- Цей фермент проявляє ендонуклеолітичне розщеплення фрагменту РНК гібридів РНК/ДНК, а також активність екзорибонуклеази 5'->3' та 3'->5'.
- Іншими словами, він викличе РНК, а потім перейде до перетравлення назад в обох напрямках:
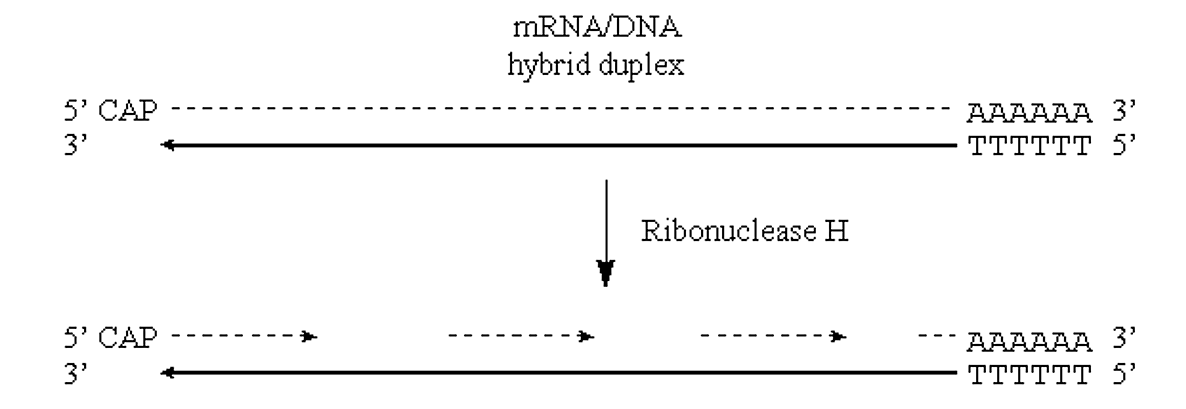.png)
- Ці фрагменти РНК тепер можуть служити праймерами для синтезу ДНК E. coli Pol I. Цей фермент також переведе «нікс» для ефективного видалення праймерів РНК:
.png)
Малюнок 3.6.3: Синтез ДНК
Введення кДНК в плазміду.
Щоб завершити нашу побудову корисної бібліотеки кДНК, нам потрібен спосіб підтримки та поширення нашої кДНК.
- Ми можемо досягти цього, вставивши кДНК у відповідну плазміду.
- Існує два класичних способу здійснення цього подвигу:
- Гомополімерні хвости
- Додавання компонувальника
Гомополімерні хвости
Термінальна трансфераза - це незвичайна ДНК-полімераза, виявлена тільки в типі еукаріотичної клітини, яка називається прелімфоцитом.
- У присутності двовалентного катіону фермент каталізує додавання dNTp до 3'-гідроксильних терміні ДНК.
- Коли нуклеотид, який потрібно додати, є пурином, Mg 2+ - це катіон.
- Коли нуклеотид, який потрібно додати, є піримідин, використовується Co 2+.
- Залежно від умов реакції буде додано від трьох до декількох тисяч підстав.
.png)
Малюнок 3.6.4: Термінальна трансферазна активність
- Якщо ми розрізаємо нашу плазміду, а також обробляємо її термінальною трансферазою, за винятком того, що тепер ми додамо додаткову базу до тієї, яку ми додали до нашої кДНК, ми можемо відпалити і лігувати кДНК в плазміду.
.png)
Малюнок 3.6.5: Лігування кДНК в плазміду
- Корисність вставки c-хвостової вставки кДНК в g-хвостий сайт Pst I у векторі полягає в наступному:
- Пост I розпізнавання послідовність і місце розщеплення
5' C T G C A G
3' G A C G G T C 5' - Розщеплення цього сайту по Pst I, а потім G-tailing буде виробляти
5' C T G C A (G) n G
3' G (G) n A C G T C 5'
компонувальники
Альтернативний метод вставки фрагментів кДНК в бібліотечний вектор полягає в додаванні «лінкерів».
- Лінкери - це короткі олігонуклеотиди (~ 18 до 24 мерів), які, як правило, паліндромні і містять одну або повторну послідовність розпізнавання ендонуклеази обмеження.
- Паліндромний характер дозволяє лінкеру олігонуклеотиду самогібридизуватися, утворюючи тупий дуплекс.
- Якщо кінці фрагментів кДНК тупі, то компоновщик може бути перев'язаний в обидва кінці, щоб ввести корисні термінальні місця обмеження.
Етапи додавання компонувальника такі:
- Лікування кДНК нуклеазою S1 (для видалення можливого 5' фрагмента мРНК ковпачка, що залишився в дуплексі кДНК
- Перетворіть потенційні «рвані» кінці в тупі за допомогою обробки Pol I (заповнить 5' звіси і пережовувати 3' звіси)
- Метилатна кДНК на потенційних внутрішніх ділянках Eco RI шляхом лікування метилазою Eco RI (плюс S-аденозилметіонін)
- Лігатуючі лінкери до тупої метильованої кДНК за допомогою Т4 ДНК-лігази
- Вирізати компонувальники з обмеженням Eco RI ендонуклеази
- Видалення фрагментів компоновки з фрагментів кДНК методом електрофорезу агарозного гелю
- Лігатувати кДНК на векторний фрагмент ДНК (відкритий ендонуклеазою рестрикції Eco RI)
Редакційна примітка
Цей підручник був опублікований в 1998 році. Проект «Геном людини» був завершений у 2003 році.
Бібліотеки геномних ДНК
Розмір деяких геномів і хромосом:
|
|
|
| (дріжджова хромосома 3) |
|
| Геном кишкової палички (бактерії) |
|
| Найбільша дріжджова хромосома тепер відображена |
|
| Весь геном дріжджів (завершено 5/96) |
|
| Найменша хромосома людини (Y) |
|
| Найбільша хромосома людини (1) |
|
| Весь геном людини |
|
- Геном людини містить приблизно 50 000 унікальних генів в межах 3-4 мільярдів пар основ ДНК, розкиданих приблизно в 23 парах хромосом.
Фрагментація геномної ДНК для побудови бібліотеки
Обмеження ендонуклеази травлення
- Шість різаків (наприклад, Eco RI) буде скорочувати в середньому кожні 4,1 Кб. Повне перетравлення ДНК людини цим типом ферменту призведе до отримання приблизно 1 х 10 6 унікальних фрагментів.
- Яка ймовірність знаходження клону в межах заданої бібліотеки?
Точну ймовірність наявності будь-якої заданої послідовності ДНК в бібліотеці можна обчислити за рівнянням
Наприклад, наскільки велика бібліотека (тобто скільки клонів) вам знадобиться для того, щоб мати 99% ймовірність знайти потрібну послідовність, представлену в бібліотеці, створеній травленням за допомогою 6-різака?
Таким чином, з цього типу аналізу ми бачимо, що нам потрібна технологія, яка дозволить нам досягти наступного:
- Стабільна вставка відносно великих фрагментів ДНК в наш вектор клонування
- Висока ефективність вставки і здатність обробляти велику кількість клонів
- Наприклад, при нанесенні колоній кишкової палички на 3-дюймову пластину Петрі максимальна практична щільність, що дозволяє ізолювати окремі колонії, становить близько 100-200 колоній на тарілку.
- Якби ми спробували розмістити нашу бібліотеку 3,37 х 10 6 таким чином, потрібно було б близько 22,500 пластин.
- Мало того, але такі великі фрагменти ДНК погано переносяться у типових векторах клонування кишкової палички, таких як PBr322.
Бактеріофагові лямбда-вектори зазвичай використовуються для побудови геномних бібліотек
Бактеріофаг l - це фаг кишкової палички з типом ікосаедричної фагової частинки, яка містить вірусний геном:
.png)
Малюнок 3.6.6: Бактеріофаза л
- Під час реплікації ДНК фагів виробляється в конкатамерній формі, яка розщеплюється відповідними ендонуклеазами, щоб забезпечити упаковку одного генома в межах фагового капсиду.
- Встановлено, що внутрішні ділянки генома фагів, які не були суттєвими для реплікації фагів, можуть бути видалені та замінені цікавою ДНК.
- Ця гібридна ДНК може бути ефективно упакована та утворювати інфекційний фаг.
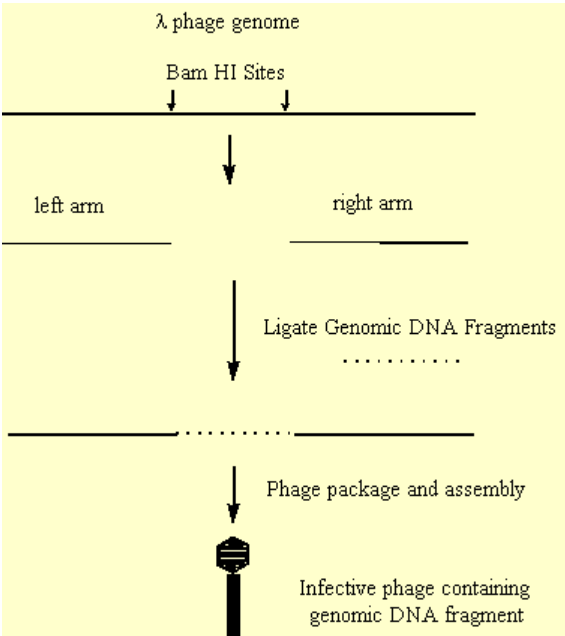.png)
Малюнок 3.6.7: Створення неефективного фага
Перевагами цього типу системи проти плазмід, таких як PBR322 є:
- Геном фагів здатний ефективно упаковувати з вставками ДНК розміром до 20 Кб.
- Крім того, фаги упаковані дуже інфекційні і заражають кишкову паличку з набагато більшою ефективністю, ніж плазмідні методи перетворення.
Неповне перетравлення геномної ДНК дозволить ідентифікувати перекриття послідовності
Повне травлення ендонуклеазою призведе до створення бібліотеки, що не містить фрагментів, що перекриваються:
Однак неповне перетравлення призведе до бібліотеки, що містить фрагменти, що перекриваються:
- Таким чином, інформація про послідовність, отримана з одного клону, дозволить ізолювати клони, що містять сусідню (перекривається) інформацію послідовності.
- Це може дозволити отримати великі суміжні ділянки інформації про послідовність («Хромосомна ходьба»).
Бібліотеки зондування
Після побудови бібліотеки (кДНК або геномної) ми хочемо мати можливість ідентифікувати клони, які містять ДНК, що цікавить.
- Наприклад, з інформації про послідовність білків ми можемо вивести можливі розтяжки відповідної послідовності ДНК (однак буде неоднозначність через виродження кодонів).
- Якщо ми можемо синтезувати олігонуклеотид, що доповнює нашу послідовність ДНК, що цікавить, ми можемо використовувати його спеціально для гібридизації до відповідного клону в нашій бібліотеці (тобто для зондування нашої бібліотеки).
У стандартних методологіях олігонуклеотид фосфорилюється на кінці 5' з радіомаркуванням g 32 P-ATP і T4 полінуклеотидкіназою.
- Потім зонд інкубують з окремими фаговими бляшками, які були закріплені на нітроцелюлозі та денатурації їх ДНК шляхом обробки основою.
- Якщо бляшка містить комплементарну ДНК до послідовності зондування, зонд буде гібридизуватися.
- Якщо нітроцелюлоза (що містить багато окремих бляшок) піддається впливу рентгенівської плівки, то з'являться лише ті бляшки з гібридизованим зондом (як темна пляма):
.png)
Малюнок 3.6.8: Радіомаркована бляшка
Помилкові спрацьовування
Якщо ми розробляємо зонди ДНК з інформації про послідовність білків, ми матимемо можливу неоднозначність у нашій виведеній послідовності ДНК, яка використовується для проектування зонда.
- Зазвичай 14-24mer олігонуклеотиди використовуються як зонди, 14-24mer зонд означає, що нам потрібна розтяжка 5-8 амінокислот у поліпептиді.
- Враховуючи вибір, найкращі послідовності амінокислот, які слід шукати в поліпептиді, - це ті, що мають низьку дегенерацію кодонів (див. Вище).
- Таким чином, ми шукали б короткий відрізок поліпептидної послідовності, сподіваюся, що містить Met або Trp, і з рештою амінокислот, що містять або Phe, Tyr, His, Gln, Asn, Lys, Asp, Glu або Cys.
- Слід уникати регіонів, включаючи Леу, Арг або Сер (6 кодонів кожен).
Під час синтезу олігонуклеотидів кілька основ будуть включені в неоднозначних положеннях.
- Таким чином, наш зонд насправді буде сумішшю олігонуклеотидів.
- Чим вище виродження, тим більша можливість «помилкових спрацьовувань», тобто клонів, які гібридизуються, але не пов'язані з фактичною послідовністю, яку ми хочемо.
- Позитивні клони секвенуються, а виведена послідовність амінокислот порівнюється з нашою інформацією про послідовність поліпептидів для виявлення правильних клонів.
Антитіла (імуноглобуліни)
Якщо конкретний вектор або фаг, який використовується для побудови бібліотеки кДНК, містить область промотора вище за течією сайту вставки, ми можемо відстежувати бажані клони, шукаючи вираження цікавить білка.
- У цьому випадку нам потрібен аналіз, який є як чутливим (ми не будемо виробляти багато білка), так і специфічний (ми хочемо мінімізувати будь-які помилкові спрацьовування).
- Один з найкращих аналізів, який є одночасно чутливим і специфічним, використовує антитіла.
Антиген, антитіла, епітоп
Одним із захисних механізмів хребетних є здатність розрізняти молекули себе і не самоврядування.
- Таким чином, якщо чужорідна молекула (або від іншого виду, або іноді від іншої особини всередині виду) вторгається в організм хребетних, імунна система функціонує, щоб навчитися ідентифікувати цю молекулу.
- У майбутніх інвазіях тієї ж молекули організм встановлює захист від неї, виробляючи специфічні антитіла, які розпізнають і зв'язуються з чужорідним антигеном.
- Коли антитіла зв'язуються з антигеном певні лейкоцити (макрофаги і моноцити) розпізнають вторгнене тіло як чужорідне і реагують, руйнуючи його.
Антитіла - це молекули у формі «Y», які містять дві однакові важкі ланцюги та дві однакові легкі ланцюги.
- Стебло 'Y' містить домен Fc (константа), а «руки» з 'Y' містять Fab (змінні) домени.
- Антигени зв'язуються з регіонами, що визначають комплементарність (CDR), розташованими на кінцях доменів Fab.
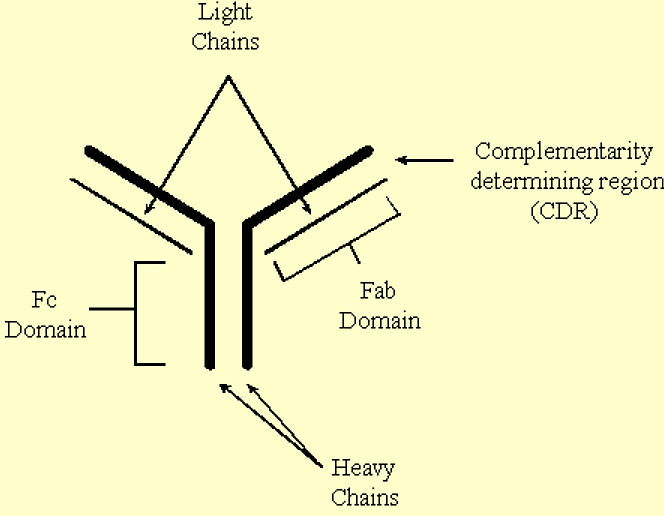.png)
Малюнок 3.6.9: Структура антитіл
Антитіла синтезуються В-лімфоцитами. Кожен В-лімфоцит здатний виробляти один тип антитіл, спрямованих проти конкретного структурного детермінанта, або епітопу, на антиген.
- Таким чином, імунна відповідь на білковий антиген може призвести до популяції В-лімфоцитів, кожен з яких виробляє антитіла, які розпізнають інший структурний детермінант чужорідного білка.
- Епітоп може бути суміжною областю 5 або 6 амінокислот у чужорідному поліпептиді, або епітоп може містити півтора десятка або близько того амінокислот, внесених у зіставлення в нативному білку, але широко розташовані в послідовності поліпептидів.
- Таким чином, деякі антитіла однаково добре розпізнають нативну і денатуровану форми чужорідного білка, тоді як інші антитіла можуть розпізнавати лише ту чи іншу.
Якщо цікавий білок був очищений, його можна використовувати для індукування імунної відповіді у тварини-господаря.
- Типові тварини-господаря включають миша, курка, кролик, коза, овець, кінь і іноді людина.
- Після початкової імунізації з подальшим одним або декількома бустерними знімками В-лімфоцити тварини-господаря можуть виробляти антитіла, спрямовані проти антигену.
- Антитіла можуть бути очищені від зразків крові, вилучених у тварини. Такі препарати антитіл, як кажуть, поліклональні.
- Це стосується того, що присутні антитіла є з колекції різних В-лімфоцитів і, таким чином, розпізнають безліч різних епітопів на білку антигену.
- Здатність виділяти антитіла із зразків крові означає, що тварина-господар не потребує знищення.
- Звичайно, розмір тварини визначає, скільки антитіл можна отримати. Наприклад, кролик може забезпечити 5 мл крові кожні два тижні, миша забезпечує значно менше, в той час як кінь може забезпечити зовсім трохи більше.
Антитіло, виділене з однієї популяції клітин В-лімфоцитів, називається моноклональним.
- Він розпізнає єдиний епітоп на антигенному білку.
- Антитіла, що продукують В-лімфоцити, можуть бути виділені з селезінки або з лімфатичних вузлів. Однак вони мають кінцевий термін життя в культурі, тобто вони зазнають певної кількості поділів клітин, а потім гинуть.
- Однак ці клітини можуть бути злиті з безсмертними (раковими мієломними) лімфоцитами для отримання гібридомної клітини.
- Така клітина безсмертна, як мієлома, і виробляє специфічне антитіло з В-лімфоцита. Здатність до нескінченності рости в культурі дозволяє виділяти корисні кількості специфічних моноклональних антитіл.
Іноді імунізація білком, що цікавить, є проблематичною: відповідні кількості очищеного матеріалу не можуть бути вироблені, або білок сам по собі токсичний на рівні дозування, необхідному для вироблення імунної відповіді.
- Якщо відома інформація про часткову послідовність, то великі кількості поліпептидів, що представляють короткі фрагменти білка, можуть бути синтезовані і використані для імунізації тварини.
- Часто ці поліпептиди ковалентно прикріплюються до білка носія (зазвичай сироваткового альбуміну) для посилення антигенної реакції.
- Антитіла, що виробляються проти таких пептидів, розпізнають лише епітопи всередині поліпептиду. Таким чином, навіть поліклональні антитіла були б досить обмеженими у розпізнаванні епітопів.
Як і у випадку з радіопозначеними олігонуклеотидами, антитіла можуть бути використані для ідентифікації бібліотечних клонів, які містять кДНК, що цікавить. Цей метод, звичайно, буде покладатися на вектор господаря або фаг, який містить промотор вище за течією від місця введення геномної ДНК.
- Антитіла можуть бути використані для скринінгу вірусних бляшок або плазмідних клонів, які були пов'язані з нітроцелюлозою.
- Зв'язані антитіла можуть бути ідентифіковані за допомогою радіомаркованого білка А (який зв'язується з імуноглобулінами) або через друге антитіло (яке, як і білок А, може розпізнавати загальні імуноглобуліни), яке має барвник або барвник, що вивільняє фермент ковалентно прикріплений.
